Слайд 1Экспериментальные методы исследований
доктор физико-математических наук
Власова Ольга Леонардовна
Санкт-Петербург
Слайд 2
УФ- и видимая спектрофотометрия
Поглощение света: основные законы,
правила, понятия и
определения
Процессы поглощения света веществом описываются рядом законов и подчиняются определенным
правилам, а именно:
1) Закон Гротгуса Дрейпера: химически активным является излучение с такими длинами волн, которые поглощаются веществом. Закон не имеет исключений.
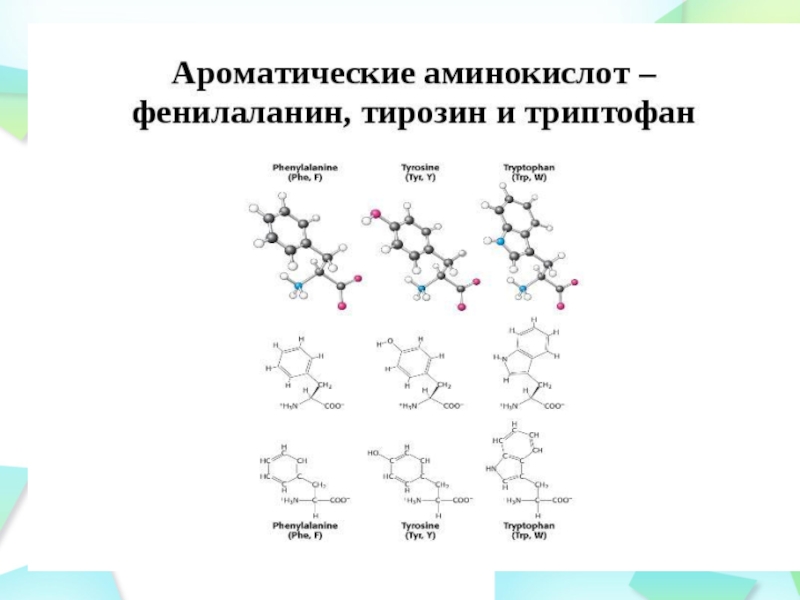
Группы атомов, поглощающих кванты света в УФ- и видимой области спектра, называют хромофорами. Основными хромофорами в белках являются остатки ароматических аминокислот (фенилаланин, тирозин, триптофан), в нуклеиновых кислотах – пуриновые и пиримидиновые азотистые основания (аденин, гуанин, тимин, цитозин и урацил).
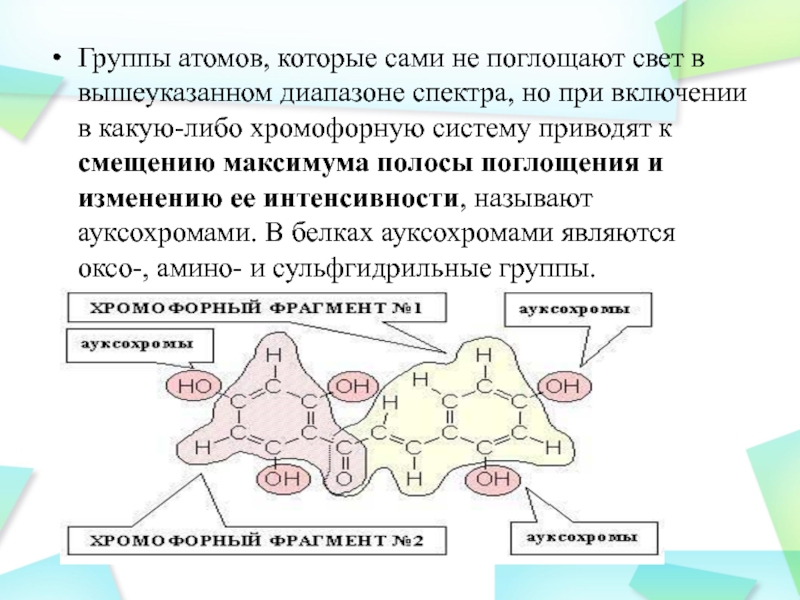
Слайд 5Группы атомов, которые сами не поглощают свет в вышеуказанном диапазоне
спектра, но при включении в какую-либо хромофорную систему приводят к
смещению максимума полосы поглощения и изменению ее интенсивности, называют ауксохромами. В белках ауксохромами являются оксо-, амино- и сульфгидрильные группы.
Слайд 6 2) Закон фотохимической эквивалентности Эйнштейна Штарка: каждый поглощенный квант
света способен химически и энергетически видоизменить (активизировать) только одну молекулу.
3) Закон Вант Гоффа: количество химически измененного светом вещества прямо пропорционально количеству поглощенной веществом энергии света.
4) Правило Бунзена Роско: химическое действия света (излучения) прямо пропорционально произведению интенсивности света на время его действия.
Слайд 7 5) Закон Бугера-Ламберта -Бера для монохроматического света: если интенсивность падающего
светового потока равна , то интенсивность светового потока
после поглощения бесконечно тонким слоем вещества , будет равняться:
где – концентрация вещества, – молярный коэффициент экстинкции (поглощения), который характеризует способность молекул вещества
поглощать свет с длиной волны .
Слайд 96) Процесс потери фотонов света при прохождении его через вещество, которое
не люминесцирует, не зависит от интенсивности падающего света
в широких пределах изменения последней (примерно в 1020 раз). Эта закономерность установлена исследованиями С.И. Вавилова.
7) Количество энергии , поглощенной одним молем вещества , определяется по формуле:
где – постоянная Авогадро, равная 6,023·1023;
– постоянная Планка; – скорость света в вакууме,
– частота света; – длина волны или
Слайд 10 8) Число квантов, поглощенное веществом в единицу времени, будет равно
,
где – количество энергии, поглощенное веществом в единицу времени.
Следовательно, согласно закону Эйнштейна-Штарка воздействию света должны подвергнуться
молекул.
Слайд 11Установлено, что число поглощенных квантов и количество прореагировавших молекул в
биологических объектах не всегда совпадает. Квантовый выход
отношение числа прореагировавших молекул к числу молекул, поглотивших фотоны , т.е.
Для большинства сложных фотохимических процессов,
протекающих в биообъектах, значительно меньше 1.
Физический смысл термина поперечное сечение поглощения состоит в том, что это эффективное сечение молекулы, при попадании в которое происходит поглощение фотона света с данной длиной волны
.
Слайд 12 Спектры оптической плотности
биологических систем
Способность молекул поглощать свет лежит в
основе спектрофотометрии, широко используемой в биологии и медицине для качественного
и количественного анализа, а также для выяснения химической структуры веществ. Как и рассеяние, поглощение света проявляется в ослаблении светового потока при прохождении через исследуемый объект, и оно тем больше, чем выше концентрация вещества ( , моль/л), оптическая длина пути ( , см), способность вещества к поглощению.
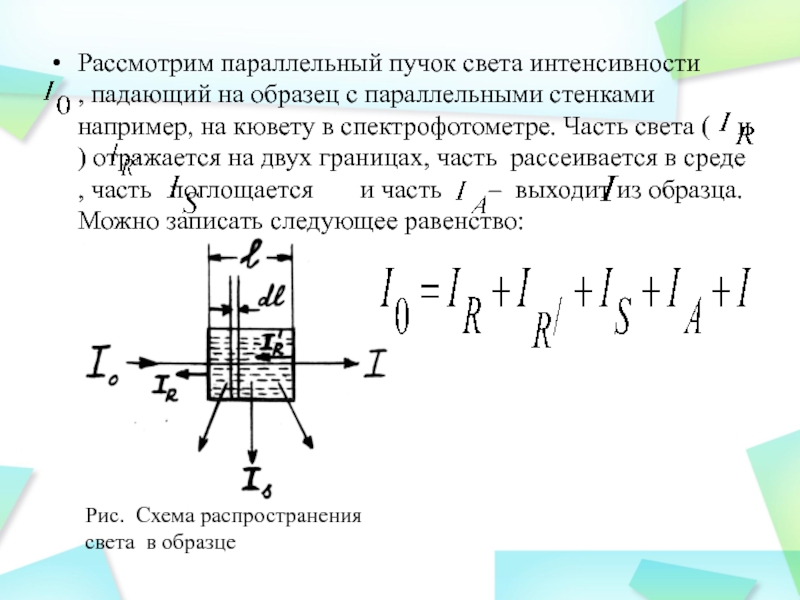
Слайд 13Рассмотрим параллельный пучок света интенсивности ,
падающий на образец с параллельными стенками например, на кювету в
спектрофотометре. Часть света ( и ) отражается на двух границах, часть рассеивается в среде , часть поглощается и часть – выходит из образца. Можно записать следующее равенство:
Слайд 14Когда ослабление потока определяется только числом поглощающих молекул, находящихся на
его пути и не зависит от абсолютной величины потока и
взаимного влияния частиц, можно получить два основных закона поглощения, подтверждаемых опытом:
Каждый тонкий слой постоянной толщины внутри однородной среды поглощает определенную долю входящего в него потока монохроматического излучения – закон Бугера Ламберта. Открыт экспериментально французским ученым П. Бугером в 1729 г. и обоснован теоретически немецким ученым И.Г. Ламбертом в 1760 г.
Поглощение данным тонким слоем пропорционально числу поглощающих частиц, содержащихся в нем, т.е. их концентрации, – закон Бера (Беера). Этот закон сформулирован для растворов немецким ученым А. Бером в 1852 году. Не выполняется для больших концентраций.
Слайд 15Оптические и химические свойств системы, которым она должна удовлетворять, чтобы
соблюдался закон Бугера Ламберта Бера :
параллельность и монохроматичность
падающих лучей;
независимое поведение поглощающих частиц, отсутствие агрегации при высоких концентрациях;
беспорядочная ориентация поглощающих частиц.
где ( – оптическая плотность).
Слайд 16Поглощение света молекулой носит резонансный характер и велико только тогда,
когда частота колебаний света близка к одной из собственных частот
молекулы, т.е. энергия кванта света близка к разности энергий одного из возбужденных и основного состояния молекулы. Молекулы состоят из валентных электронов и атомных остовов – ионов.
Для электронов характерна частота 1015 с1 , для ионов, которые примерно в 104 раз тяжелее – 1013 с1 . Это соответствует длинам волн – 0 ... ,1 мкм и 10 мкм, следовательно, электронные колебания (переходы) должны возбуждаться ультрафиолетовым (УФ) светом, колебания ионов – инфракрасным.
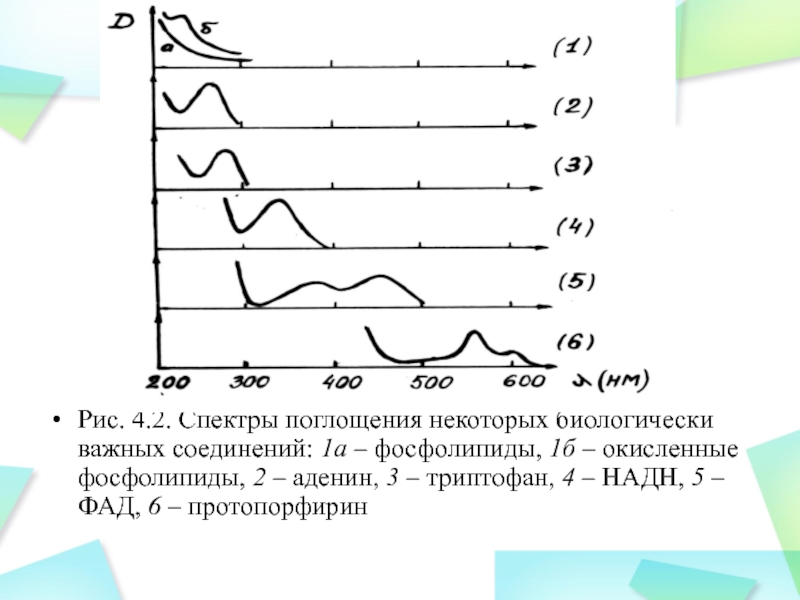
Слайд 17
Рис. 4.2. Спектры поглощения некоторых биологически важных соединений: 1а –
фосфолипиды, 1б – окисленные фосфолипиды, 2 – аденин, 3 –
триптофан, 4 – НАДН, 5 – ФАД, 6 – протопорфирин
Слайд 18В молекулярной спектроскопии принято следующее условное деление спектра электромагнитного излучения:
ниже 280 нм – далекая или вакуумная УФ-область, 400700 нм
– видимая область, 0,7–2,5 мкм – ближняя инфракрасная (ИК) область; 2,5–50 мкм – средняя ИК-область и 50–2000 мкм – далекая ИК-область.
В ИК-области полосы поглощения, связанные со структурой молекул белков и полипептидов, располагаются в пределах 2,516 мкм.
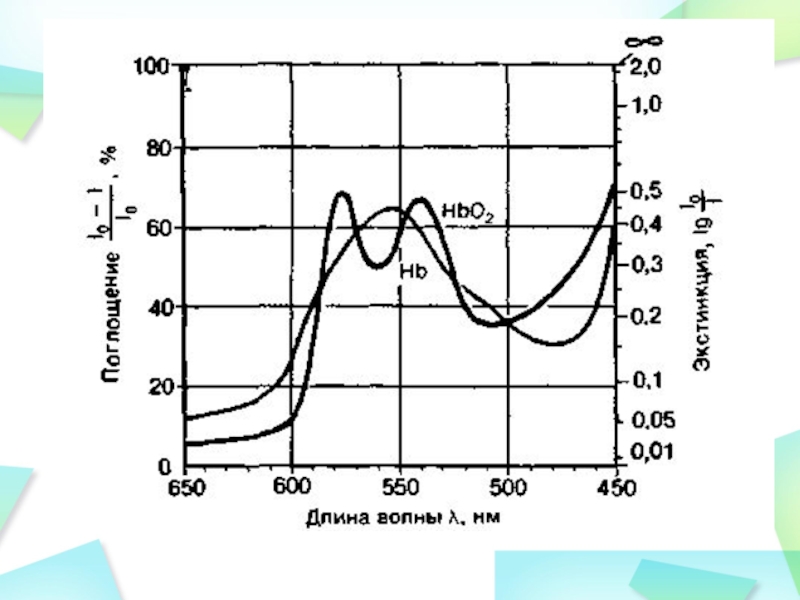
В видимой области поглощают свет окрашенные белки, хромо- протеиды, содержащие в своем составе пигмент. Примерами хромо- протеидов являются белки, содержащие так называемое гем –порфириновое кольцо с ионом железа, ярко-оранжевого цвета. К ним относятся гемоглобин, миоглобин, цитохромы, каталаза и пероксидаза.
Слайд 19Воспринимаемый нами цвет окрашенных объектов есть результат избирательного поглощения красителем
определенных участков в непрерывном спектре падающего белого цвета
Цвет и видимый спектр
поглощения
(в более общем случае –
спектр ослабления)
Слайд 20В УФ-области корреляция между положением различных полос поглощения и определенными
химическими структурами была обнаружена примерно в 1885 году. По мере
получения все новых данных, было установлено, что полосы поглощения соединений, содержащих только насыщенные связи (одинарные), находятся обычно в области длин волн короче 200 нм. Вследствие недоступности для исследования эту область называют хвостом поглощения.
У соединений с одной ненасыщенной связью (типа С=С или С=N) полосы поглощения, как правило, слабые, они находятся в области 190 300 нм, причем их положение зависит от химического строения смежных участков молекулы.
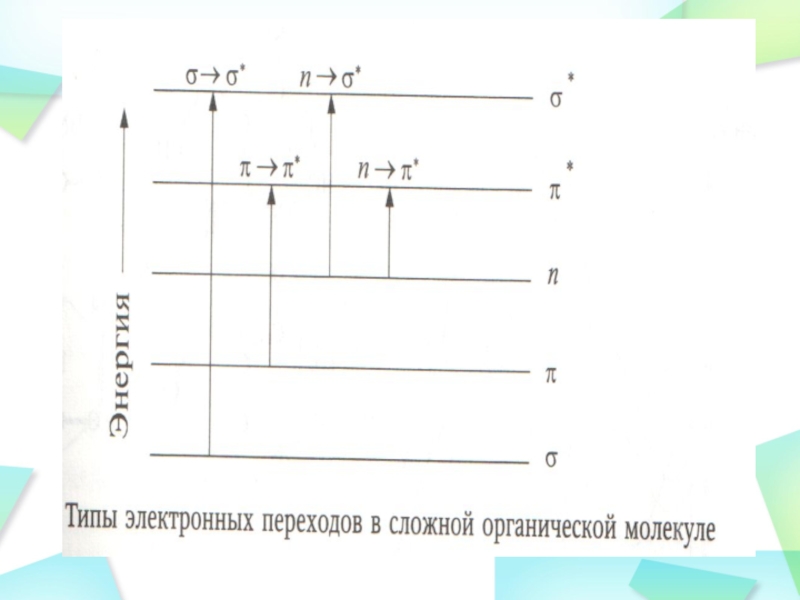
Слайд 21Сильные полосы поглощения в области 200 400 нм всегда
соответствуют структурам, содержащим сопряженные двойные связи. Поглощение видимого и ультрафиолетового
света происходит, главным образом, с участием и n-электронов ( * и n* переходы). Чем длиннее система сопряженных двойных связей в молекуле, т.е. чем сильнее делокализованы по молекуле -электроны, тем при большей длине волны располагается самый длинноволновый максимум поглощения.
Слайд 24Особенно сильно поглощают свет многие кольцевые структуры с сопряженными двойными
связями, причем в этих случаях на величину поглощения существенно влияет
присоединение боковых цепей или добавочных групп, особенно, если последние заряжены (например, –NH2 и – ОН). Такие группы влияют на положение, структуру и интенсивность полосы поглощения сопряженной системы
Спектры поглощения ароматических аминокислот : а – триптофан (1) и фенилаланин (2); б – тирозин при рН 2 (1) и РН 12 (2)
Слайд 25В клетках основными поглощающими УФ-свет структурами являются белки и нуклеиновые
кислоты. Все белки, кроме протаминов, имеют широкую полосу поглощения вблизи
275 278 нм. Эта полоса целиком связана с поглощением света сопряженными ядрами тирозина, фенилаланина, триптофана.
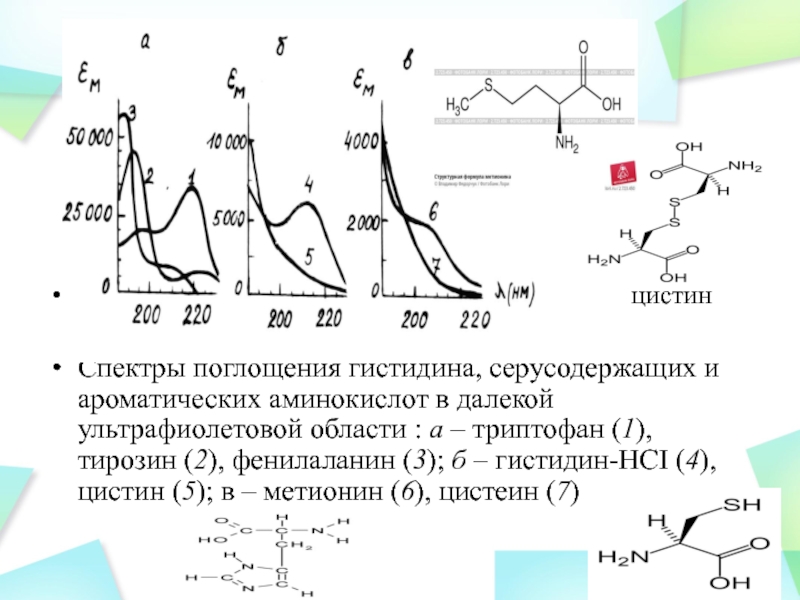
Коэффициент экстинкции каждого белка при 280 нм зависит от количества в нем хромофорных групп, содержащих сопряженные -электроны, с возбуждением которых связана данная полоса поглощения, для возбуждения -электронов требуется больше энергии, и соответствующие полосы поглощения лежат в далекой УФ-области
цистин
Спектры поглощения гистидина, серусодержащих и ароматических аминокислот в далекой ультрафиолетовой области : а – триптофан (1), тирозин (2), фенилаланин (3); б – гистидин-НСI (4), цистин (5); в – метионин (6), цистеин (7)
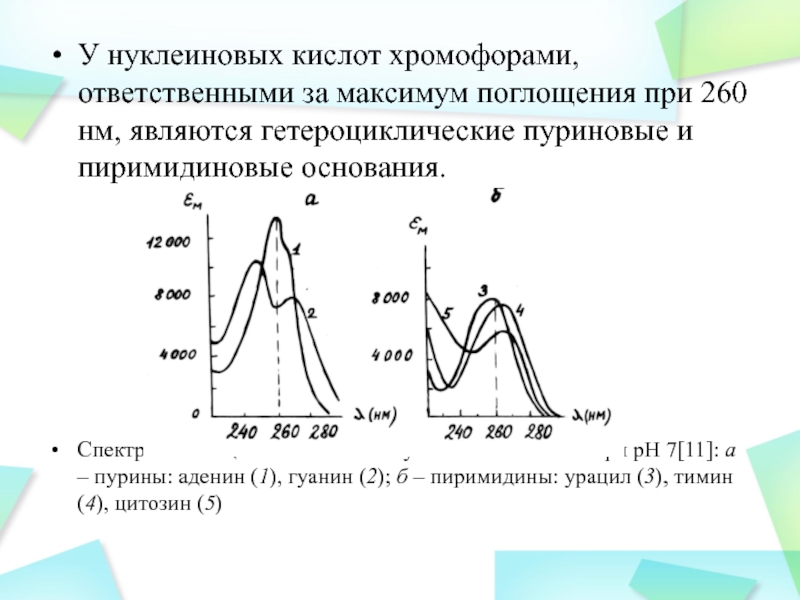
Слайд 27У нуклеиновых кислот хромофорами, ответственными за максимум поглощения при 260
нм, являются гетероциклические пуриновые и пиримидиновые основания.
Спектры поглощения оснований нуклеиновых
кислот при рН 7[11]: а – пурины: аденин (1), гуанин (2); б – пиримидины: урацил (3), тимин (4), цитозин (5)
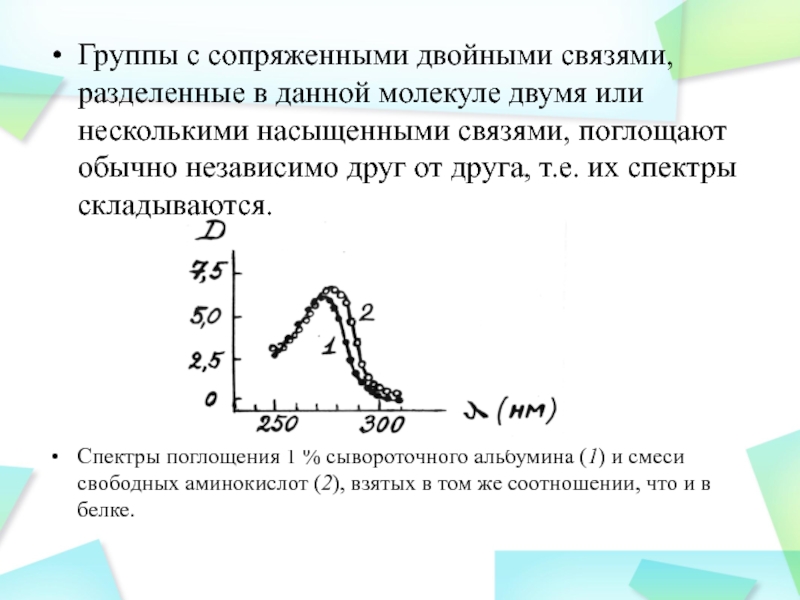
Слайд 28Группы с сопряженными двойными связями, разделенные в данной молекуле двумя
или несколькими насыщенными связями, поглощают обычно независимо друг от друга,
т.е. их спектры складываются.
Cпектры поглощения 1 % сывороточного альбумина (1) и смеси свободных аминокислот (2), взятых в том же соотношении, что и в белке.
Слайд 29Однако в случае больших полярных макромолекул УФ-спектр поглощения полимера не
всегда можно представить как сумму спектров составляющих его мономеров. Такую
неаддитивность поглощения часто называют гипохромным или гиперхромным эффектом. Оба термина означают по существу одно и то же, но имеется некоторое различие в их количественной характеристике. Если хотят сказать, что оптическая плотность данного олигонуклеотида меньше оптической плотности составляющих его мононуклеотидов, то это называют гипохромным эффектом. Если же важно подчеркнуть, что при гидролизе олигонуклеотида оптическая плотность увеличивается, то тогда это называется гиперхромным эффектом. Это явление было обнаружено сначала у нуклеиновых кислот и значительно позднее у полипептидов и белков.
Слайд 30Суммарное поглощение полностью денатурированной ДНК почти равно суммарному поглощению эквивалентного
числа соответствующих свободных мононуклеотидов. Существует прямая зависимость между относительным возрастанием
поглощения при 260 нм при тепловой денатурации ДНК и содержанием пар А Т в ДНК: возрастание поглощения тем больше, чем выше содержание пар А Т.
Спектры поглощения клубкообразной (а) и спиральной (б) ДНК тимуса теленка в Д2О
Слайд 31Таким образом, нуклеотидный состав препарата ДНК в принципе можно определить
путем спектрофотометрического измерения степени гиперхромного эффекта при нагревании раствора ДНК.
Гипохромизм
двухцепочечных молекул ДНК обусловлен электронными взаимодействиями между основаниями вдоль оси нативной двуспиральной структуры, приводящими к уменьшению вероятности поглощения света каждым основанием. Разрушение двухцепочечной структуры приводит к значительному ослаблению этих взаимодействий, и в такой менее экранированной форме основания, входящие в состав ДНК, поглощают света столько, сколько и свободные основания.
Слайд 32Для белков гипохромный эффект наблюдается в полосе поглощения пептидной связи
– С – NH – , центр которой расположен в
районе 190 нм.
На рисунке изображена кривая коэффициента экстинкции полиглутаминовой кислоты в спирализованном (1), рН 4,0 и аморфном состоянии (2), рН 7,2. В спирализованном состоянии экстинкция пептидных групп оказывается ниже на 42 %, а положение максимума поглощения почти не смещается. Гипохромный эффект может служить прямой мерой упорядоченности или степени спиральности белков.
Слайд 33Изменение любого фактора, затрагивающего электронную конфигурацию поглощающей молекулы, вызывает изменение
спектра поглощения. Экспериментальные условия, при которых проводятся измерения, также влияют
на вид спектра.
Положение, ширина
и интенсивность полос
поглощения могут зависеть
в частности от природы
растворителя.
Так при увеличении концентрации
щелочи в спектрах поглощения
триптофана появляется
и растет новая полоса при
310 330 нм.
Эти изменения в спектрах
обратимы и связаны с ионизацией
иминогруппы индольного кольца.
Спектры поглощения триптофана в растворах NaOH .
Обозначения: концентрация NaOH – 1,0 М (1); 11,0 М (2); 16,0 М (3)
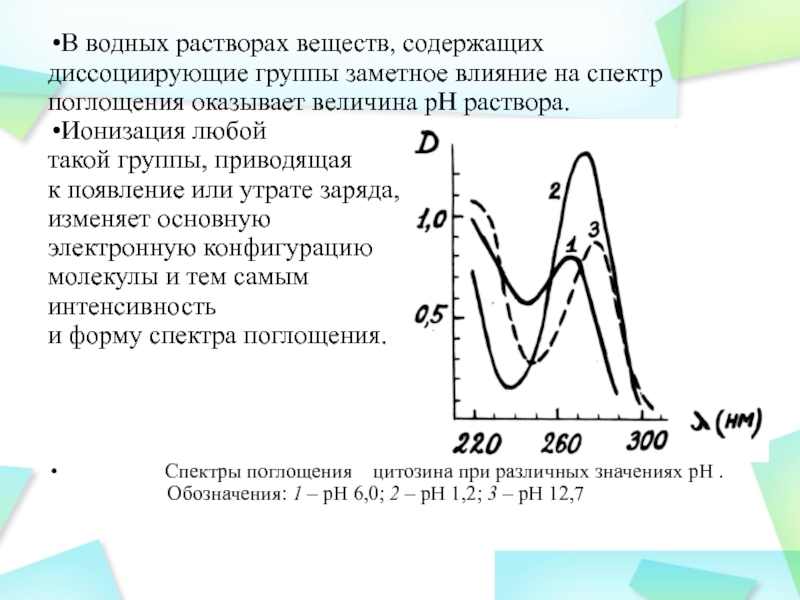
Слайд 34В водных растворах веществ, содержащих диссоциирующие группы заметное влияние на
спектр поглощения оказывает величина рН раствора.
Ионизация любой
такой группы,
приводящая
к появление или утрате заряда,
изменяет основную
электронную конфигурацию
молекулы и тем самым
интенсивность
и форму спектра поглощения.
Спектры поглощения цитозина при различных значениях рН . Обозначения: 1 – рН 6,0; 2 – рН 1,2; 3 – рН 12,7
Слайд 35В общем случае ослабление светового потока при прохождении его через
дисперсную систему, если дисперсионная среда является непоглощающей, определяется поглощением в
частицах (т.е. трансформацией электромагнитной энергии в другие виды) и рассеянием на частицах. Это ослабление (экстинкция, т.е. затухание) зависит от химического состава частиц, их размера, формы, ориентации, окружающей среды, числа частиц, а также от состояния поляризации и частоты падающего света.
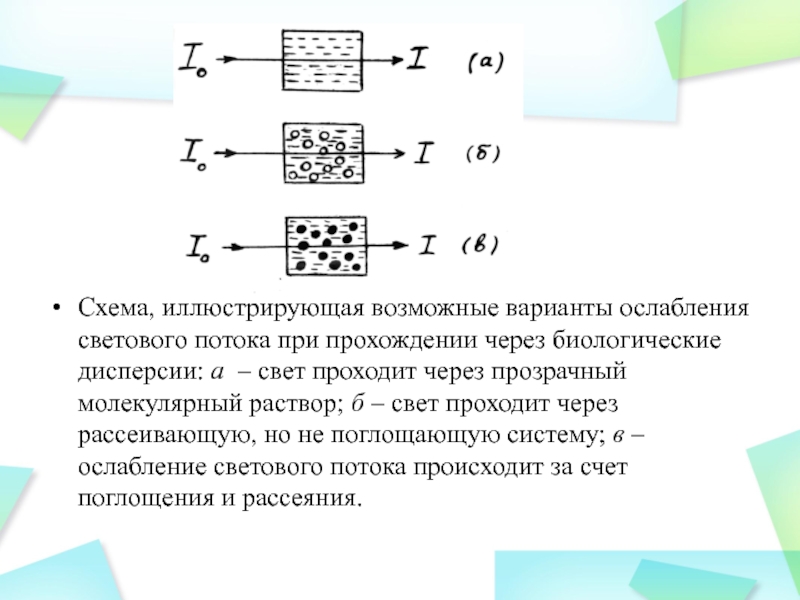
Слайд 36
Схема, иллюстрирующая возможные варианты ослабления светового потока при прохождении через
биологические дисперсии: а – свет проходит через прозрачный молекулярный раствор;
б – свет проходит через рассеивающую, но не поглощающую систему; в – ослабление светового потока происходит за счет поглощения и рассеяния.
Слайд 38
Спектры поглощения контрольного и облученных
образцов БСА. Цифрами обозначен
тип используемого лазера, после типа указано время облучения образца.