Слайд 1Электрохимические методы анализа, часть 3
Кондуктометрия. Электрогравиметрия
Слайд 26. КОНДУКТОМЕТРИЯ
Кондуктометрический метод анализа основан на измерении электропроводности раствора:
где
W - электропроводность раствора; R - сопротивление раствора.
Аналитический сигнал:
электропроводность раствора либо его сопротивление.
Сигнал формируется в межэлектродном пространстве и возникает за счёт:
диссоциации молекул на ионы;
миграции ионов под действием внешнего источника напряжения.
По этой причине методом кондуктометрии можно анализировать только растворы электролитов.
Слайд 3По способу выполнения различают
прямую кондуктометрию и
косвенную (кондуктометрическое титрование).
Слайд 4Кондуктометрическая ячейка - это стеклянный сосуд с двумя идентичными электродами,
выполняющими одинаковые функции, между которыми находится раствор электролита.
Геометрическая форма сосуда
влияет на измеряемую величину. Важнейшая характеристика кондуктометрической ячейки - это константа ячейки (сосуда) θ (тэта):
где l- расстояние между электродами;
S - площадь поверхности электродов.
Слайд 5Электроды изготавливают из платины, платинированной платины (платина, покрытая платиновой чернью)
или нержавеющей стали.
Требования к электродам. Они должны быть:
одинаковыми,
инертными,
параллельно расположенными,
жёстко закреплёнными (l = const),
с одинаковой площадью поверхности (S = const).
Слайд 6В качестве измерительных приборов используют кондуктометры (измерение электропроводности) или мосты
переменного тока (измерение сопротивления).
Слайд 7Удельная электропроводность как аналитический сигнал
Удельная электропроводность (χ - хи) -
это электропроводность 1 см3 раствора, находящегося между электродами с площадью
S = 1 см2 и расстоянием между ними l = 1 см.
Единица измерения χ - См/см. [сименс на сантиметр]
χ - определяется наличием всех ионов в растворе:
где α - степень диссоциации;
С – молярная концентрация эквивалента, моль /см3;
z+ и z- - заряды ионов;
λ+ и λ- - подвижности ионов.
Слайд 8Факторы, влияющие на удельную электропроводность:
1. Природа электролита:
степень диссоциации (α): чем больше
α, тем больше χ;
подвижности ионов электролита (λ+ и λ-): чем
больше λ±, тем больше χ;
2. Природа растворителя:
диэлектрическая проницаемость (ɛ): чем больше ɛ, тем больше χ (т. к. увеличивается α);
вязкость (η - ита): чем больше η, тем меньше χ (т.к. уменьшаются подвижности ионов λ±);
3. Температура (t°): чем больше t °, тем больше χ (т.к. увеличиваются скорость теплового движения и степень диссоциации α, а также уменьшается η).
Следовательно, измерения надо проводить при постоянной температуре.
4. Концентрация электролита (С):
в разбавленных растворах зависимость χ = f(C) - линейная;
в концентрированных - наблюдаются отклонения от линейности.
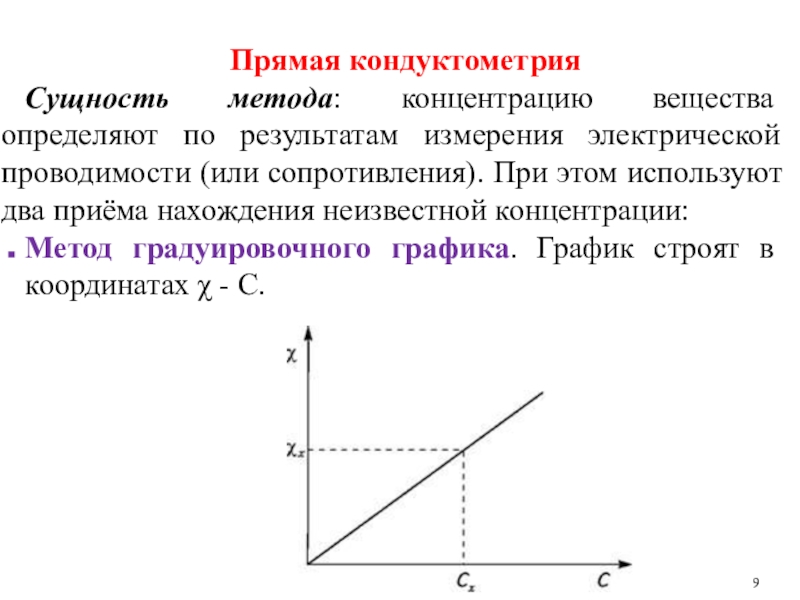
Слайд 9Прямая кондуктометрия
Сущность метода: концентрацию вещества определяют по результатам измерения электрической
проводимости (или сопротивления). При этом используют два приёма нахождения неизвестной
концентрации:
Метод градуировочного графика. График строят в координатах χ - С.
Слайд 102. Расчётный метод. Метод используют для очень разбавленных растворов. В
этом случае при С —> 0:
Таким образом, неизвестную концентрацию можно
рассчитать по измеренной величине χ и табличным значениям предельных подвижностей ионов.
λ+0 и λ-0 - предельные подвижности ионов (индивидуальные характеристики ионов, приведены в справочниках).
Слайд 11Поскольку в величину аналитического сигнала вносят вклад все ионы, присутствующие
в растворе, то применение метода ограничено из-за малой селективности.
Слайд 12Область применения прямой кондуктометрии:
анализ бинарных смесей вода - электролит;
определение общего
содержания электролитов в растворе;
контроль качества дистиллированной воды (наиболее эффективный метод
!);
контроль качества технической воды, используемой в ряде производств;
оценка чистоты органических растворителей (после экстракции примесей водой);
определение жёсткости воды;
определение влаги в техническом сырье.
Слайд 13Преимуществами метода являются простота, высокая чувствительность (до 10-4 моль/л) и
достаточная точность (2 %), а недостатком - малая селективность.
Константа ячейки
и ее определение.
При проведении прямых кондуктометрических измерений необходимо предварительно определять константу ячейки θ (тета), поскольку удельная электрическая проводимость (χ) даже при l = 1 см и S = 1 см2 не равна электрической проводимости (W), а лишь пропорциональна ей:
Слайд 14Чтобы найти константу ячейки, измеряют сопротивление (R) стандартных растворов электролитов
(КС1 или NaCl) с известной удельной электрической проводимостью при нескольких
концентрациях. Затем рассчитывают θ:
Слайд 15Кондуктометрическое титрование
Сущность метода: измеряют электрическую проводимость раствора в ходе титрования
и строят кривую титрования. Кривая титрования является линейной. По её
излому определяют объём титранта в т.э. и проводят расчёт результатов анализа по закону эквивалентов.
В кондуктометрическом титровании используют реакции осаждения, комплексообразования и кислотно-основные реакции в водных и неводных растворах. Окислительно-восстановительные реакции (ОВР) используют реже.
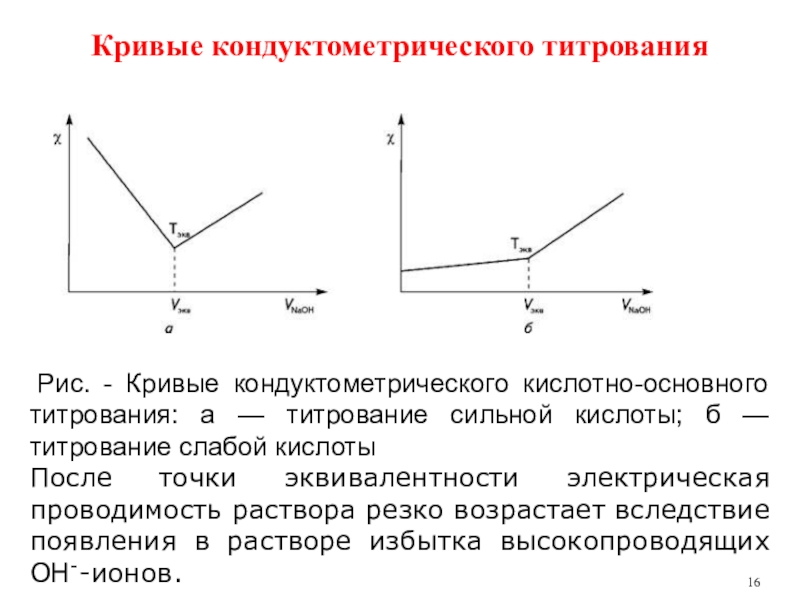
Слайд 16 Рис. - Кривые кондуктометрического кислотно-основного титрования: а — титрование сильной
кислоты; б — титрование слабой кислоты
После точки эквивалентности электрическая проводимость
раствора резко возрастает вследствие появления в растворе избытка высокопроводящих ОН--ионов.
Кривые кондуктометрического титрования
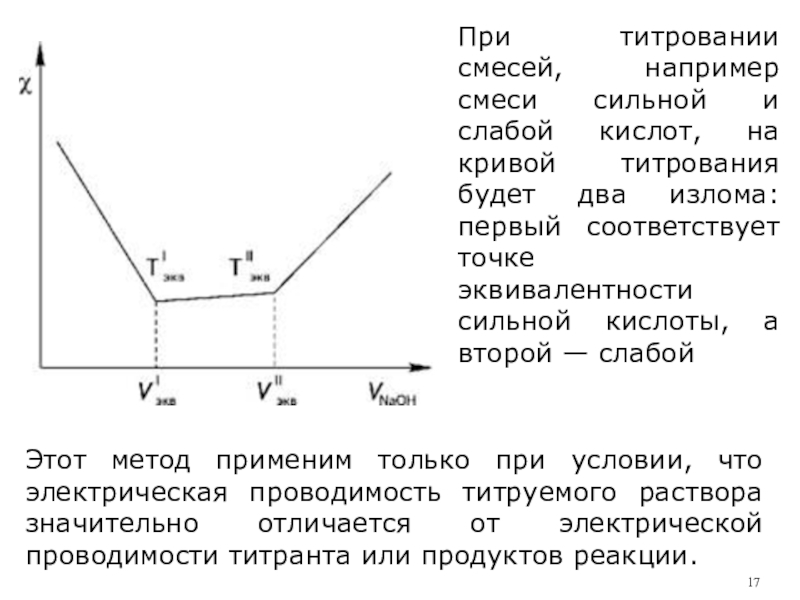
Слайд 17Этот метод применим только при условии, что электрическая проводимость титруемого
раствора значительно отличается от электрической проводимости титранта или продуктов реакции.
При
титровании смесей, например смеси сильной и слабой кислот, на кривой титрования будет два излома: первый соответствует точке эквивалентности сильной кислоты, а второй — слабой
Слайд 18ЛАБОРАТОРНЫЙ КОНДУКТОМЕТР-СОЛЕМЕР АНИОН-4120
Слайд 19Электрогравиметрический метод определения ионов основан на электролитическом осаждении из растворов
металлов на взвешенном электроде, главным образом на катоде, (на аноде
осаждается только свинец или марганец, окисляясь в процессе электролиза до PbO2 или MnO2). О количестве выделенного металла судят по увеличению массы катода.
В основе метода - закон Фарадея - масса вещества, выделяющегося при электролизе, пропорциональна силе тока, времени и химическому эквиваленту вещества.
7. Электрогравиметрический метод
Слайд 20Для выделения одного моля эквивалента вещества требуется около 96500 кулонов
электричества (постоянная Фарадея). F = 96485,33 Кл/моль
Один кулон (1 Кл)
- количество электричества, прошедшее через проводник в течение 1 с при силе тока в 1 А.
Количество вещества, выделяемое одним кулоном электричества, называют электрохимическим
эквивалентом (Ээ), оно равно
Ээ = М/(z·96500),
z – число электронов, участвующих в процессе
Слайд 21Вследствие протекания побочных процессов масса вещества, выделяющегося при электролизе обычно
меньше теоретически вычисленной по закону Фарадея, т.е. выход по току
(η) чаще всего менее 100 %. Поэтому масса вещества, выделившегося на электроде:
где m - масса вещества,
I - сила тока, А;
t - время, с;
М - молярная масса вещества, выделившегося на электроде, г/моль;
η - выход по току;
n - число электронов, участвующих в электрохимическом процессе.
Слайд 22К ОСАДКАМ, ИСПОЛЬЗУЕМЫМ В ЭЛЕКТРОГРАВИМЕТРИИ ПРЕДЪЯВЛЯЮТСЯ СЛЕДУЮЩИЕ ТРЕБОВАНИЯ:
- определяемый компонент
должен выделяться на электроде количественно,
получающийся осадок должен быть чистым,
мелкозернистым и обладать хорошим сцеплением с поверхностью электрода с тем, чтобы последние операции - промывание, высушивание и взвешивание не вызвали потери осадка.
Для получения таких осадков необходимо: регулировать плотность тока, состав и температуру раствора, поверхность и материал электрода, скорость перемешивания.
Слайд 23Преимуществами метода являются:
простота, достаточная точность и экспрессность метода позволили применить
этот метод к анализу цветных металлов и их сплавов;
метод исключает
фильтрование осадка (в гравиметрии самый длительный и утомительный процесс);
возможность анализа многокомпонентных смесей, путем подбора электролита или потенциала электрода.