nucleus)
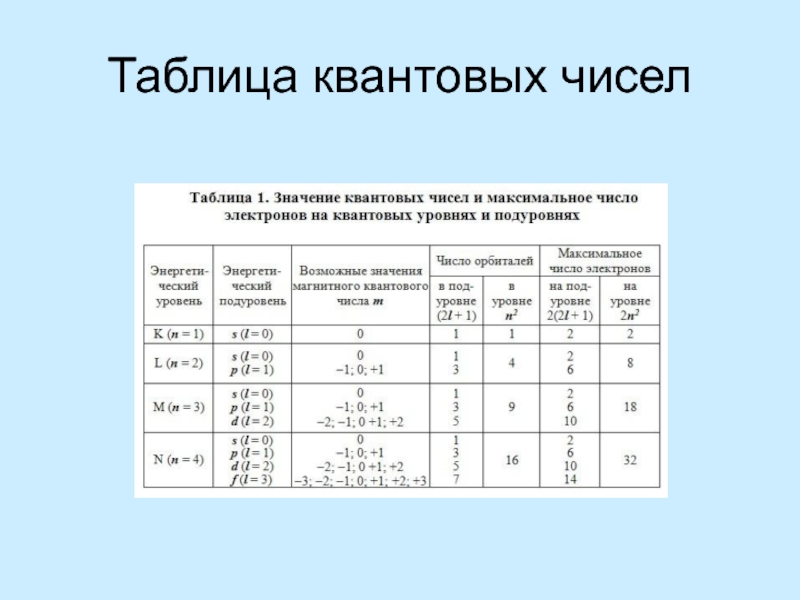
Стационарные орбиты в настоящее время называют уровнями
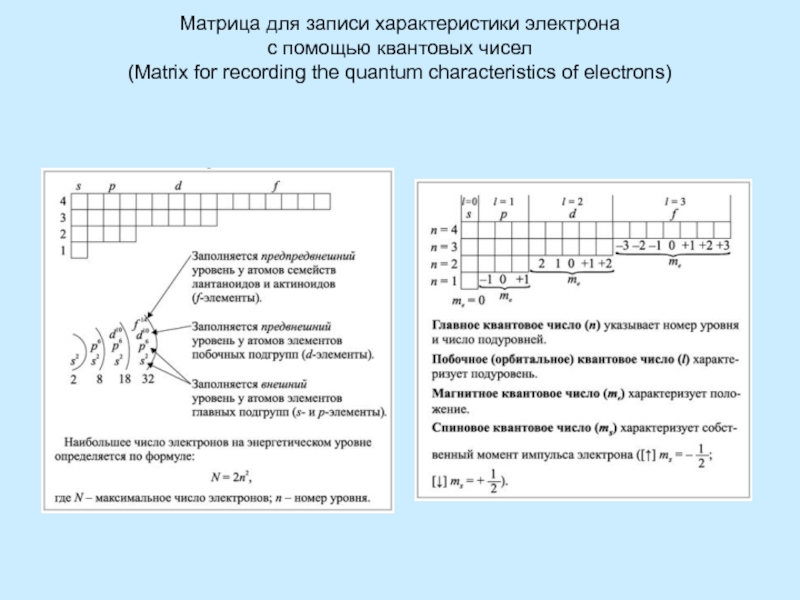
Уровни нумеруются от ядра
как целые числаУровни состоят из подуровней
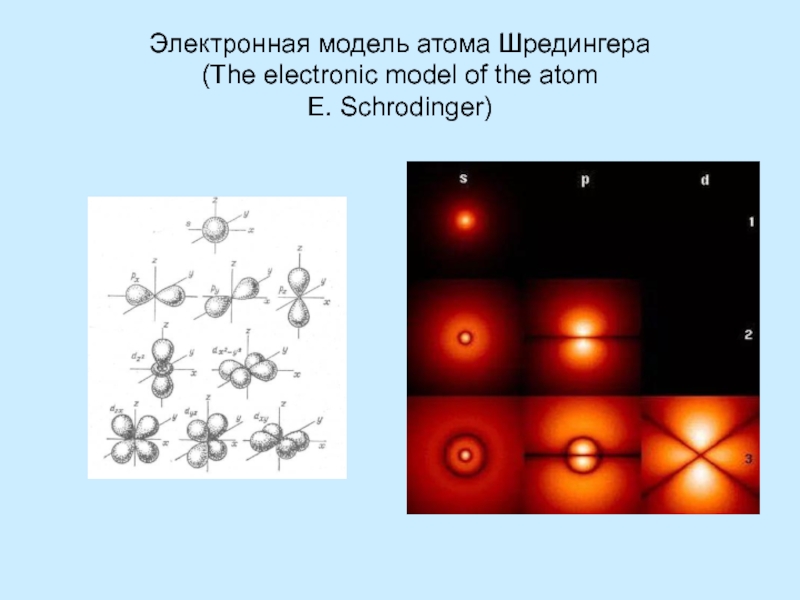
На каждом подуровне может быть несколько орбиталей
Орбиталь – это зона атома, где теоретически может находится один электрон
Из всех орбиталей и электронов на них состоит зона электронной плотности или электронное облако атома
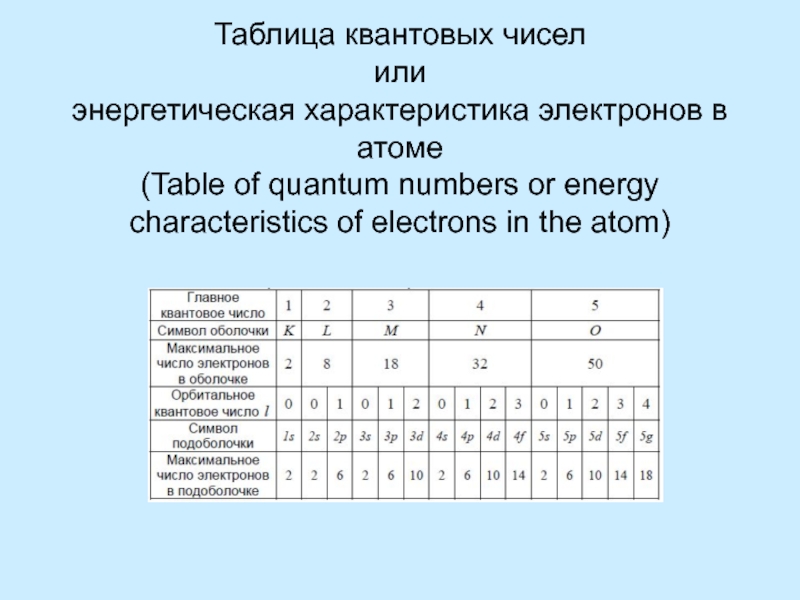
A stationary orbit is currently referred to as levels
The levels are numbered from the nucleus as integers
Levels consist of sublevels
Each sublevel can have multiple orbitals
Orbital is the area of the atom where it is possible is one electron
Of all the orbitals and electrons in them is area of electron density or electron cloud of an atom