Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Энергетика химических реакций и физико-химических процессов
Содержание
- 1. Энергетика химических реакций и физико-химических процессов
- 2. Термодинамика - раздел химии, изучающий свойства макроскопическх
- 3. Достоинства термодинамики:Экономит средства и время.Не требует сведений
- 4. Система – тело или группа тел, отделенных
- 5. Классификация по характеру взаимодействия с окружающей средойΔE
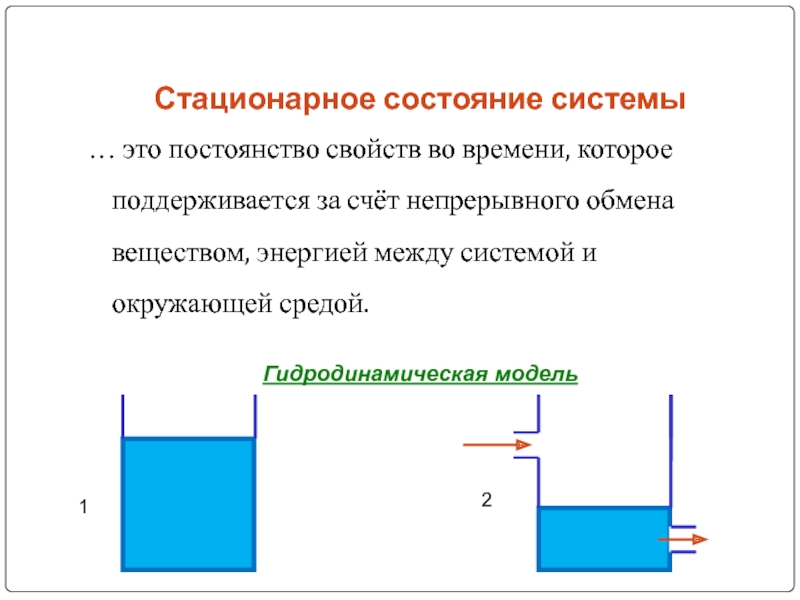
- 6. Стационарное состояние системы… это постоянство свойств во
- 7. Термодинамические функции состояния Н − энтальпия
- 8. Первый закон термодинамики – всеобщий закон природы,
- 9. Первый закон термодинамикиQ = ΔU + A,
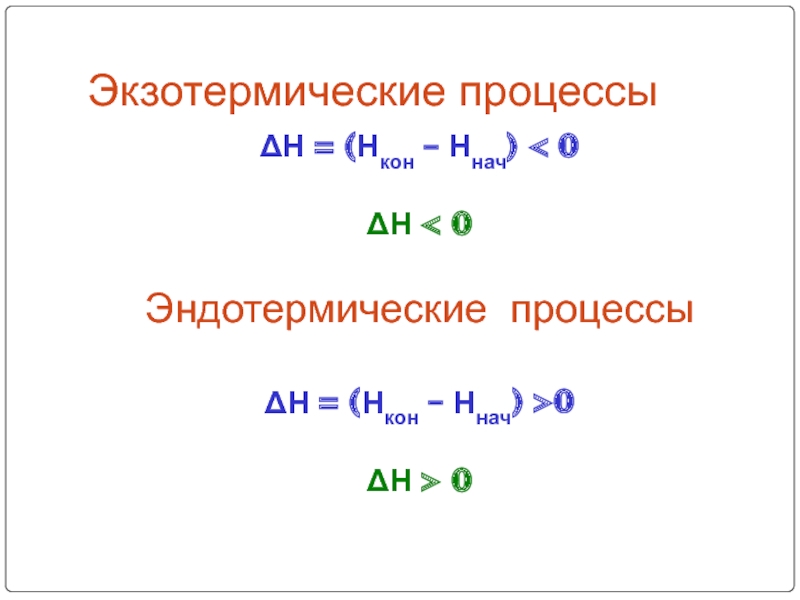
- 10. Экзотермические процессыΔН = (Нкон – Ннач) <
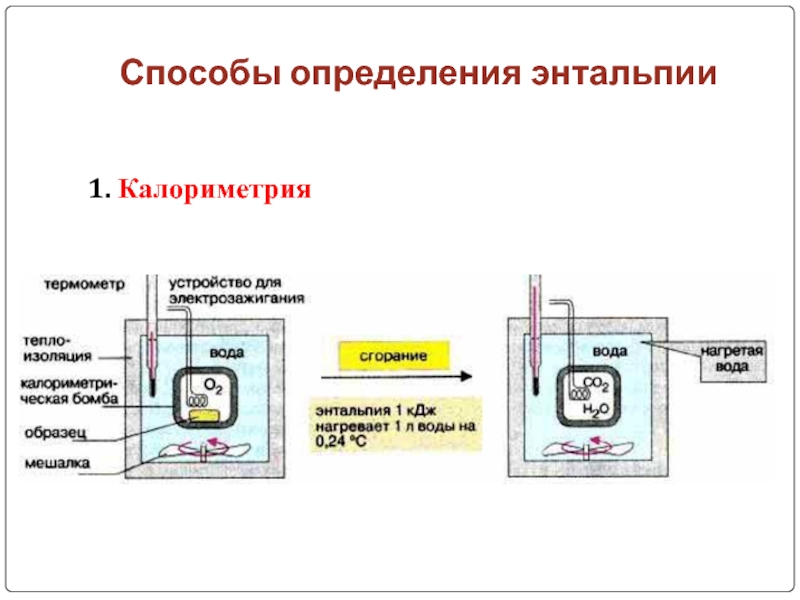
- 11. Способы определения энтальпии1. Калориметрия
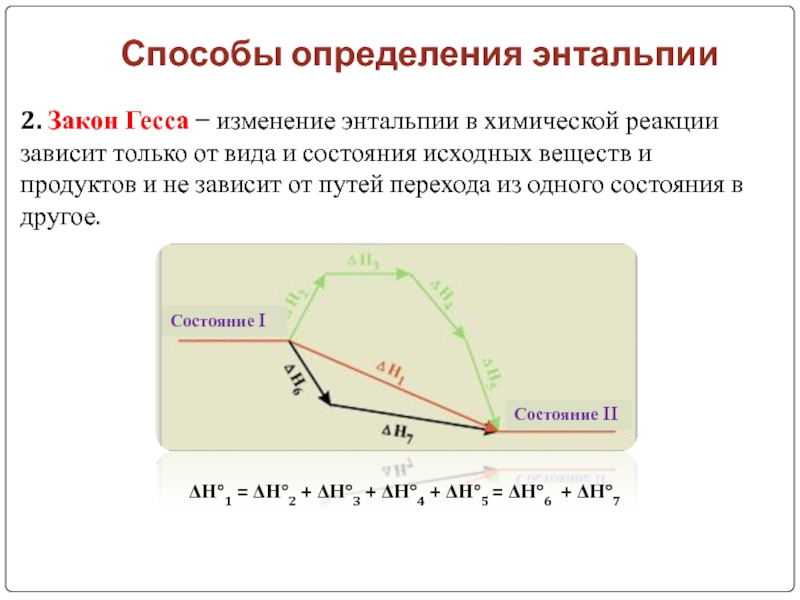
- 12. Способы определения энтальпии2. Закон Гесса − изменение
- 13. Способы определения энтальпииСледствия из закона Гесса1-ое следствие2-ое следствие Т=298К, р=101,3 кПа, n=1моль
- 14. ЗадачаМногие микроорганизмы, включая дрожжи, получают необходимую энергию
- 15. Правило нахождения ΔНЭнтальпия простых веществ и элементов
- 16. Калорийность питательных веществ…… называется энергия, выделяемая при
- 17. ЗадачаВычислите калорийность пищевого продукта массой 350г, содержащего 50% воды, 30% белка, 15% жиров, 5% углеводов.Q=Qб+Qж+QугQбелка=17кДж/гQуглеводов=17кДж/гQжира=39кДж/гQбелка=350⋅0,3⋅17=1785кДжQжира=350⋅0,17⋅39=2047,5кДжQуглеводов=350⋅0,05⋅17=297,5кДжQ=1785+2047,5+297,5=4130кДж
- 18. Спасибо за внимание
- 19. Скачать презентанцию
Термодинамика - раздел химии, изучающий свойства макроскопическх систем, находящихся в состоянии термодинамического равновесия и процессы перехода между этими состояниями. ЗАДАЧИ: 1. Расчет теплового эффекта реакции. 2. Прогнозирование
Слайды и текст этой презентации
Слайд 1
Лекция №1
Лектор Задорожная Анна Николаевна
Энергетика химических реакций и физико-химических процессов.
Первое начало термодинамики. Закон Гесса.
Слайд 2Термодинамика - раздел химии, изучающий свойства макроскопическх систем, находящихся в
состоянии термодинамического равновесия и процессы перехода между этими состояниями. ЗАДАЧИ: 1. Расчет
теплового эффекта реакции. 2. Прогнозирование направления реакции. 3. Расчет максимального выхода продукта.Слайд 3Достоинства термодинамики:
Экономит средства и время.
Не требует сведений о стадиях процесса.
Недостатки
термодинамики:
Отсутствуют сведения о скорости хим. реакции.
Проводить реакцию можно только в
равновесных условиях.Слайд 4Система – тело или группа тел, отделенных от окружающей среды
реальной или воображаемой поверхностью раздела
Классификация систем по однородности
гомогенные гетерогенные(однородная система (разнородная система
в которой нет частей из двух или более частей,
различающихся по отличающихся по
свойствам и разделённых свойствам, между которыми
поверхностями раздела, есть поверхность раздела
например: вода, воздух) например: молоко, кровь)
Слайд 5Классификация по характеру взаимодействия с окружающей средой
ΔE ≠ 0, Δm
≠ 0
ΔE ≠ 0, Δm = 0
ΔE = 0, Δm
≠ 0Слайд 6Стационарное состояние системы
… это постоянство свойств во времени, которое поддерживается
за счёт непрерывного обмена веществом, энергией между системой и окружающей
средой.Гидродинамическая модель
1
2
Слайд 7Термодинамические функции состояния
Н − энтальпия − тепловой эффект
образования 1 моль вещества из простых веществ при р=const.
Е(U) −
внутренняя энергия − полный запас энергии тела или системы без учёта её Ек и Еп.S − энтропия.
G − изобарно-изотермический потенциал / свободная энергия Гиббса.
Слайд 8Первый закон термодинамики – всеобщий закон природы, закон сохранения и
превращения энергии
Его формулировки:
Энергия не исчезает и не возникает из
ничего, а только превращается из одного вида в другой строго эквивалентных соотношениях.Полная энергия изолированной системы – величина постоянная.
Слайд 9Первый закон термодинамики
Q = ΔU + A, где А –
работа
A = pΔV, тогда
Q = ΔU + pΔV =
(Uкон
– Uнач) + (pVкон – pVнач) = (Uкон + pVкон) + (Uнач– pVнач).
Слайд 10Экзотермические процессы
ΔН = (Нкон – Ннач) < 0
ΔН < 0
Эндотермические
процессы
ΔН = (Нкон – Ннач) >0
ΔН > 0
Слайд 12Способы определения энтальпии
2. Закон Гесса − изменение энтальпии в химической
реакции зависит только от вида и состояния исходных веществ и
продуктов и не зависит от путей перехода из одного состояния в другое.ΔΗ°1 = ΔΗ°2 + ΔΗ°3 + ΔΗ°4 + ΔΗ°5 = ΔΗ°6 + ΔΗ°7
Состояние I
Состояние II
Слайд 13Способы определения энтальпии
Следствия из закона Гесса
1-ое следствие
2-ое следствие
Т=298К,
р=101,3 кПа, n=1моль
Слайд 14Задача
Многие микроорганизмы, включая дрожжи, получают необходимую энергию в результате сбраживания
глюкозы в этанол:
С6Н12О6 ? 2С2Н5ОН + 2СО2
ΔН°обр
-1260,0 -277,63 -393,51кДж/моль
Слайд 15Правило нахождения ΔН
Энтальпия простых веществ и элементов в стандартных условиях
принимается равным 0.
Значения энтальпии прямой реакции численно равно энтальпии обратной
реакций, но с противоположным знаком – закон Лавуазье – Лапласа.? +53 кДж/моль
? - 53 кДж/моль
Слайд 16Калорийность питательных веществ…
… называется энергия, выделяемая при полном окислении (сгорании)
1грамма питательных веществ.
1кал = 4,16кДж
Жиры, углеводы и белки окисляются в
организме:С ? CO2, H ? H2O, белки ? мочевина