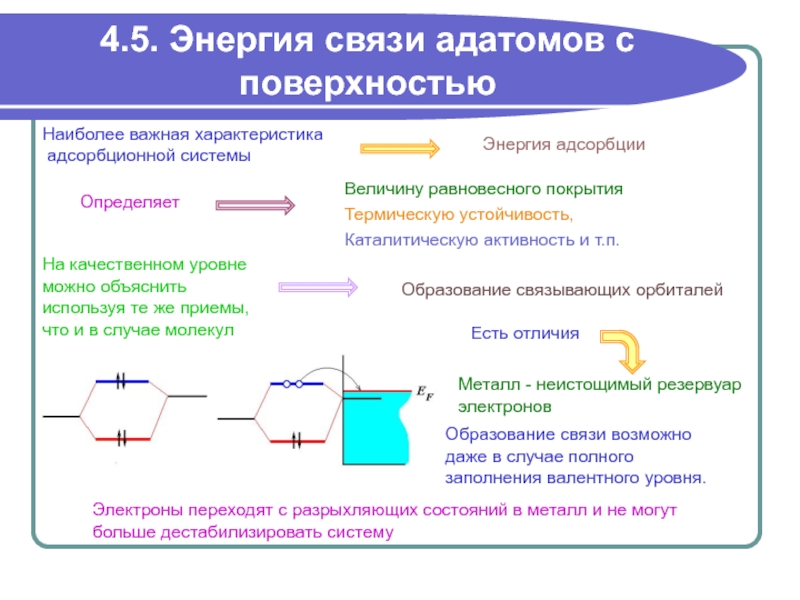
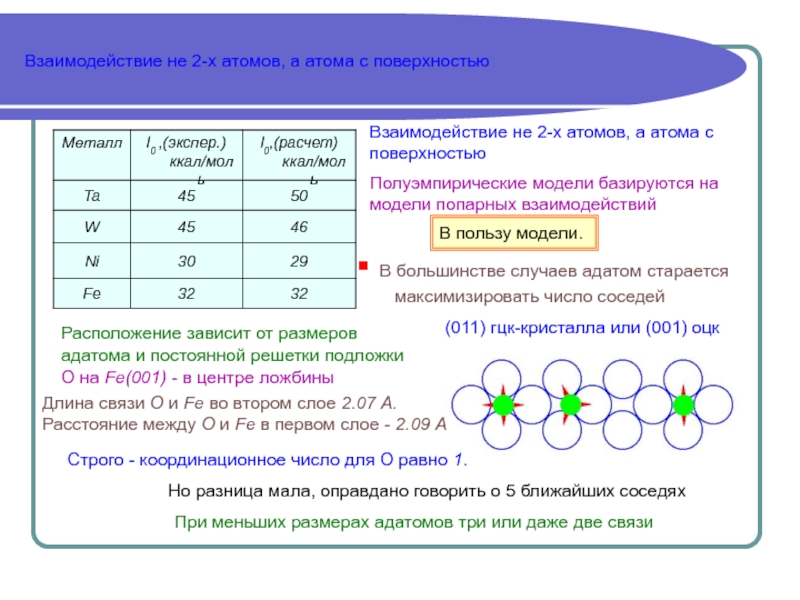
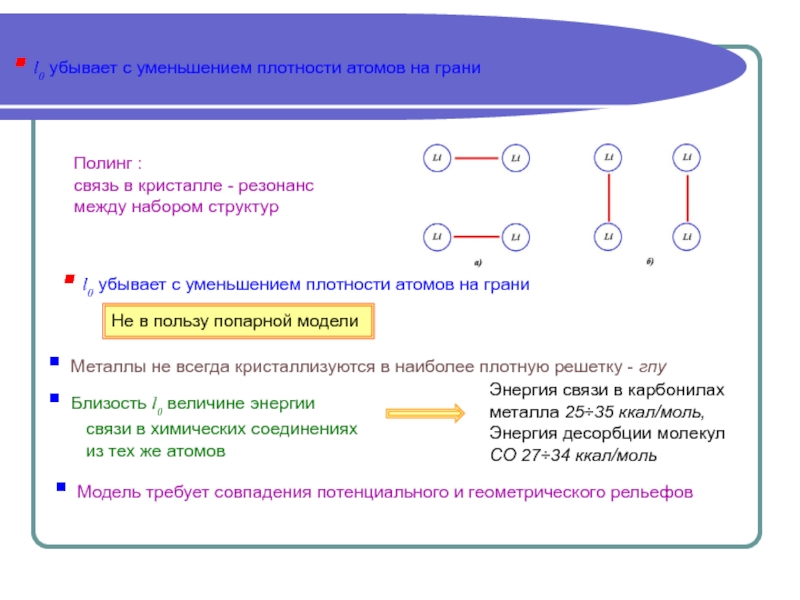
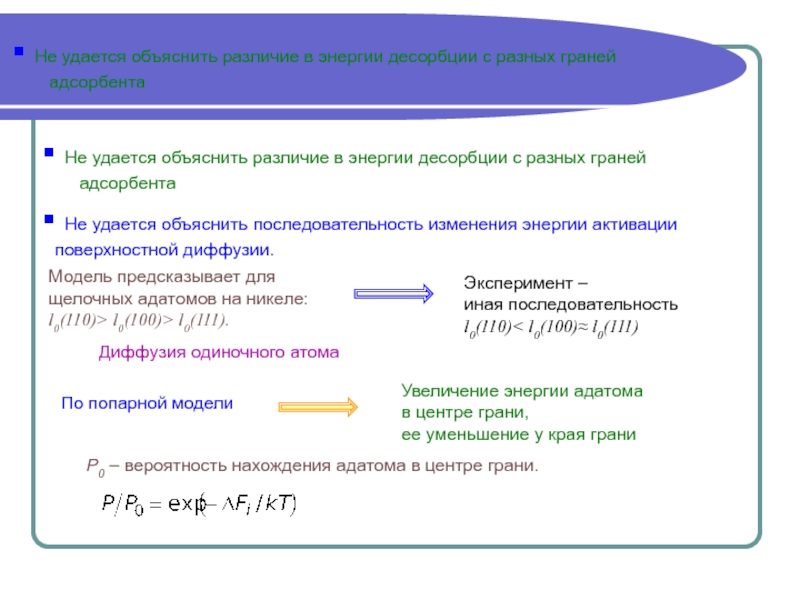
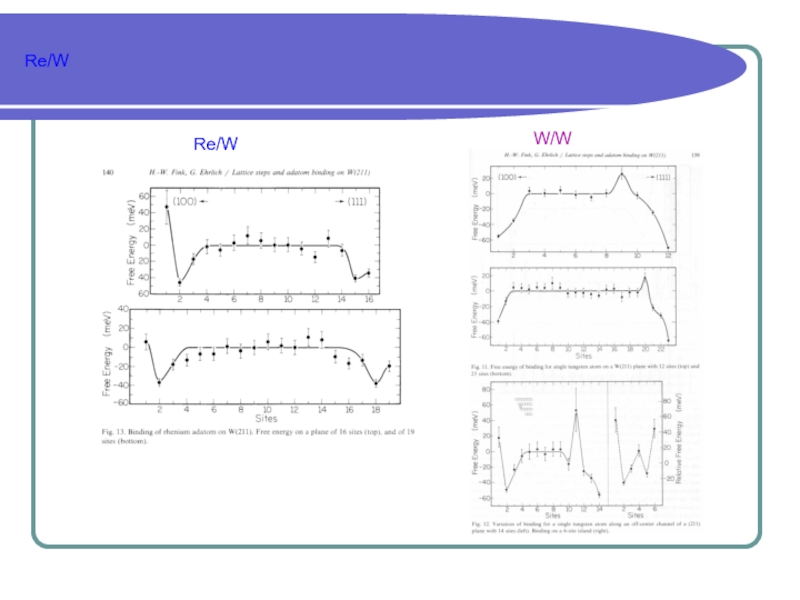
качественном уровне
можно объяснить
используя те же приемы,
что и
в случае молекул Образование связывающих орбиталей
Металл - неистощимый резервуар
электронов
Образование связи возможно
даже в случае полного
заполнения валентного уровня.
Термическую устойчивость,
Каталитическую активность и т.п.
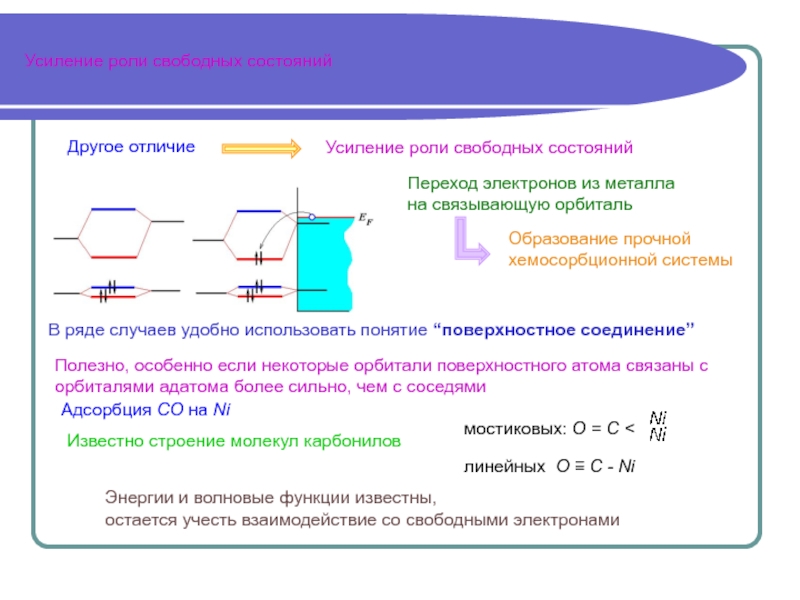
Есть отличия
Электроны переходят с разрыхляющих состояний в металл и не могут
больше дестабилизировать систему
Энергия адсорбции
Величину равновесного покрытия