Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Энзиология
Содержание
- 1. Энзиология
- 2. *Ферменты – биологические катализаторы белковой природыВ природе
- 3. * История энзимологии В древности использовали ферментативные
- 4. *История энзимологии (прод)1871 г. М.М. Манассеина, а
- 5. *Простые и сложные ферментыПростые ферменты состоят только
- 6. *Структурно-функциональная организация ферментов. СхемаАктивные центрыЯкорные площадкиСубстратныйсубстратпродуктЦентры регуляции + и -
- 7. *Сходство Е и неферметативных катализаторовКатализируют энергетически возможные
- 8. *Отличия Е и неферметативных катализаторовКаталитическая эффективность -
- 9. *Доказательства белковой природы ЕИдентичные свойства ВМСЧувствительность к
- 10. *Свойства ферментов Белковая природа определяет многие свойства
- 11. *Оптимум рН разных ферментов
- 12. *Механизмы рН зависимостиионизация и изменение зарядаповерхностных групп
- 13. *Термолабильность
- 14. *Специфичность ЕВиды специфичности:Субстратная специфичностьАбсолютная - аргиназаОтносительная (групповая)
- 15. *Специфичность химотрипсина
- 16. *Этапы взаимодействия Е и SСближение и ориентация
- 17. *Механизм взаимодействия Е и SТеория Э Фишера
- 18. *Динамика белковой молекулы
- 19. *Теория промежуточных соединенийВ 1913 г Л. Михаэлис
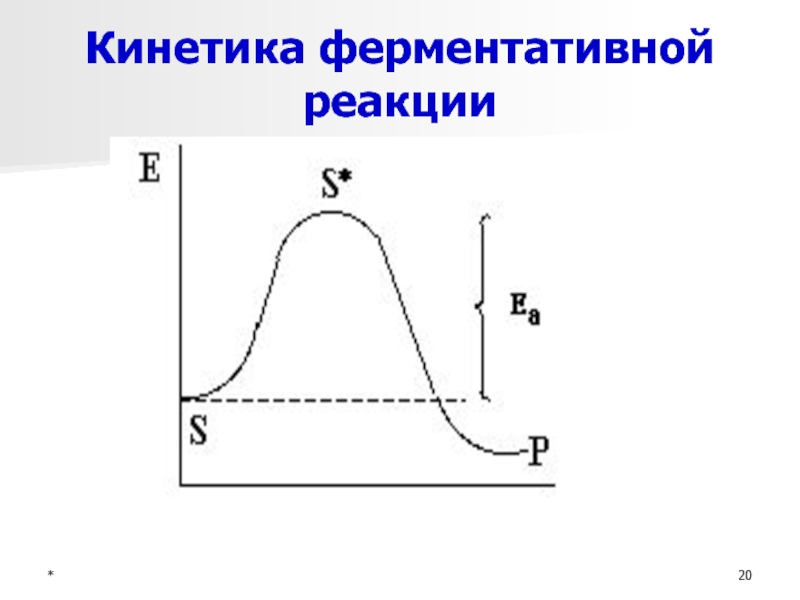
- 20. *Кинетика ферментативной реакции
- 21. *Зависимость активности Е от [S]
- 22. *Активность фермента зависит от [S]
- 23. *График зависимости скорости реакции от[S] Метод «двойных обратных величин» (график Лайнуивера-Берка)
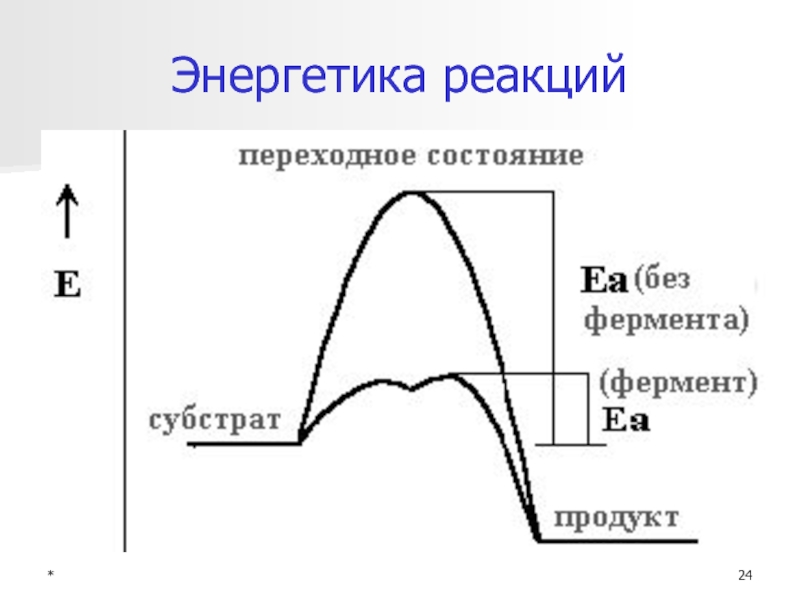
- 24. *Энергетика реакций
- 25. *Зависимость скорости реакции от [E]
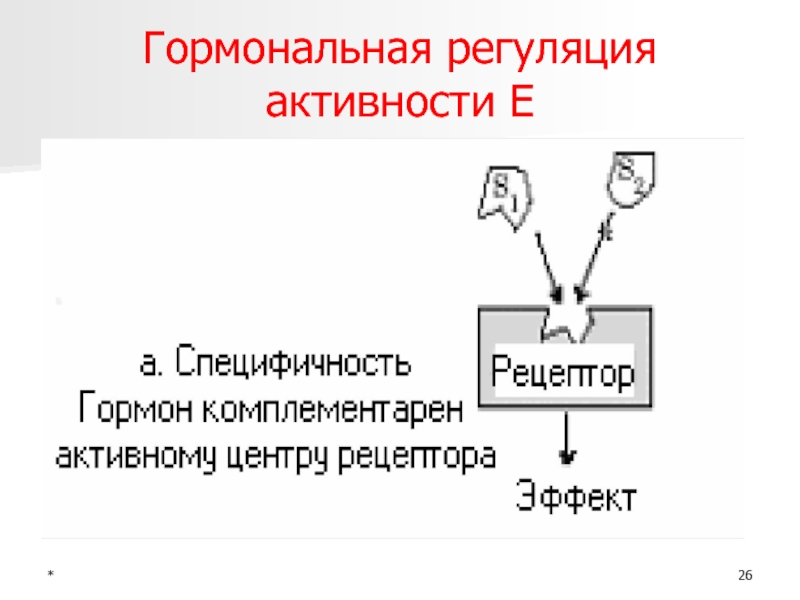
- 26. *Гормональная регуляция активности Е
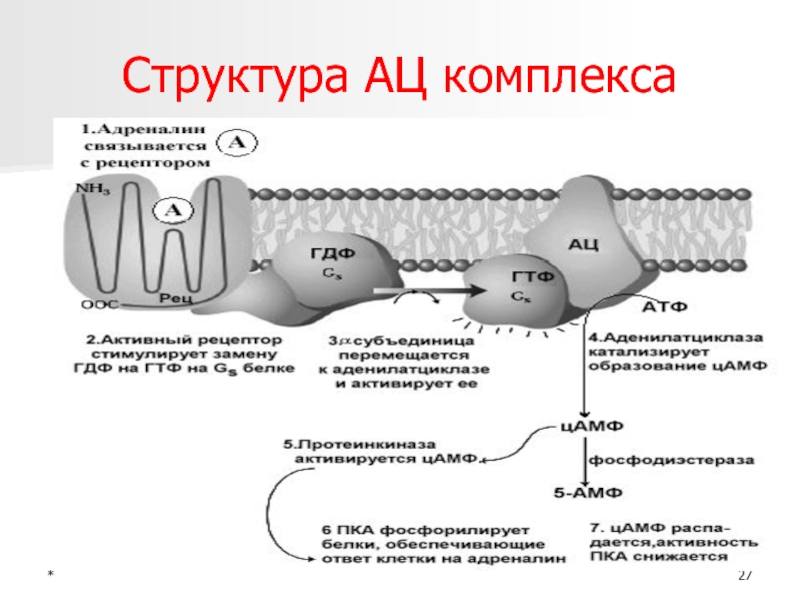
- 27. *Структура АЦ комплекса
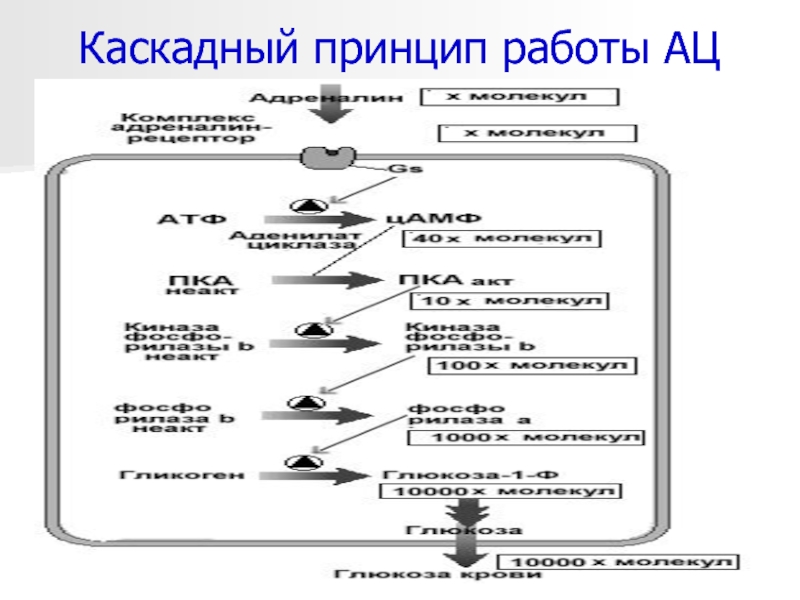
- 28. *Каскадный принцип работы АЦ комплекса
- 29. *Регуляция активности Е путем химической модификацииОграниченный протеолиз (Пепсиноген→пепсин)ФосфорилированиеМетилированиеАцетилированиеАденилированиеи др.
- 30. *Виды ингибированияОбратимое - Обратимые изменения активности фермента
- 31. *Свойства аллостерических ферментовСубъединичная структураИмеется ось симметрииИзменения конформации
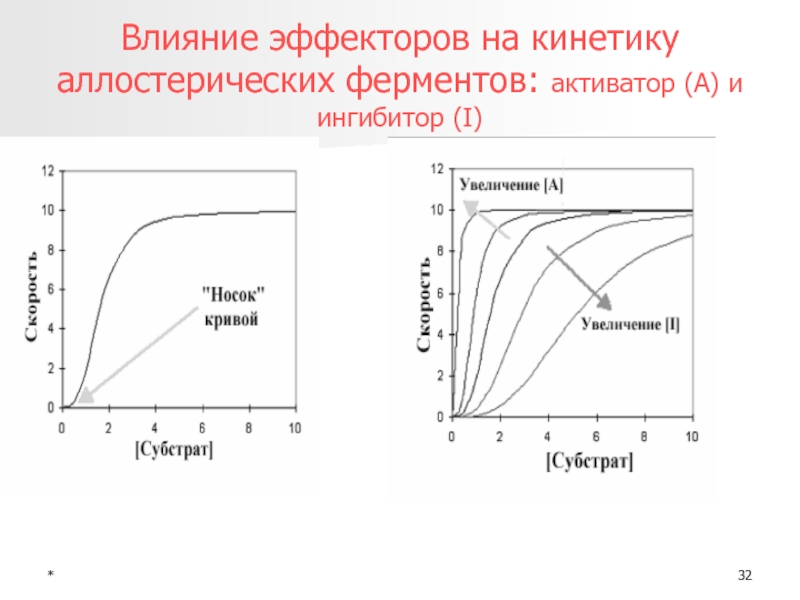
- 32. *Влияние эффекторов на кинетику аллостерических ферментов: активатор (А) и ингибитор (I)
- 33. *Благодарю за внимание
- 34. Скачать презентанцию
*Ферменты – биологические катализаторы белковой природыВ природе существует 3 вида биологических катализаторов :Ферменты (энзимы) – белковой природыРибозимы – РНК с каталитической активностьюАбзимы – антитела с каталитической активностью
Слайды и текст этой презентации
Слайд 2*
Ферменты – биологические катализаторы белковой природы
В природе существует 3 вида
биологических катализаторов :
Ферменты (энзимы) – белковой природы
Рибозимы – РНК с
каталитической активностьюАбзимы – антитела с каталитической активностью
Слайд 3*
История энзимологии
В древности использовали ферментативные технологии (хлебопечение, виноделие, обработка шкур
и др)
XVIII в Р.Реомюр, Л. Спалланцани описание пищеварения у птиц
1814
г. К.Кирхгоф показал каталитический хар-р гидролиза крахмала при прорастании зернаСередина XIX в спор Ю. Либиха и Л. Пастера «организованные» и «неорганизованные» ферменты
1878 г. Ф. Кюне ввел термин «энзим»
Слайд 4*
История энзимологии (прод)
1871 г. М.М. Манассеина, а затем Э. Бюхнер
показали, что экстракт клеток способен к катализу
1894 г. Э. Фишер
создал модель «ключ-замок»1913 г. Л. Михаэлис и М. Ментен создали теорию ферм катализа
1929 г. Дж Самнер доказал белковую природу ферментов
1963 г. определена первичная структура РНК-азы
1968 г. М. Меррифилд синтез искусственной РНК-азы
Слайд 5*
Простые и сложные ферменты
Простые ферменты состоят только из молекулы белка
(большинство ферментов ЖКТ)
Сложные ферменты простой фермент (апофермент) + небелкое соединение
(кофермент, кофактор) - коферменты алифатические (GSH)
- коферменты ароматические (КоQ)
- коферменты- нуклеотиды (NAD, FAD, FMN)
- коферменты ионы Ме (K, Na, Ca, Mg, Mn, Fe …) ~ 25%
- коферменты-производные водорастворимых витаминов B1- ТПФ, В6 –Фосфопиридоксаль и др)
Слайд 6*
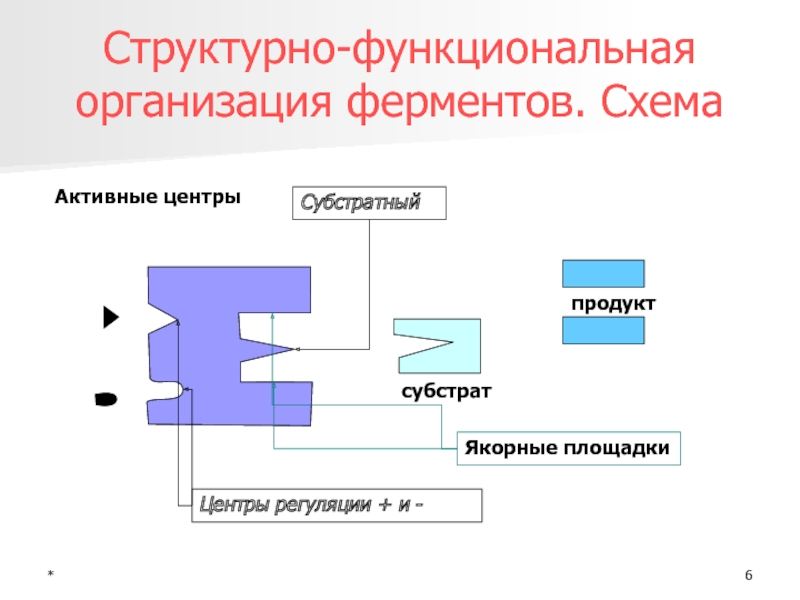
Структурно-функциональная организация ферментов. Схема
Активные центры
Якорные площадки
Субстратный
субстрат
продукт
Центры регуляции + и -
Слайд 7*
Сходство Е и неферметативных катализаторов
Катализируют энергетически возможные реакции
Энергия химической системы
остается постоянной
В ходе катализа направление реакции не меняется
Не расходуются в
процессе реакции Слайд 8*
Отличия Е и неферметативных катализаторов
Каталитическая эффективность - Е реакций выше
–в 108 – 1014 раз, чем скорость некатализируемых реакций
Высокая специфичность
Реакции
протекают в «мягких» условиях при t = 37° C, рН~7.0, постоянном атм давленииСкорость реакции может регулироваться
Слайд 9*
Доказательства белковой природы Е
Идентичные свойства ВМС
Чувствительность к рН, t, факторам
денатурации и др.
При парентеральном введении образуют АТ
Гидролиз Е дает свободные
протеиногенные АКИскусственный синтез Е
Слайд 10*
Свойства ферментов
Белковая природа определяет многие свойства ферментов
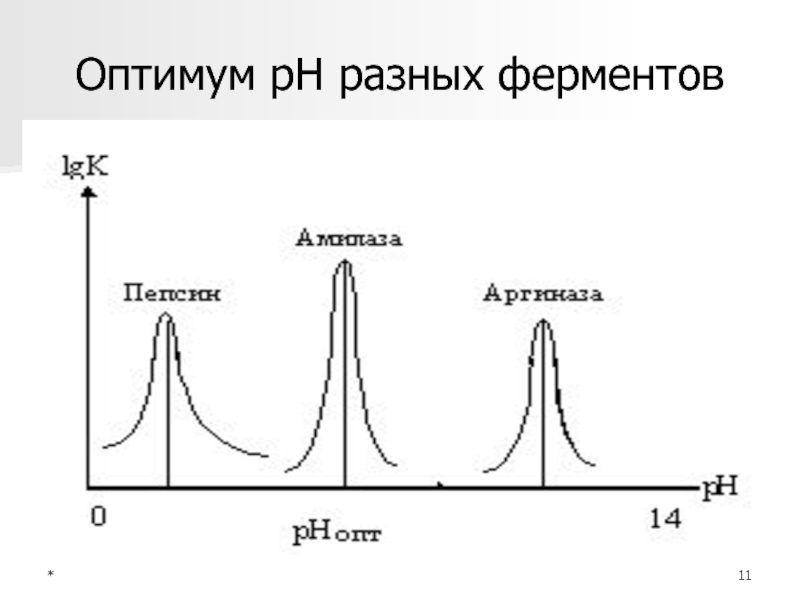
Высокая чувствительность к
pH, у каждого фермента существует свой pH-оптимум
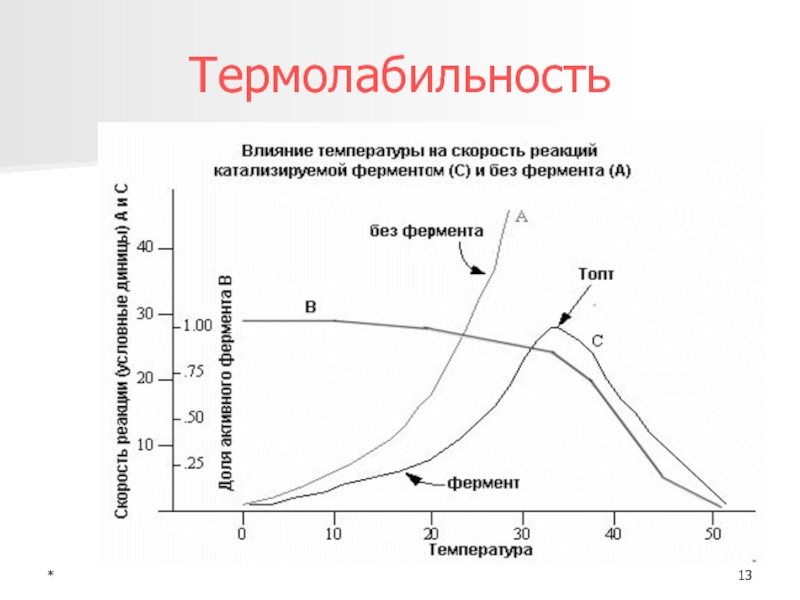
Термолабильность - высокая
чувствительность к действию температурыСпецифичность
Многоуровневая разнообразная регуляция
Слайд 12*
Механизмы рН зависимости
ионизация и изменение заряда
поверхностных групп молекулы Е, в
т.ч. и его активного центра,
субстратов, т.к. большинство S являются
кислотамиСлайд 14*
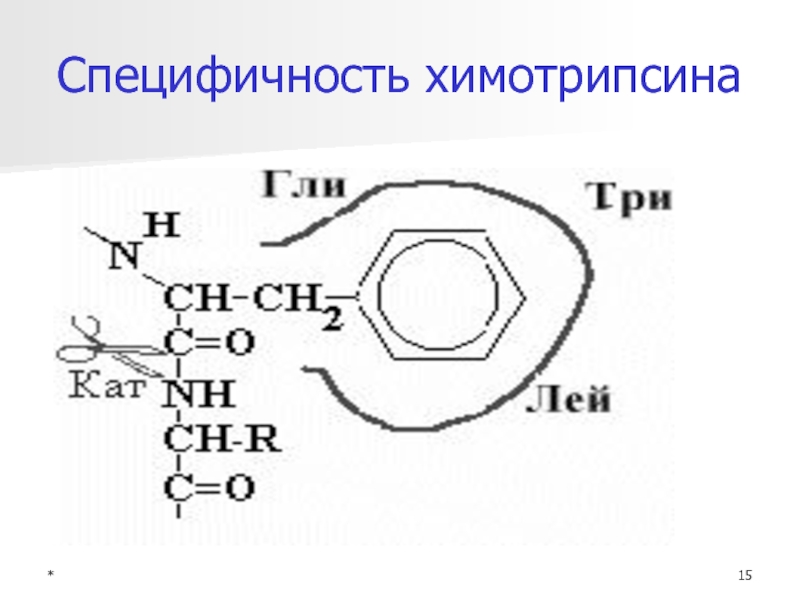
Специфичность Е
Виды специфичности:
Субстратная специфичность
Абсолютная - аргиназа
Относительная (групповая) - ферм ЖКТ
Стереоспецифичность
D- и L-изомеры
2. Каталитическая 4 пути катализа Г6Ф (фосфоглюкомутаза, Г6Ф-аза,
фосфоглюкоизомераза, Г6Ф ДГ)Слайд 16*
Этапы взаимодействия Е и S
Сближение и ориентация S по отношению
к каталитической группе Е
Напряжение и деформация чувствительной к действию Е
связи, из-за индуцированного соответствия S и Е (образование ЕS компл)Общий кислотно-основной катализ
Ковалентный катализ
Слайд 17*
Механизм взаимодействия Е и S
Теория Э Фишера (1894) жесткого стерического
соответствия (ключ-замок)
Теория Д.Кошланда (1957) индуцированного взаимодействия Е и S (рука-перчатка)
Современные
представления – синтез обеих теорийСлайд 19*
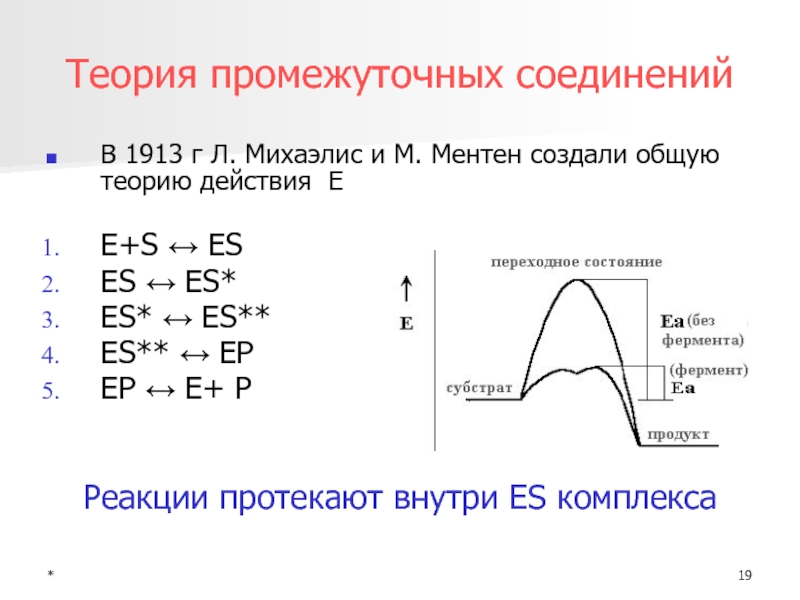
Теория промежуточных соединений
В 1913 г Л. Михаэлис и М. Ментен
создали общую теорию действия Е
E+S ↔ ES
ES ↔ ES*
ES* ↔ ES**
ES** ↔ EP
EP ↔ E+ P
Реакции протекают внутри ES комплекса
Слайд 23*
График зависимости скорости реакции от[S] Метод «двойных обратных величин» (график
Лайнуивера-Берка)
Слайд 29*
Регуляция активности Е путем химической модификации
Ограниченный протеолиз (Пепсиноген→пепсин)
Фосфорилирование
Метилирование
Ацетилирование
Аденилирование
и др.
Слайд 30*
Виды ингибирования
Обратимое - Обратимые изменения активности фермента путем ковалентной модификации
1. конкурентное (структурное сходство I с S) IE
- путем связывания активного центра - путем изменения конформации фермента
Принципы конкурентного торможения находят применение в медицине в химиотерапии и при лечении отравлений
2. неконкурентное ISE Неконкурентные ингибиторы не могут связаться со свободным ферментом , а только с ES комплексом
3. бесконкурентное
Необратимое обычно необратимое повреждение Е
Слайд 31*
Свойства аллостерических ферментов
Субъединичная структура
Имеется ось симметрии
Изменения конформации в пределах R
и T
Сигмоидная (в отличие от гиперболической для не аллостерических) форма
кривой зависимости скорости реакции от концентрация субстрата Наличие эффекторов (активаторов и ингибиторов)
Двухфазный ответ на конкурентные ингибиторы (увеличение акт при малых [I] и торможение при больших)
Катализируют «ключевые» реакции метаболизма
Потеря аллостерических свойств при денатурации














![Энзиология *Зависимость активности Е от [S] *Зависимость активности Е от [S]](/img/thumbs/6fb5805e7b02c636d4f3e5c015c31c9f-800x.jpg)
![Энзиология *Активность фермента зависит от [S] *Активность фермента зависит от [S]](/img/thumbs/dd1644941e129e28e574e7421d0340b7-800x.jpg)
![Энзиология *График зависимости скорости реакции от[S] Метод «двойных обратных величин» (график Лайнуивера-Берка) *График зависимости скорости реакции от[S] Метод «двойных обратных величин» (график Лайнуивера-Берка)](/img/thumbs/9c97dd7492bea06b72ebc6a76ad9ed6a-800x.jpg)
![Энзиология *Зависимость скорости реакции от [E] *Зависимость скорости реакции от [E]](/img/thumbs/0d8f5ee6fcadb7b21fa97c39ef99b0d9-800x.jpg)