ч е с к а я х и
м и я ЛСЛекции №19 - 20:
Тема: «IV и III группы периодической системы элементов Д.И. Менделеева»
План:
1. Общая характеристика IV группы ПСХЭ.
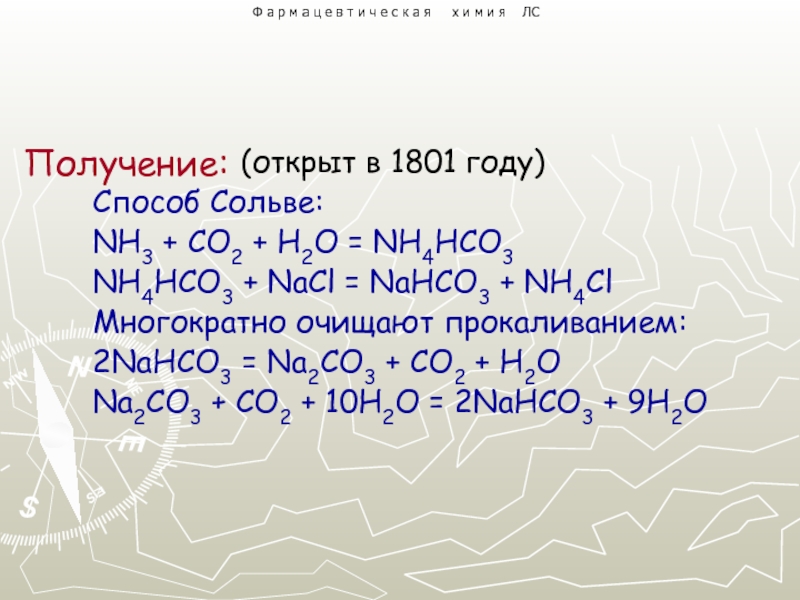
2. Натрия гидрокарбонат.
3. Общая характеристика III группы ПСХЭ.
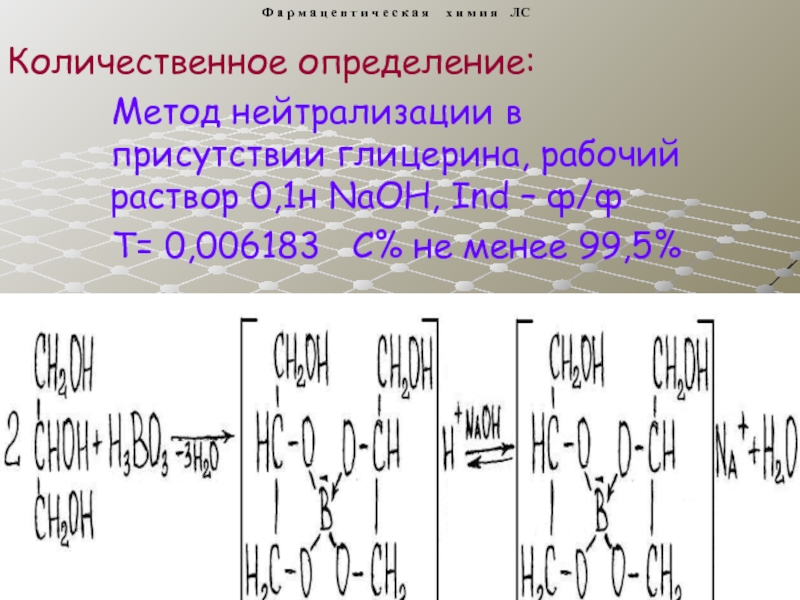
4. Кислота борная.
5. Натрия тетраборат.