Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферменты гидробионтов. Факторы, влияющие на активность ферментов
Содержание
- 1. Ферменты гидробионтов. Факторы, влияющие на активность ферментов
- 2. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ И МЕТОДЫ ИХ ВЫДЕЛЕНИЯЛабораторная работа
- 3. Важное место в биохимических исследованиях занимает выделение
- 4. Некоторые очищенные индивидуальные белки используют в медицине
- 5. Белкиполимерные молекулы, мономеры - аминокислоты. В составе
- 6. Общие структурные особенности аминокислот, входящих в состав
- 7. В водных растворах при нейтральном значении рН
- 8. Аминокислота
- 9. Слайд 9
- 10. Классификация аминокислотПо радикалуНеполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофанПолярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, аспарагин, глутамин, тирозинПолярные заряженные отрицательно при pH7: лизин, аргинин, гистидин
- 11. Классификация аминокислотПо функциональным группам (радикалам)Ароматические: фенилаланин, тирозин, триптофанГетероциклические: гистидин, пролинСеросодержащие: цистеин, метионинНециклические: все остальные
- 12. Классификация аминокислотНезаменимыевалин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин.Заменимые глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
- 13. Пептидная связь α-Аминокислоты могут ковалентно связываться друг
- 14. Слайд 14
- 15. ПептидыПептиды до 10 аминокислот - олигопептиды по
- 16. Слайд 16
- 17. СТРУКТУРА БЕЛКА Пептидные цепи содержат а/к остатки,
- 18. Слайд 18
- 19. Первичная структура белкалинейная последовательность а/к в полипептидной цепипервичная структура каждого белка закодирована в одном гене
- 20. Вторичная структура белкаЛинейные цепи а\к приобретают пространственную
- 21. Вторичная структура белкарегулярные структуры двух типов: α-спираль и β-структура.
- 22. α-Спираль пептид закручивается в виде спирали водородных
- 23. β-Структураформируется за счёт образования водородных связей между
- 24. Слайд 24
- 25. Третичная структура белковтрёхмерная пространственная структураобразуетсяза счёт взаимодействий
- 26. Доменная структура белков Если полипептидная цепь белка
- 27. Четвертичная структура белков существуют белки, состоящие из
- 28. Слайд 28
- 29. Физико-химические свойства белков Индивидуальные белки различаются по
- 30. 1. Различия белков по форме молекулпо форме
- 31. 2. Различия белков по молекулярной массе
- 32. 3. Суммарный заряд белков Белки имеют
- 33. Степень ионизации функциональных групп этих радикалов зависит
- 34. Значение рН, при котором белок приобретает суммарный
- 35. Так как большинство белков в клетке имеет
- 36. Белки, имеющие суммарный положительный или отрицательный заряд,
- 37. 4. Соотношение полярных и неполярных групп на
- 38. 5. Растворимость белков Растворимость белков в воде
- 39. Методы выделения и очистки белков Получение индивидуальных
- 40. 1. Методы разрушения тканей и экстракции
- 41. Слайд 41
- 42. Метод замораживания и оттаивания ткани В
- 43. Экстракция белков, связанных с мембранами, и разрушение
- 44. Удаление из раствора небелковых веществ Нуклеиновые кислоты,
- 45. Методы очистки белков Очистка белков избирательной денатурацией
- 46. Высаливание Метод очистки белков, основанный на различиях
- 47. Гель-фильтрация, или метод молекулярных сит
- 48. Метод разделения белков с помощью гель-фильтрационной хроматографии
- 49. Неподвижная фаза - жидкость внутри гранул, в
- 50. Более мелкие молекулы диффундируют внутрь гранул сефадекса
- 51. Так как гелевая структура сефадекса легко деформируется
- 52. Слайд 52
- 53. Слайд 53
- 54. Факторы, влияющие на активность ферментов. Способы регуляции работы ферментов.Лабораторная работа
- 55. Каталитическая функцияФерменты (энзимы) – белки - увеличивают
- 56. Фермент-субстратные реакцииВ участке связывания субстрат связывается с
- 57. КатализСхематично процесс катализа можно представить следующим уравнением:
- 58. Слайд 58
- 59. Слайд 59
- 60. Слайд 60
- 61. Специфичностьнаиболее важное свойство ферментов. субстратная сп.- способность
- 62. СпецифичностьВыделяютабсолютную субстратную специфичность (катализ 1 субстрата) -
- 63. Каталитическая специфичностьФермент превращает субстрат по одному из
- 64. Скачать презентанцию
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ И МЕТОДЫ ИХ ВЫДЕЛЕНИЯЛабораторная работа
Слайды и текст этой презентации
Слайд 1Ферменты гидробионтов. Факторы, влияющие на активность ферментов..
Способы регуляции работы ферментов
Слайд 4Некоторые очищенные индивидуальные белки используют в медицине как лекарственные препараты,
например гормон инсулин применяют для лечения сахарного диабета, а пищеварительные
ферменты поджелудочной железы назначают при нарушении её функций в качестве заместительной терапии. Кроме того, очищенные ферменты часто используют в биохимических исследованиях в качестве химических реактивов для определения веществ в биологических жидкостях.Слайд 5Белки
полимерные молекулы, мономеры - аминокислоты.
В составе белков в организме
человека встречают 20 α-аминокислот.
Индивидуальность белковых молекул - порядок чередования аминокислот
в белке.Аминокислоты - буквы алфавита, ими, как в слове, записывается информация.
От последовательности аминокислот зависит пространственная структура и функции белка.
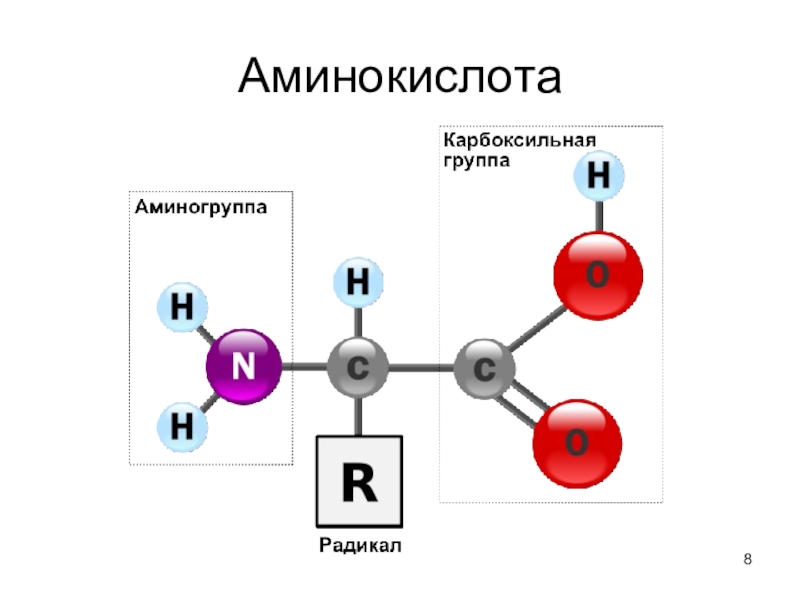
Слайд 6Общие структурные особенности
аминокислот, входящих в состав белков
наличие амино-
и карбоксильной групп, соединённых с одним и тем же α-углеродным
атомом.R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
Слайд 7В водных растворах при нейтральном значении рН α- аминокислоты существуют
в виде биполярных ионов.
в природе а/к -в двух изомерных
формах - L и D. Исключение составляет глицин, который не имеет асимметричного α-углеродного атома, так как его радикал представлен только атомом водорода.В составе белков присутствуют только L-изомеры аминокислот.
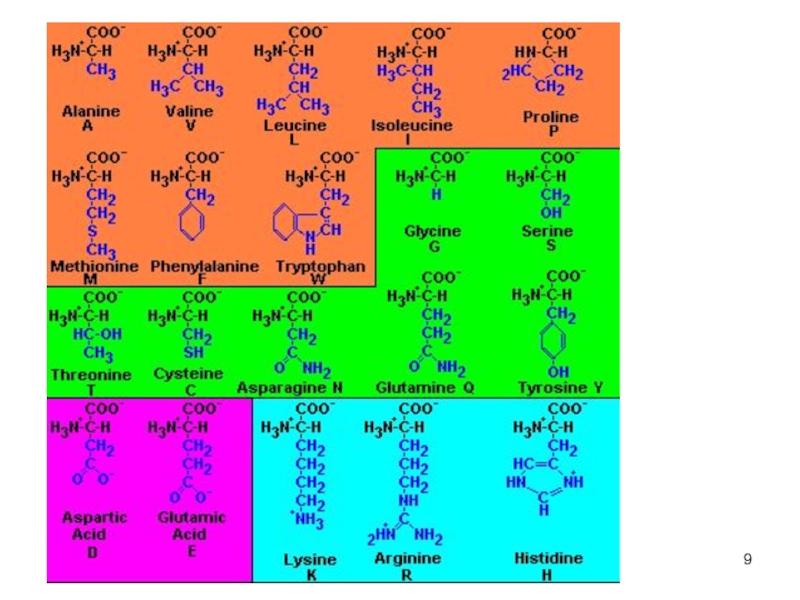
Слайд 10Классификация аминокислот
По радикалу
Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан
Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, аспарагин, глутамин, тирозин
Полярные заряженные отрицательно
при pH7: лизин, аргинин, гистидин
Слайд 11Классификация аминокислот
По функциональным группам (радикалам)
Ароматические: фенилаланин, тирозин, триптофан
Гетероциклические: гистидин, пролин
Серосодержащие: цистеин, метионин
Нециклические: все остальные
Слайд 12Классификация аминокислот
Незаменимые
валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин.
Заменимые
глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
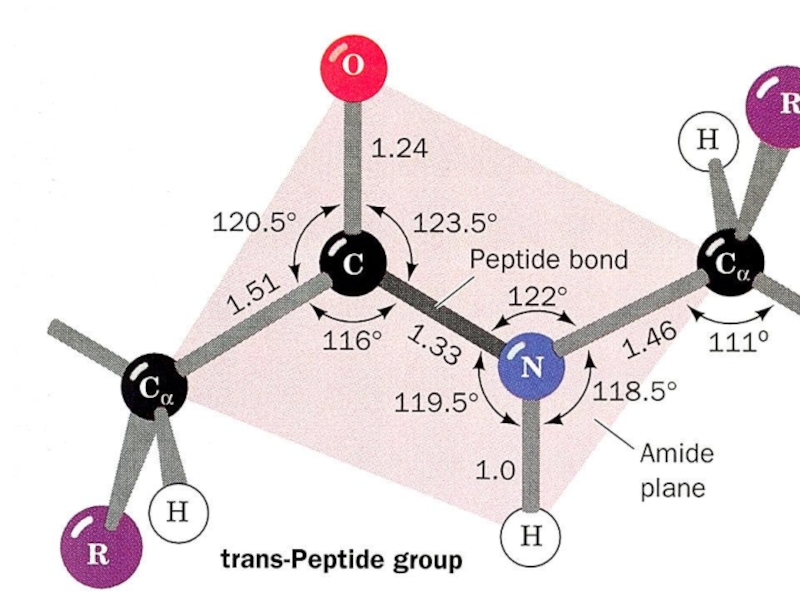
Слайд 13Пептидная связь
α-Аминокислоты могут ковалентно связываться друг с другом с
помощью пептидных связей.
Пептидная связь образуется между а-карбоксильной группой одной
аминокислоты и α-аминогруппой другой, т.е. является амидной связью. отщепление молекулы воды
Слайд 15Пептиды
Пептиды до 10 аминокислот - олигопептиды по количеству аминокислот: трипептид,
пентапептид, октапептид
Пептиды, содержащие более 10 аминокислот – полипептиды
Полипептиды, из
более 50 аминокислотных остатков – белки, хотя глюкагон, состоящий из 29 аминокислот, называют белковым гормоном Слайд 17СТРУКТУРА БЕЛКА
Пептидные цепи содержат а/к остатки, соединены пептидными связями.
(прочные, разрыв - фермент)
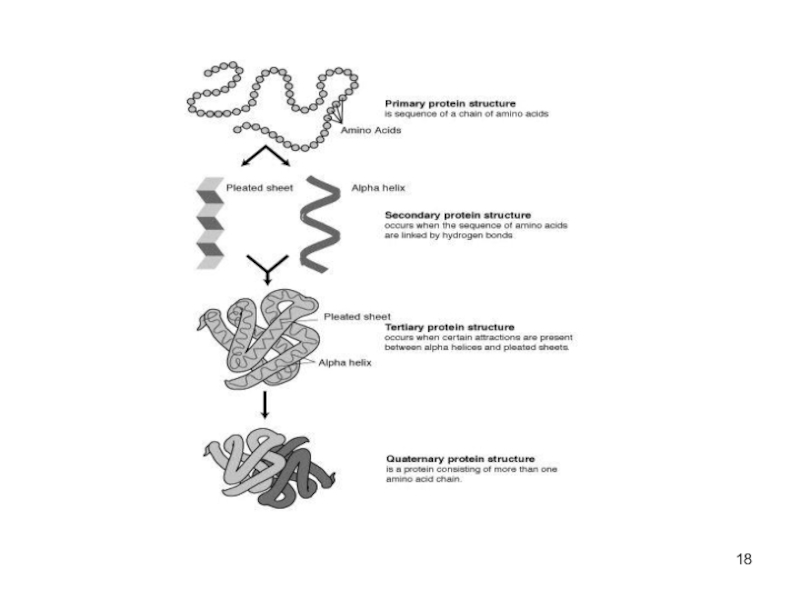
Белок имеет определённую пространственную структуру, она определяет
функции белка.Различают 4 уровня структурной организации белков
Слайд 19Первичная структура белка
линейная последовательность а/к в полипептидной цепи
первичная структура каждого
белка закодирована в одном гене
Слайд 20Вторичная структура белка
Линейные цепи а\к приобретают пространственную трёхмерную структуру -"конформацию".
образуется за счёт взаимодействия функциональных групп аминокислот
обусловлена первичной структурой белка.
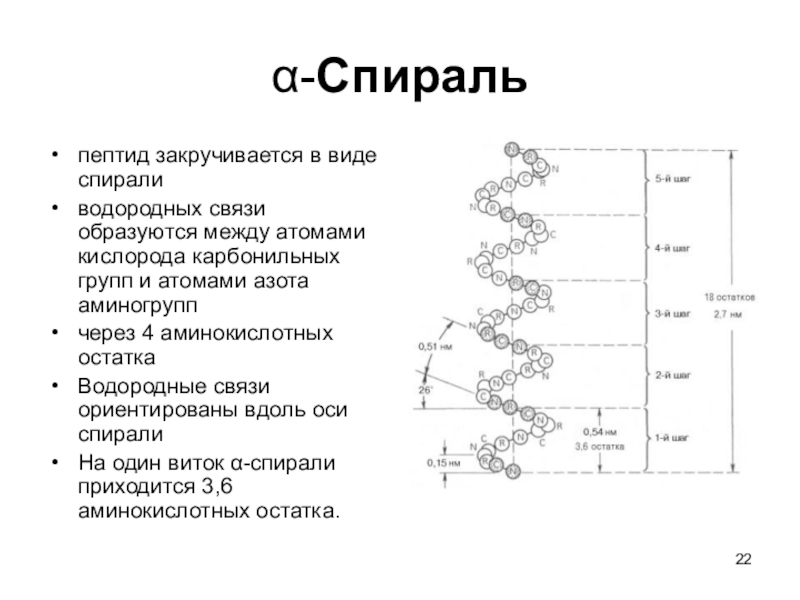
Слайд 22α-Спираль
пептид закручивается в виде спирали
водородных связи образуются между
атомами кислорода карбонильных групп и атомами азота аминогрупп
через 4
аминокислотных остаткаВодородные связи ориентированы вдоль оси спирали
На один виток α-спирали приходится 3,6 аминокислотных остатка.
Слайд 23β-Структура
формируется за счёт образования водородных связей между атомами пептидных групп
β-Структура образует фигуру, подобную листу, сложенному "гармошкой",
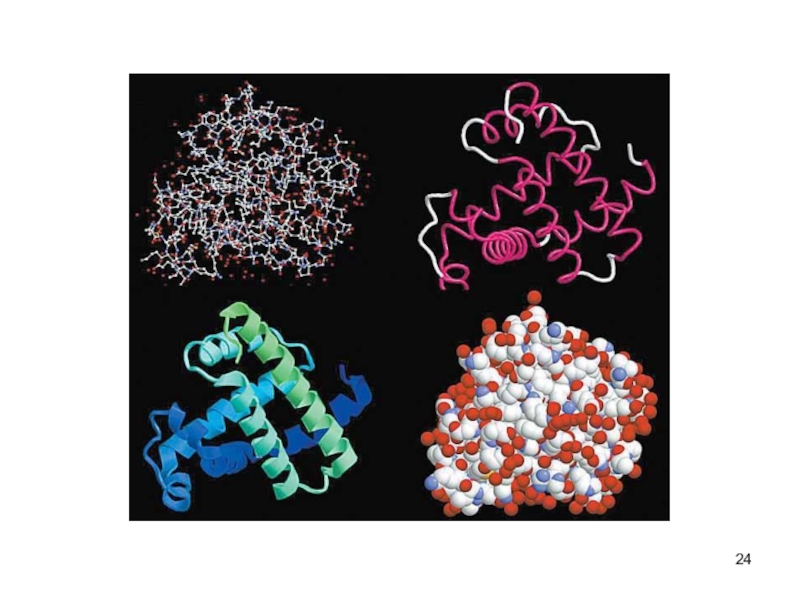
Слайд 25Третичная структура белков
трёхмерная пространственная структура
образуетсяза счёт взаимодействий между радикалами аминокислот,
стоящих на значительном расстоянии друг от друга в цепи
функционально активная
конформация - "нативная структура". Слайд 26Доменная структура белков
Если полипептидная цепь белка содержит более 200
аминокислот, как правило, её пространственная структура сформирована в виде двух
или более доменов.Домен - участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи конформацию глобулярного белка.
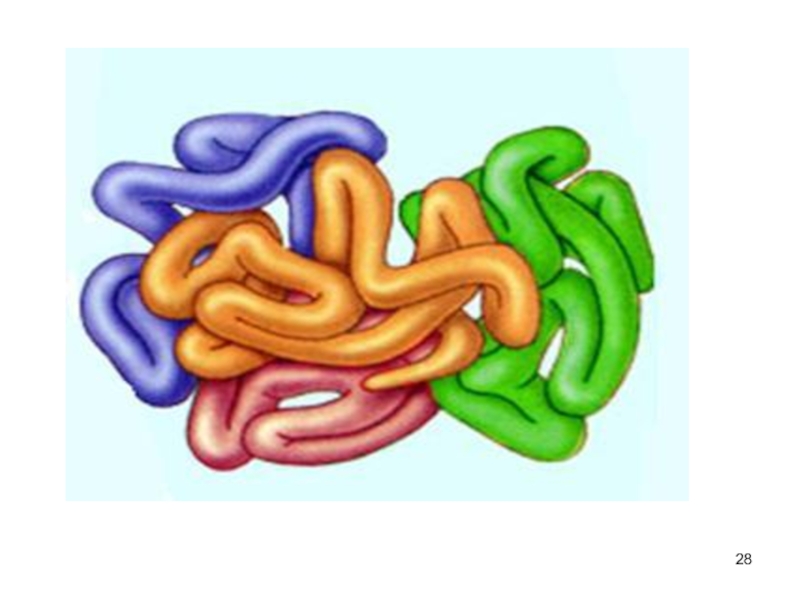
Слайд 27Четвертичная структура белков
существуют белки, состоящие из двух и более
полипептидных цепей
после формирования трёхмерной структуры каждой полипептидной цепи они объединяются
связи, соединяющие полипептидные цепи: гидрофобные, ионные, водородные
отдельные полипептидные цепи - субъединицы
Слайд 29Физико-химические свойства белков
Индивидуальные белки различаются по своим физико-химическим свойствам:
форме молекул
молекулярной массе,
суммарному заряду молекулы,
соотношению полярных и неполярных
групп на поверхности нативной молекулы белка, растворимости белков,
степени устойчивости к воздействию денатурирующих агентов.
Слайд 301. Различия белков по форме молекул
по форме молекул белки делят
на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру,
их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки).Слайд 312. Различия белков по молекулярной массе
Белки - высокомолекулярные соединения,
но могут сильно отличаться по молекулярной массе, которая колеблется от
6000 до 1 000 000 Д и выше (Д)альтон — единица массы, равная массе атома водорода (1 а.е.м.). Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц).Слайд 323. Суммарный заряд белков
Белки имеют в своём составе радикалы
лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы,
способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apr и Гис.Слайд 33Степень ионизации функциональных групп этих радикалов зависит от рН среды.
При рН раствора около 7 все ионогенные группы белка находятся
в ионизированном состоянии. В кислой среде увеличение концентрации протонов (Н+) приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков: -СОО- + Н+ → -СООН. В щелочной среде связывание избытка ОН" с протонами, образующимися при диссоциации NH3+с образованием воды, приводит к уменьшению положительного заряда белков:Слайд 34Значение рН, при котором белок приобретает суммарный нулевой заряд, называют
"изоэлектрическая точка" и обозначают как pI. В изоэлектрической точке количество
положительно и отрицательно заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии.Слайд 35Так как большинство белков в клетке имеет в своём составе
больше анионогенных групп (-СОО-), то изоэлектрическая точка этих белков лежит
в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, - гистоны, входящие в состав хроматина.Слайд 36Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем
белки, находящиеся в изоэлектрической точке. Суммарный заряд увеличивает количество диполей
воды, способных связываться с белковой молекулой, и препятствует контакту одноимённо заряженных молекул, в результате растворимость белков увеличивается. Заряженные белки могут двигаться в электрическом поле: анионные белки, имеющие отрицательный заряд, будут двигаться к положительно заряженному аноду (+), а катионные белки - к отрицательно заряженному катоду (- ). Белки, находящиеся в изоэлектрическом состоянии, не перемещаются в электрическом поле.Слайд 374. Соотношение полярных и неполярных
групп на поверхности нативных молекул
белков
На
поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных
и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде.Слайд 385. Растворимость белков
Растворимость белков в воде зависит от всех
перечисленных выше свойств белков: формы, молекулярной массы, величины заряда, соотношения
полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать вьшадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.Слайд 39Методы выделения и очистки белков
Получение индивидуальных белков из биологического
материала (тканей, органов, клеточных культур) требует проведения последовательных операций, включающих:
дробление биологического материала и разрушение клеточных мембран;
фракционирование органелл, содержащих те или иные белки;
экстракцию белков (перевод их в растворённое состояние);
разделение смеси белков на индивидуальные белки.
Слайд 40
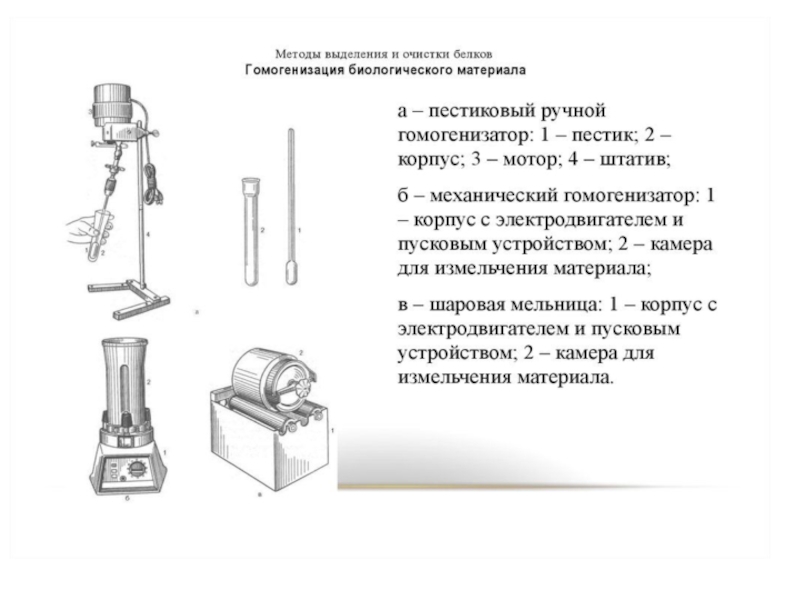
1. Методы разрушения тканей
и экстракции белков
Гомогенизация биологического материала
Ткань,
находящуюся в буферном растворе с определённым значением рН и концентрацией
солей, помещают в стеклянный сосуд (гомогенизатор) с пестиком. Вращающийся пестик измельчает и растирает ткань о притёртые стенки сосуда.Слайд 42Метод замораживания и оттаивания ткани
В результате попеременного замораживания и
оттаивания образующиеся кристаллы льда разрушают оболочки клеток.
После разрушения ткани
нерастворимые части осаждают центрифугированием. Последующее центрифугирование гомогената с разной скоростью позволяет получить отдельные фракции, содержащие клеточные ядра, митохондрии и другие органеллы, а также надосадочную жидкость, в которой находятся растворимые белки цитозоля клетки. Искомый белок будет содержаться в одной из этих фракций. Слайд 43Экстракция белков, связанных с мембранами, и разрушение олигомерных белков на
протомеры
Если искомый белок прочно связан с какими-либо структурами клетки,
его необходимо перевести в раствор. Так, для разрушения гидрофобных взаимодействий между белками и липидами мембран в раствор добавляют детергенты; чаще всего используют тритон Х-100 или додецилсульфат натрия. Механизм действия детергентов описан в разделе "Денатурация белков". При действии детергентов обычно разрушаются и гидрофобные взаимодействия между протомерами в олигомерных белках.
Слайд 44Удаление из раствора небелковых веществ
Нуклеиновые кислоты, липиды и другие
небелковые вещества можно удалить из раствора, используя их Особенные физико-химические
свойства.липиды легко удаляются из раствора добавлением органических растворителей, например ацетона. Однако воздействие должно быть кратковременным, так как ацетон вызывает денатурацию некоторых белков. Нуклеиновые кислоты осаждают добавлением в раствор стрептомицина.
Слайд 45Методы очистки белков
Очистка белков избирательной денатурацией
Большинство белков денатурирует
и выпадает в осадок уже при кратковременном нагревании раствора до
50-70 °С или подкислении раствора до рН 5. Если выделяемый белок выдерживает эти условия, то с помощью избирательной денатурации можно удалить большую часть посторонних белков, отфильтровав выпавшие в осадок-белки, или осадить их центрифугированием.Слайд 46Высаливание
Метод очистки белков, основанный на различиях в их растворимости
при разной концентрации соли в растворе. Соли щелочных и щёлочно-земельных
металлов вызывают обратимое осаждение белков, т.е. после их удаления белки вновь приобретают способность растворяться, сохраняя при этом свои нативные свойства.Чаще всего для разделения белков методом высаливания используют разные концентрации солей сульфата аммония - (NH4)2SO4. Чем выше растворимость белка, тем большая концентрация соли необходима для его высаливания.
Слайд 47
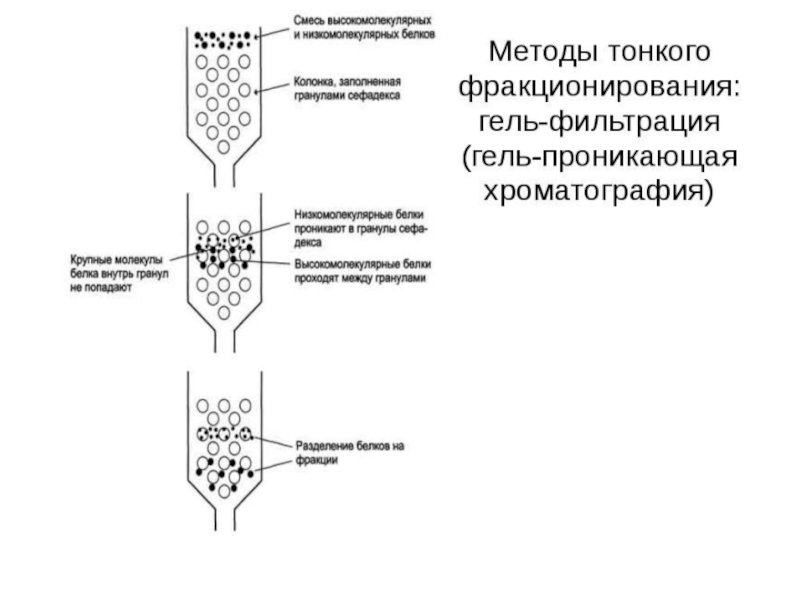
Гель-фильтрация, или метод молекулярных сит
Для разделения белков часто используют
хроматографические методы, основанные на распределении веществ между двумя фазами, одна
из которых подвижная, а другая неподвижная. В основу хроматографических методов положены разные принципы: гель-фильтрации, ионного обмена, адсорбции, биологического сродства.Слайд 48Метод разделения белков с помощью гель-фильтрационной хроматографии основан на том,
что вещества, отличающиеся молекулярной массой, по-разному распределяются между неподвижной и
подвижной фазами. Хроматографическая колонка заполняется гранулами пористого вещества (сефадекс, агароза и др.). В структуре полисахарида образуются поперечные связи и формируются гранулы с "порами", через которые легко проходят вода и низкомолекулярные вещества. В зависимости от условий можно формировать гранулы с разной величиной "пор".Слайд 49Неподвижная фаза - жидкость внутри гранул, в которую способны проникать
низкомолекулярные вещества и белки с небольшой молекулярной массой. Смесь белков,
нанесённую на хроматографическую колонку, вымывают (элюируют), пропуская через колонку растворитель. Вместе с фронтом растворителя движутся и самые крупные молекулы.Слайд 50Более мелкие молекулы диффундируют внутрь гранул сефадекса и на некоторое
время попадают в неподвижную фазу, в результате чего их движение
задерживается. Величина пор определяет размер молекул, способных проникать внутрь гранул (рис. 1-55).Слайд 51Так как гелевая структура сефадекса легко деформируется под давлением, гели
стали заменять более жёсткими матрицами (сефактил, той-оперл), представляющими сферические гранулы
с разными размерами пор. Выбор размеров пор в гранулах зависит от целей хроматографии (о других хроматографических методах будет сказано ниже).Слайд 54Факторы, влияющие на активность ферментов. Способы регуляции работы ферментов.
Лабораторная работа
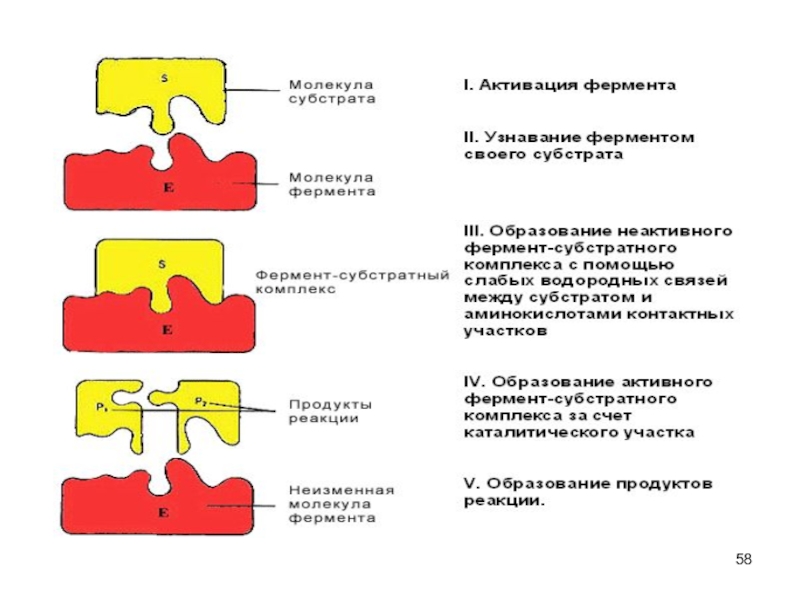
Слайд 55Каталитическая функция
Ферменты (энзимы) – белки - увеличивают скорость протекания химической
реакции, при этом не расходуются
биологическая функция фермента обусловлена наличием в
его структуре активного центра (АЦ)в АЦ фермента есть участки связывания субстрата, и участки химического превращения субстрата (каталитический участок).
Слайд 56Фермент-субстратные реакции
В участке связывания субстрат связывается с ферментом - фермент-субстратный
комплекс.
В каталитическом участке субстрат превращается в продукт
продукт отщепляется от
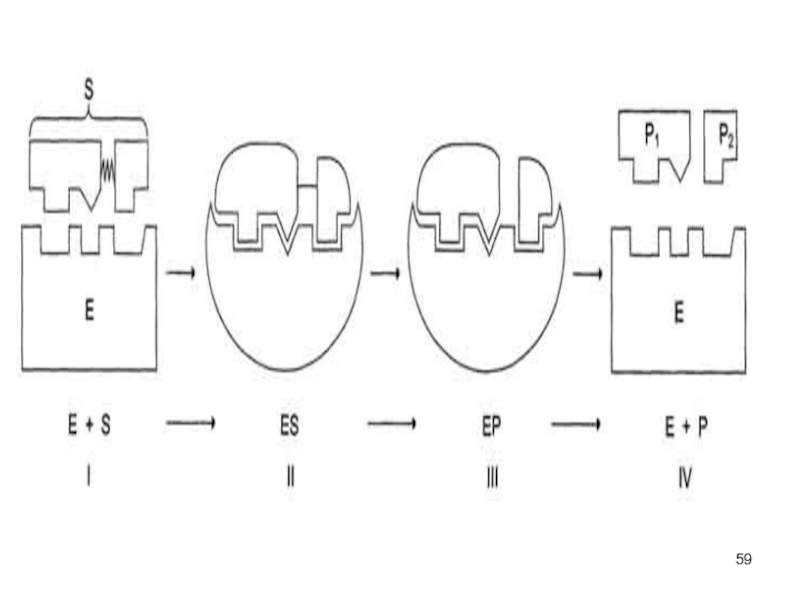
активного центра фермента. Слайд 57Катализ
Схематично процесс катализа можно представить следующим уравнением:
Е + S
↔ ES ↔ ЕР ↔ Е + Р,
где Е
- фермент (энзим), S - субстрат, Р - продукт. Слайд 61Специфичность
наиболее важное свойство ферментов.
субстратная сп.- способность фермента взаимодействовать лишь
с одним или несколькими определёнными субстратами.
Слайд 62Специфичность
Выделяют
абсолютную субстратную специфичность (катализ 1 субстрата) - аргиназа;
групповую субстратную
специфичность однотипные реакции с группой структурно похожих субстратов - панкреатическая
липаза ;стереоспецифичность специфичность ферментов к стереоизомерам (L-аминокислотам )