Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ФГБОУ ВО БГМУ Минздрава России Кафедра общей химии ЛЕКЦИЯ 2 Биологически важные
Содержание
- 1. ФГБОУ ВО БГМУ Минздрава России Кафедра общей химии ЛЕКЦИЯ 2 Биологически важные
- 2. Реакционная способность альдегидов и кетонов.
- 3. Карбонильные соединенияАльдегиды
- 4. Классификация и номенклатура альдегидов По характеру углеводородного
- 5. Классификация и номенклатура кетонов По характеру углеводородных
- 6. Гомологический ряд насыщенных альдегидов состава С1 –
- 7. Реакционные центры в молекулах карбонильных соединений на
- 8. Общая схема реакции нуклеофильного присоединения в карбонильных соединенияхδ+δ-+ Е – NuE +
- 9. Сравнение реакционной способности альдегидов и кетонов в
- 10. Реакции нуклеофильного присоединения АN1. ПРИСОЕДИНЕНИЕ ВОДЫ+ НОНформальдегидгидрат формальдегидаδ++ НОН хлоральхлоральгидрат устойчив
- 11. δ +δ -+ С2Н5ОННСI сух.2. ПРИСОЕДИНЕНИЕ СПИРТОВуксусный
- 12. 3. Присоединение гидросульфита натриядля выделения из
- 13. 5. Присоединение циановодородной кислоты2-гидроксибутаннитрил
- 14. Реакции карбонильных соединений с азотсодержащими нуклеофилами АN - EМЕХАНИЗМ:+ NH2 - XН2О + монозамещенный иминδ +
- 15. Реакции карбонильных соединений с азотсодержащими нуклеофилами АN - E+ NH3этаналь+ Н2О + Н2Оимин+ NH2- CH3N-замещенный иминэтанальметиламин
- 16. Реакции карбонильных соединений с азотсодержащими нуклеофилами АN - E+ NH2- ОН+ Н2Оацетонацетоноксим+ NH2 – NH2гидроксиламингидразингидразон+ Н2О
- 17. Реакции с углеродсодержащими нуклеофиламиПрисоединение магнийорганических соединений
- 18. Реакции с участием С-Н-кислотного центра Альдольно-кротоновая конденсация+
- 19. Реакции окисленияокислениеδ +Реакция «серебряного зеркала»+ [Ag(NH3)2]OHCH3-COONH4+Ag+ NH3+H2Oуксусный альдегид+ 2Сu(OH)2tCH3-COOH+ Cu2O+ 2H2Oоранжево- красный
- 20. Восстановление карбонильных соединенийВосстанавливающие реагенты: Н2 / Ni,
- 21. Реакции диспропорционирования (Канниццаро) КОН конц.+бензальдегидсоль кислоты бензоат калияпервичный спирт бензиловый спирт2H2O2HCOOН + СН3-ОНформальдегидмуравьиная кислотаметанол
- 22. Реакционная способность карбоновых кислот
- 23. Классификация карбоновых кислотПо числу карбоксильных групп:монокарбоновыедикарбоновыетрикарбоновые и т.д.щавелевая к-тауксусная к-та
- 24. Классификация карбоновых кислотпо строению углеводородного радикала:никотиновая к-тауксусная к-тациклогексановая к-табензойная к-та -алифатические -ароматические-гетероциклические-алициклические
- 25. Номенклатура алифатических карбоновых кислоттривиальноеназваниеIUPAC муравьиная к-та(формиаты)метановаякислотауксусная к-та(ацетаты)этановаякислотапропионовая к-та(пропионаты)пропановаякислота
- 26. IUPAC масляная к-та(бутираты)бутановаякислотавалериановая к-та(валераты)пентановаякислотаНоменклатура алифатических карбоновых кислоттривиальноеназваниеизовалериановая к-та(изовалериаты)3-метил-бутановаякислота
- 27. Непредельные карбоновые кислотыакриловая кислотапропеновая кислотаметакриловая кислота2-метилпропеновая кислота
- 28. Алифатические дикарбоновые кислотыэтандиовая кислота(оксалаты)щавелевая кислотапропандиовая кислота(малонаты)малоновая кислота
- 29. Алифатические дикарбоновые кислотыбутандиовая кислота(сукцинаты)янтарная кислотапентандиовая кислота(глутараты)глутаровая кислота
- 30. Непредельные дикарбоновые кислотыН СООН СООН Н Н СООН НООС Н малеиновая кислотацис-бутендиоваяфумаровая кислотатранс-бутендиовая
- 31. Реакционные центры в молекулах карбоновых кислотRCCOO HHHδ+δ-электрофильныйцентр:основный центрδ' +CH-кислотныйцентр..OH-кислотный центр
- 32. Кислотные свойства +NaOH+H2Oпропионовая кислотапропионат натриябензойная кислота+NaHCO3бензоат натрия+CO2+H2O
- 33. Кислотные свойства карбоновых кислот Электроноакцепторные заместители в
- 34. Реакции нуклеофильного замещения+E+ Nu--E+присоеди-нениеE+замещениеE+ OH-+E+
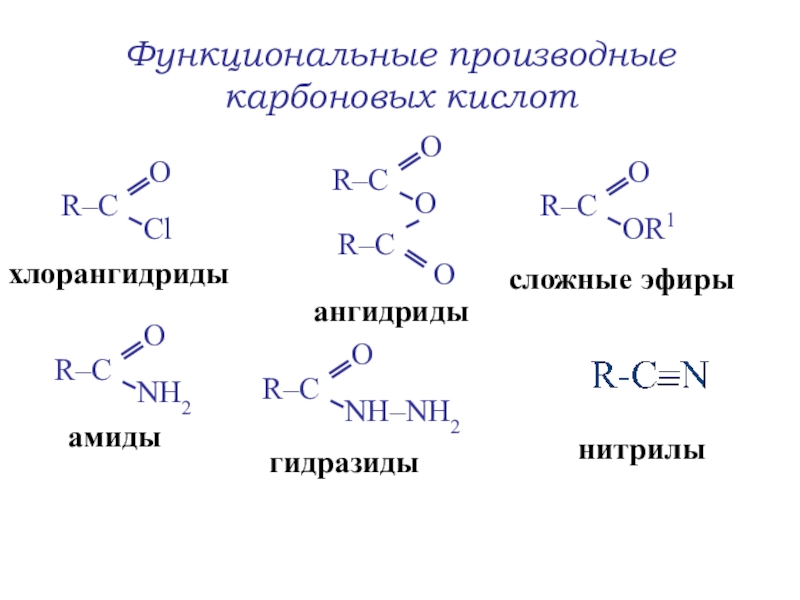
- 35. Функциональные производные карбоновых кислотхлорангидридыангидридысложные эфирыгидразидыамидынитрилы
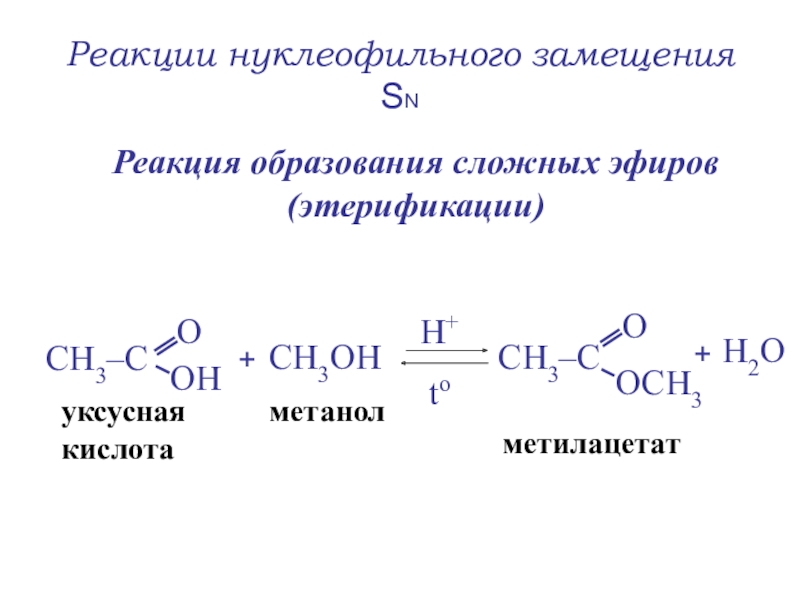
- 36. Реакции нуклеофильного замещения SNРеакция образования сложных эфиров (этерификации)+СН3ОНН+ to +уксуснаякислотаметанолметилацетатН2О
- 37. Получение хлорангидридовуксусная кислота+SOCl2++HClSO2ацетилхлорид+РCl5+РOCl3+HClбензоилхлоридбензойная кислотатионилхлоридtoto
- 38. Получение ангидридов++Н2ОР2О5 , toуксусный ангидрид
- 39. Получение амидов NH3 to+Н2Опропионовая кислотапропионат аммонияамид пропионовой кислоты
- 40. Реакции карбоновых кислот по радикалуНасыщенные алифатические карбоновые кислотыСН3–СН2–СООН + Cl2Ркр, tпропионовая кислотаα-хлорпропионовая кислота
- 41. Реакции карбоновых кислот по радикалуНенасыщенные карбоновые кислотыРеакция галоганированияСН2=СН–СООН + Br2H2Oпропеновая кислота2,3-дибромпропановая кислота
- 42. Реакции карбоновых кислот по радикалуНенасыщенные карбоновые кислоты+
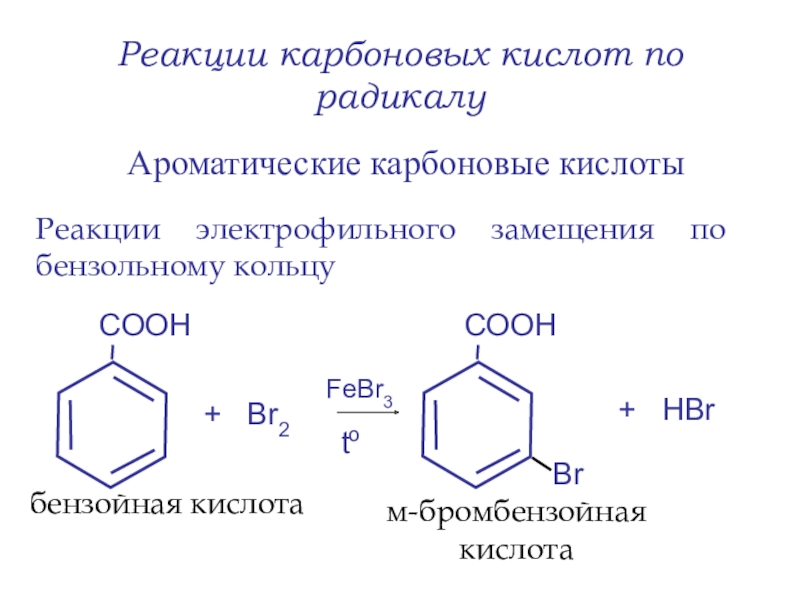
- 43. Реакции карбоновых кислот по радикалуАроматические карбоновые кислотыРеакции
- 44. Дикарбоновые кислоты
- 45. Кислотные свойстваNaOH– Н2O NaOH– Н2O щавелевая кислотакислый оксалат натрия (мононатриевая соль)оксалат натрия (динатриевая соль)
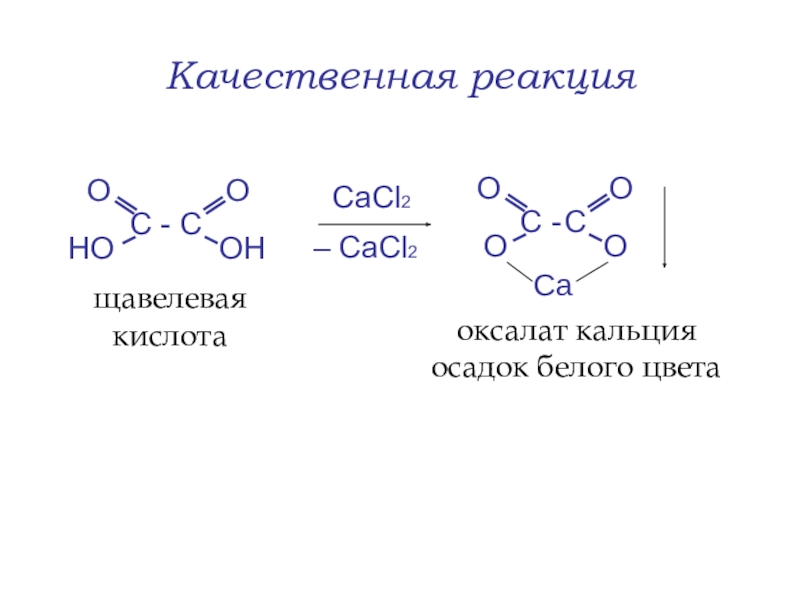
- 46. Качественная реакцияСaСl2– СaCl2 щавелевая кислотаоксалат кальция осадок белого цвета Ca
- 47. Реакции нуклеофильного замещенияСН3OH Н + СН3OHН + янтарная кислотамонометилсукцинатдиметилсукцинат
- 48. Специфические свойстващавелевая кислотаДекарбоксилирование С ОО
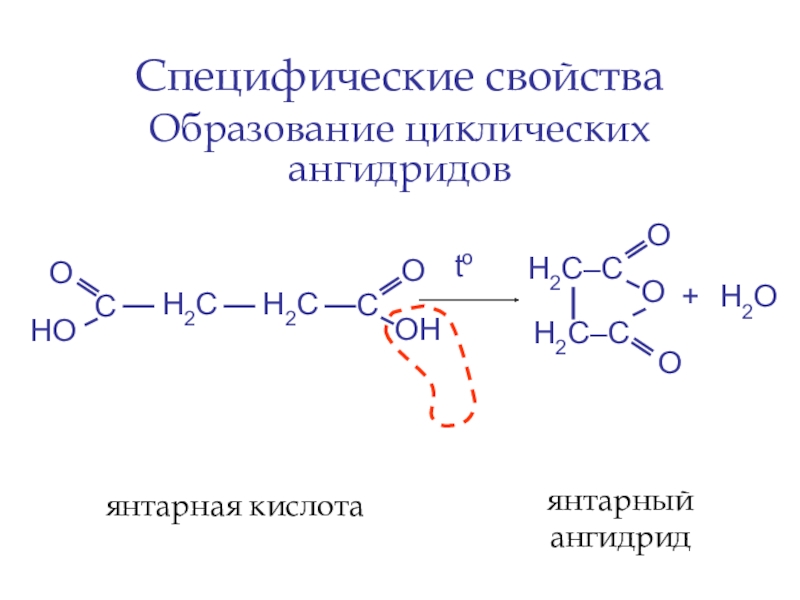
- 49. Специфические свойстваОбразование циклических ангидридов С Н2СН2С to +Н2Оянтарная кислотаянтарный ангидрид
- 50. Контрольные вопросы:Назовите реакционные центры в молекулах карбонильных
- 51. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ФГБОУ ВО БГМУ Минздрава России Кафедра общей химии ЛЕКЦИЯ 2 Биологически важные
реакции карбонильных соединений. Карбоновые кислоты и их производные.
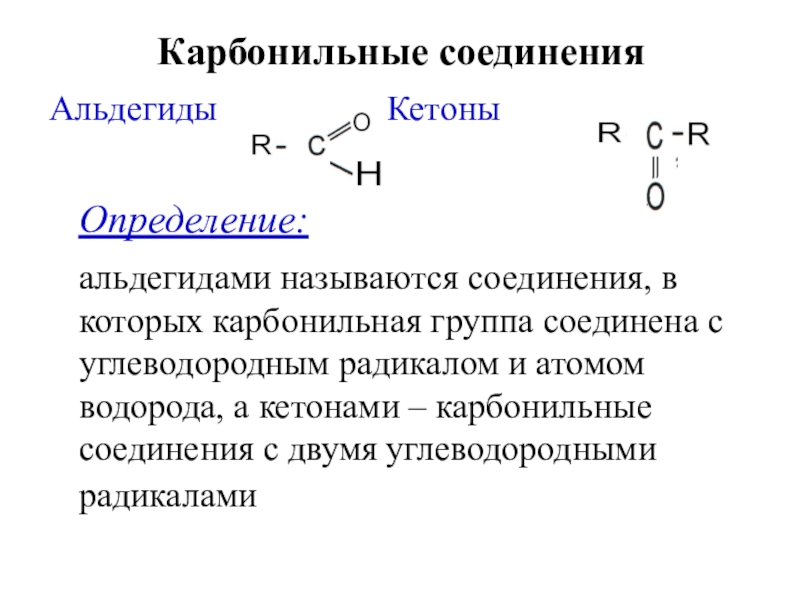
Слайд 3Карбонильные соединения
Альдегиды
Кетоны
Определение:
альдегидами называются соединения,
в которых карбонильная группа соединена с углеводородным радикалом и атомом водорода, а кетонами – карбонильные соединения с двумя углеводородными радикалами Слайд 4Классификация и номенклатура альдегидов
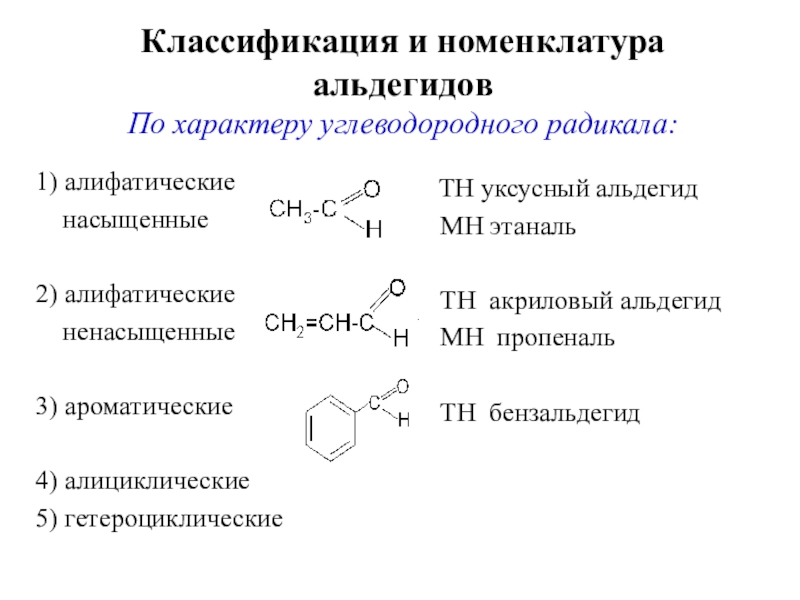
По характеру углеводородного радикала:
1) алифатические
насыщенные
2)
алифатические
ненасыщенные
3) ароматические
4) алициклические
5) гетероциклические
ТН уксусный альдегид
МН этаналь ТН акриловый альдегид
МН пропеналь
ТН бензальдегид
Слайд 5Классификация и номенклатура кетонов
По характеру углеводородных радикалов:
алифатические насыщенные
ароматические
смешанные
ТН ацетон
РН диметилкетон
МН пропанон РН дифенилкетон
РН метилфенилкетон
ТН ацетофенон
Слайд 6Гомологический ряд насыщенных альдегидов состава С1 – С5
С1
С2
С3
С4
С5
ТН муравьиный альдегид; формальдегид
МН метаналь
ТН уксусный альдегид; ацетальдегид
МН этаналь
ТН пропионовый альдегид
МН пропаналь
ТН масляный альдегид
МН бутаналь
ТН валериановый альдегид
МН пентаналь
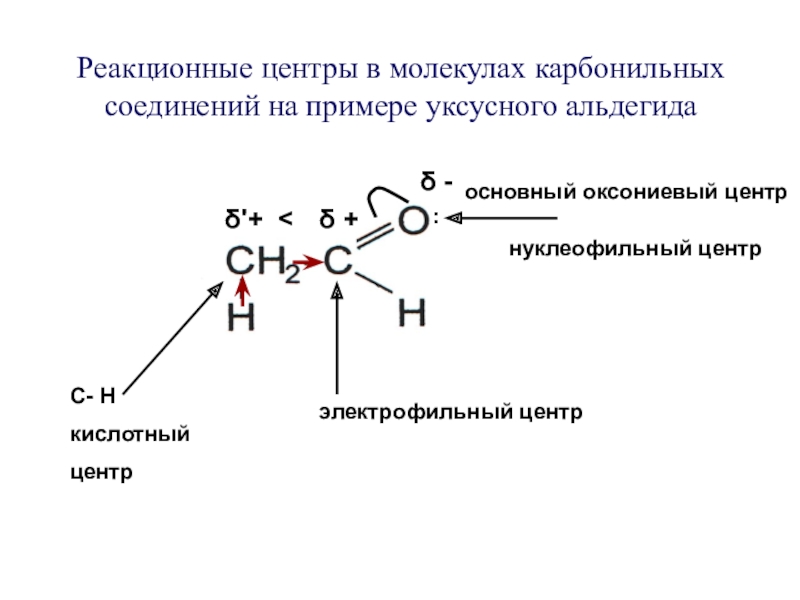
Слайд 7Реакционные центры в молекулах карбонильных соединений на примере уксусного альдегида
С- Н
кислотный
центр
электрофильный центр
основный оксониевый центр
нуклеофильный центр
δ'+ <
δ +
δ -
:
Слайд 9Сравнение реакционной способности альдегидов и кетонов в реакциях AN
Выводы:
Альдегиды обладают
большей реакционной способностью, чем кетоны.
Электроноакцепторные заместители увеличивают реакционную способность, электронодонорные
заместители – уменьшают. Ароматические альдегиды и кетоны менее реакционноспособные, чем алифатические.
В гомологическом ряду насыщенных альдегидов реакционная способность уменьшается.
Слайд 10Реакции нуклеофильного присоединения АN
1. ПРИСОЕДИНЕНИЕ ВОДЫ
+ НОН
формальдегид
гидрат формальдегида
δ+
+ НОН
хлораль
хлоральгидрат
устойчив
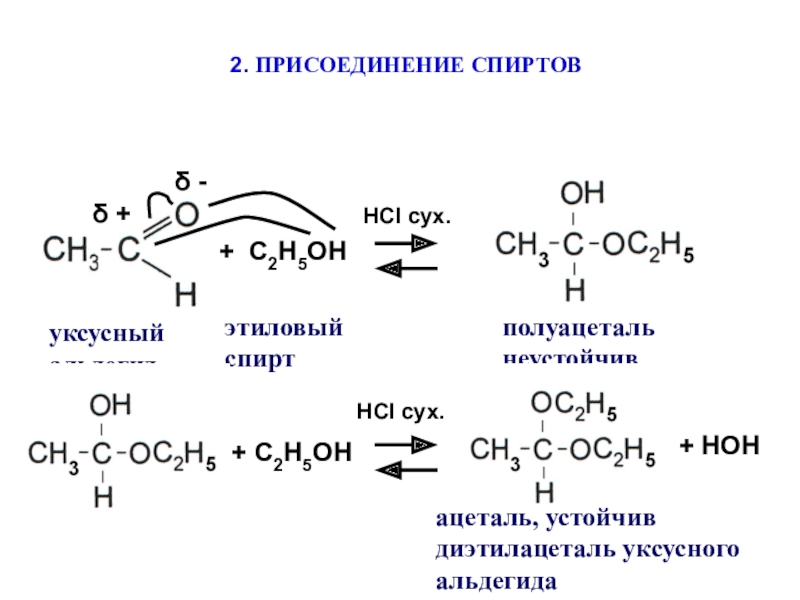
Слайд 11δ +
δ -
+ С2Н5ОН
НСI сух.
2. ПРИСОЕДИНЕНИЕ СПИРТОВ
уксусный альдегид
этиловый спирт
полуацеталь неустойчив
+
С2Н5ОН
НСI сух.
+ НОН
ацеталь, устойчив диэтилацеталь уксусного альдегида
Слайд 12
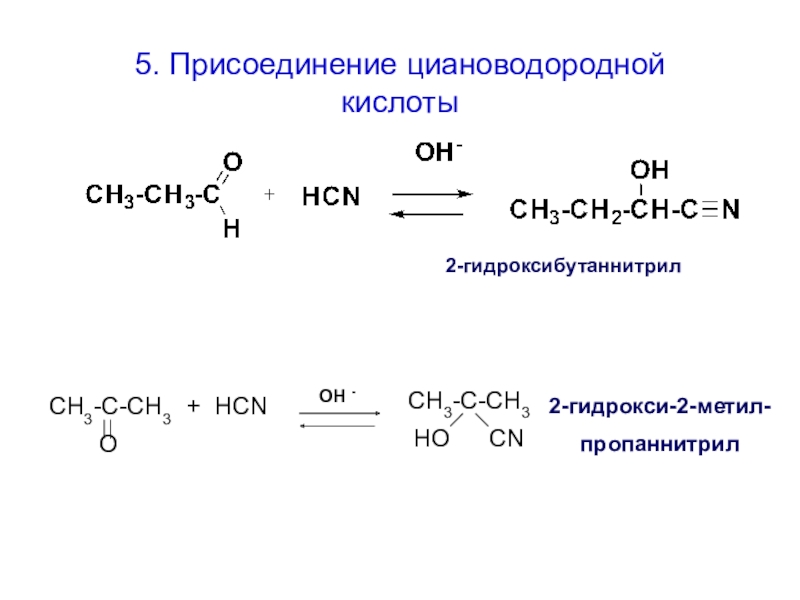
3. Присоединение гидросульфита натрия
для выделения из смеси и очистки
карбонильных соединений
4. Реакция с тиолами
для «защиты» карбонильной группы
Слайд 14Реакции карбонильных соединений с азотсодержащими нуклеофилами АN - E
МЕХАНИЗМ:
+ NH2
- X
Н2О +
монозамещенный имин
δ +
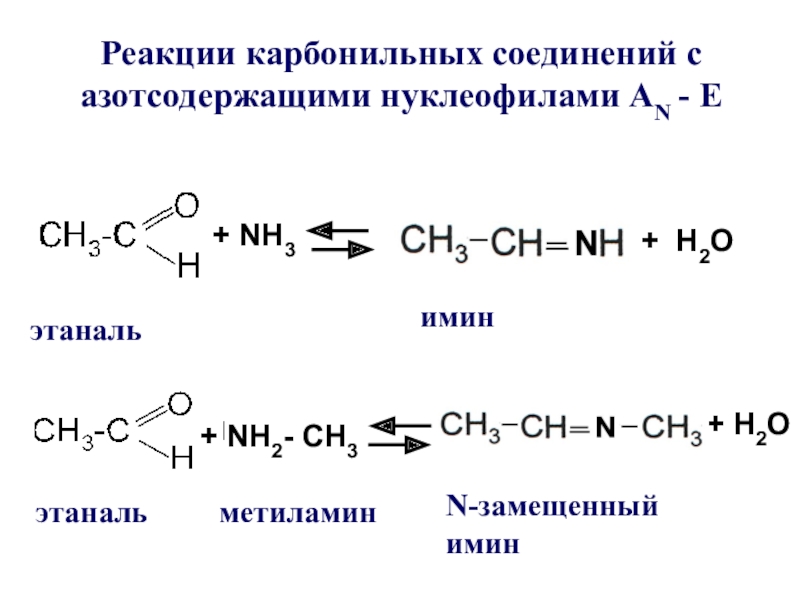
Слайд 15Реакции карбонильных соединений с азотсодержащими нуклеофилами АN - E
+ NH3
этаналь
+
Н2О
+ Н2О
имин
+ NH2- CH3
N-замещенный имин
этаналь
метиламин
Слайд 16Реакции карбонильных соединений с азотсодержащими нуклеофилами АN - E
+ NH2-
ОН
+ Н2О
ацетон
ацетон
оксим
+ NH2 – NH2
гидроксиламин
гидразин
гидразон
+ Н2О
Слайд 19Реакции окисления
окисление
δ +
Реакция «серебряного зеркала»
+ [Ag(NH3)2]OH
CH3-COONH4
+Ag
+ NH3+H2O
уксусный альдегид
+ 2Сu(OH)2
t
CH3-COOH
+ Cu2O
+
2H2O
оранжево- красный
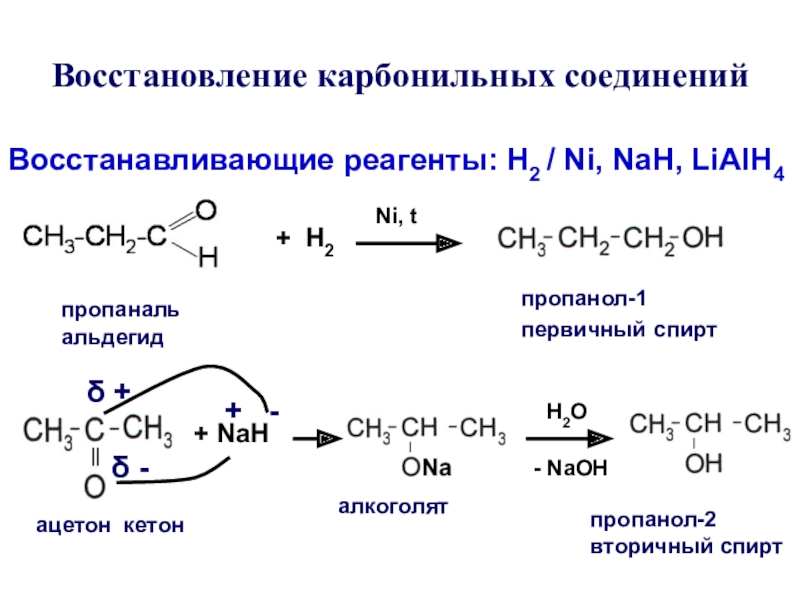
Слайд 20Восстановление карбонильных соединений
Восстанавливающие реагенты: Н2 / Ni, NaH, LiAlH4
пропаналь альдегид
+
Н2
Ni, t
пропанол-1 первичный спирт
ацетон кетон
+ NaH
+ -
δ +
δ -
алкоголят
Н2О
-
NaОHпропанол-2 вторичный спирт
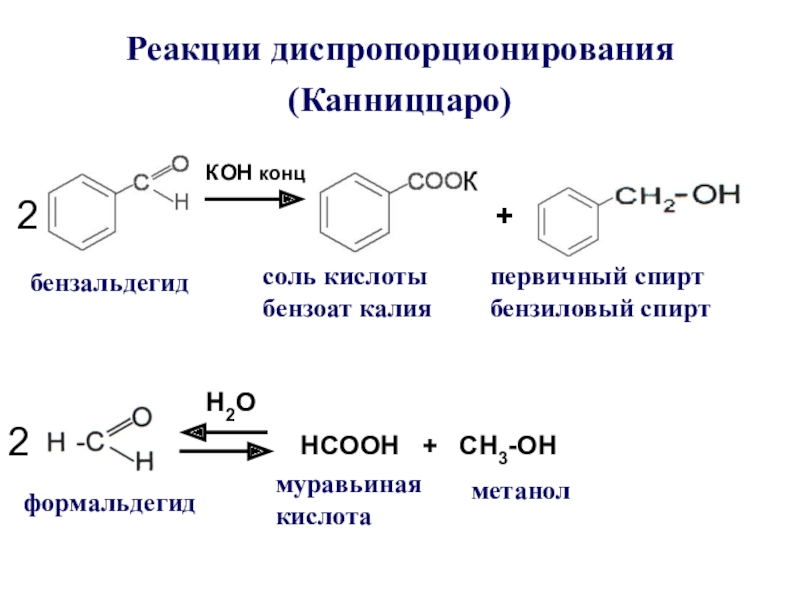
Слайд 21Реакции диспропорционирования (Канниццаро)
КОН конц.
+
бензальдегид
соль кислоты бензоат калия
первичный спирт бензиловый
спирт
2
H2O
2
HCOOН + СН3-ОН
формальдегид
муравьиная кислота
метанол
Слайд 23Классификация карбоновых кислот
По числу карбоксильных групп:
монокарбоновые
дикарбоновые
трикарбоновые и т.д.
щавелевая к-та
уксусная к-та
Слайд 24Классификация карбоновых кислот
по строению углеводородного радикала:
никотиновая к-та
уксусная к-та
циклогексановая к-та
бензойная к-та
-алифатические
-ароматические
-гетероциклические
-алициклические
Слайд 25Номенклатура алифатических карбоновых кислот
тривиальное
название
IUPAC
муравьиная к-та
(формиаты)
метановая
кислота
уксусная к-та
(ацетаты)
этановая
кислота
пропионовая к-та
(пропионаты)
пропановая
кислота
Слайд 26IUPAC
масляная к-та
(бутираты)
бутановая
кислота
валериановая к-та
(валераты)
пентановая
кислота
Номенклатура алифатических карбоновых кислот
тривиальное
название
изовалериановая к-та
(изовалериаты)
3-метил-
бутановая
кислота
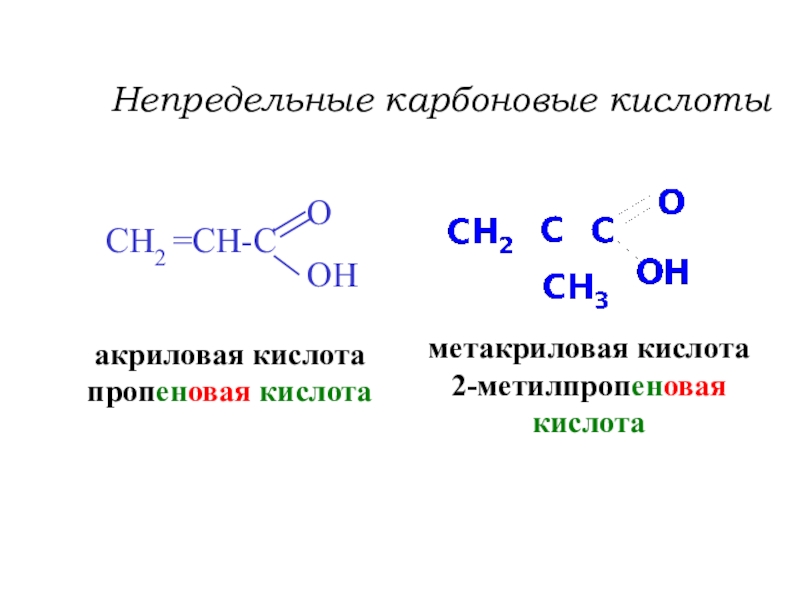
Слайд 27Непредельные карбоновые кислоты
акриловая кислота
пропеновая кислота
метакриловая кислота
2-метилпропеновая
кислота
Слайд 28Алифатические дикарбоновые кислоты
этандиовая кислота
(оксалаты)
щавелевая кислота
пропандиовая кислота
(малонаты)
малоновая кислота
Слайд 29Алифатические дикарбоновые кислоты
бутандиовая кислота
(сукцинаты)
янтарная кислота
пентандиовая кислота
(глутараты)
глутаровая кислота
Слайд 30Непредельные дикарбоновые кислоты
Н
СООН
СООН
Н
Н
СООН
НООС
Н
малеиновая кислота
цис-бутендиовая
фумаровая кислота
транс-бутендиовая
Слайд 31Реакционные центры в молекулах карбоновых кислот
R
C
C
O
O H
H
H
δ+
δ-
электрофильный
центр
:
основный центр
δ'
+
CH-кислотный
центр
..
OH-кислотный центр
Слайд 32Кислотные свойства
+
NaOH
+
H2O
пропионовая кислота
пропионат натрия
бензойная кислота
+
NaHCO3
бензоат натрия
+
CO2
+
H2O
Слайд 33Кислотные свойства карбоновых кислот
Электроноакцепторные заместители в радикале карбоновых кислот
повышают их кислотные свойства, электронодонорные – понижают.
В гомологическом ряду предельных алифатических карбоновых кислот кислотность понижается.Слайд 35Функциональные производные карбоновых кислот
хлорангидриды
ангидриды
сложные эфиры
гидразиды
амиды
нитрилы
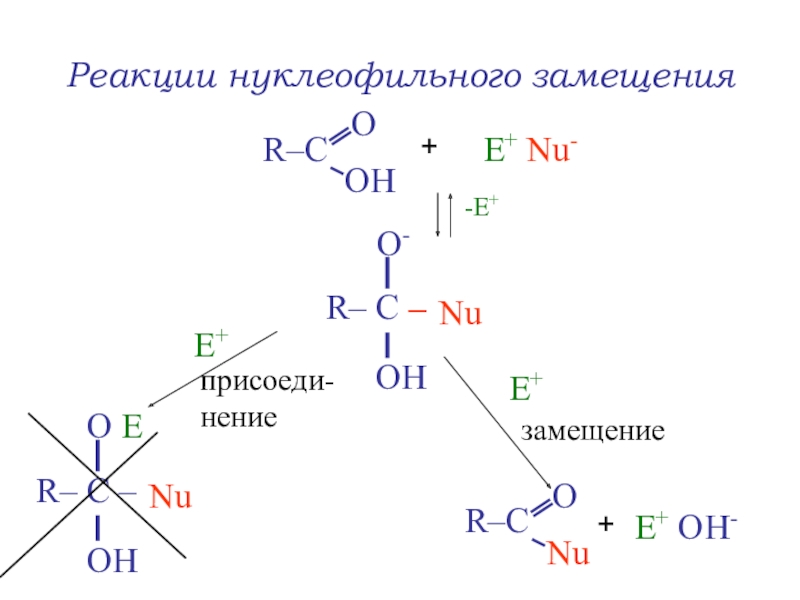
Слайд 36Реакции нуклеофильного замещения SN
Реакция образования сложных эфиров (этерификации)
+
СН3ОН
Н+
to
+
уксусная
кислота
метанол
метилацетат
Н2О
Слайд 37Получение хлорангидридов
уксусная кислота
+
SOCl2
+
+
HCl
SO2
ацетилхлорид
+
РCl5
+
РOCl3
+
HCl
бензоилхлорид
бензойная кислота
тионилхлорид
to
to
Слайд 40Реакции карбоновых кислот по радикалу
Насыщенные алифатические карбоновые кислоты
СН3–СН2–СООН + Cl2
Ркр,
t
пропионовая кислота
α-хлорпропионовая кислота
Слайд 41Реакции карбоновых кислот по радикалу
Ненасыщенные карбоновые кислоты
Реакция галоганирования
СН2=СН–СООН + Br2
H2O
пропеновая
кислота
2,3-дибромпропановая кислота
Слайд 42Реакции карбоновых кислот по радикалу
Ненасыщенные карбоновые кислоты
+ НBr
пропеновая кислота
3-бромпропановая кислота
Реакции
гидрогалогенирования акриловой кислоты протекают против правила Марковникова
δ+
δ-
+ –
Слайд 43Реакции карбоновых кислот по радикалу
Ароматические карбоновые кислоты
Реакции электрофильного замещения по
бензольному кольцу
+ Br2
+ НBr
бензойная кислота
м-бромбензойная кислота
FeBr3
toСлайд 45Кислотные свойства
NaOH
– Н2O
NaOH
– Н2O
щавелевая кислота
кислый оксалат натрия
(мононатриевая соль)
оксалат натрия (динатриевая соль)
Слайд 47Реакции нуклеофильного замещения
СН3OH
Н +
СН3OH
Н +
янтарная кислота
монометилсукцинат
диметилсукцинат
Слайд 48Специфические свойства
щавелевая кислота
Декарбоксилирование
С
О
О
to
+
СО2
муравьиная кислота
малоновая
кислота
С
О
О
to
+
СО2
уксусная кислота
Слайд 49Специфические свойства
Образование циклических ангидридов
С
Н2С
Н2С
to
+
Н2О
янтарная кислота
янтарный ангидрид
Слайд 50Контрольные вопросы:
Назовите реакционные центры в молекулах карбонильных соединений
Сравните реакционную способность
альдегидов и кетонов в реакциях АN
Назовите реакционные центры в молекулах
карбоновых кислотПриведите примеры реакций SN, характерных для карбоновых кислот












![ФГБОУ ВО БГМУ Минздрава России Кафедра общей химии ЛЕКЦИЯ 2 Биологически важные Реакции окисленияокислениеδ +Реакция «серебряного зеркала»+ [Ag(NH3)2]OHCH3-COONH4+Ag+ NH3+H2Oуксусный альдегид+ 2Сu(OH)2tCH3-COOH+ Cu2O+ 2H2Oоранжево- красный Реакции окисленияокислениеδ +Реакция «серебряного зеркала»+ [Ag(NH3)2]OHCH3-COONH4+Ag+ NH3+H2Oуксусный альдегид+ 2Сu(OH)2tCH3-COOH+ Cu2O+ 2H2Oоранжево- красный](/img/tmb/7/651853/6df45ee717273ba9829a01d25ecceee5-800x.jpg)