Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ФОСФОР Элемент V группы
Содержание
- 1. ФОСФОР Элемент V группы
- 2. Электронная формула, степени окисления1S22S22p63S23p3-3 , 0 , +3 , +5Открытие фосфора: Х.Бранд (1669г.)
- 3. Картина Джозефа Райта «Алхимик, открывающий фосфор» предположительно описывающая открытие фосфора Хеннигом Брандом, 1771 год.
- 4. Аллотропные модификацииФОСФОР (стр. 259)белый
- 5. Слайд 5
- 6. Аллотропные модификацииБелый фосфор (Р4) – молекулярная кристал-лическая
- 7. Биологическое значениеСоставная часть тканей организмовАТФ – собиратель и носитель энергииВходит в состав ДНК и РНКНеобходим растениям
- 8. Химические свойства фосфоравосстановитель(+3,+5)Р + О2 → P
- 9. Применение фосфораПроизводство спичек (в головке спички)Водоотнимающее средство
- 10. Установить соответствиеа) P2O5б) H3PO3в) K3PO4г) H3PO4д) PH3е) P2O31. - 32. 03. +14. +25. +36. +5
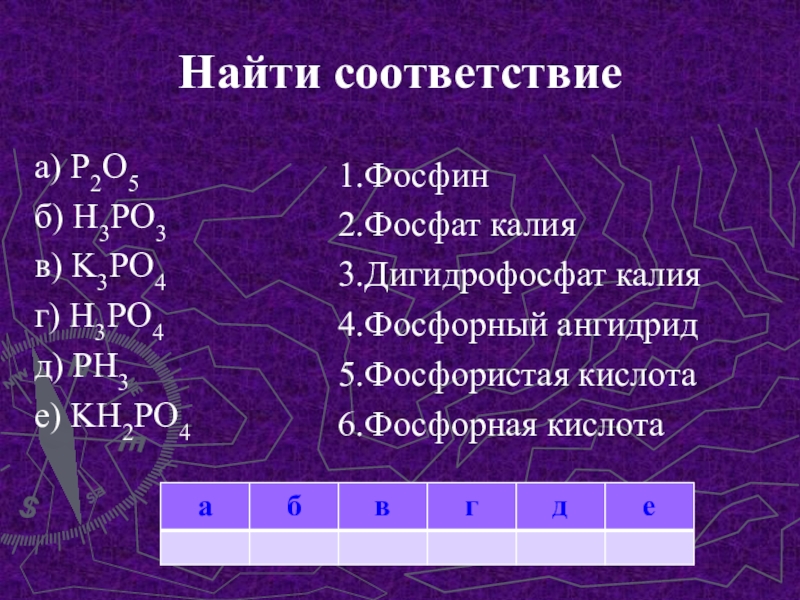
- 11. Найти соответствие а) P2O5б) H3PO3в) K3PO4г) H3PO4д) PH3е) KH2PO41.Фосфин2.Фосфат калия3.Дигидрофосфат калия4.Фосфорный ангидрид5.Фосфористая кислота6.Фосфорная кислота
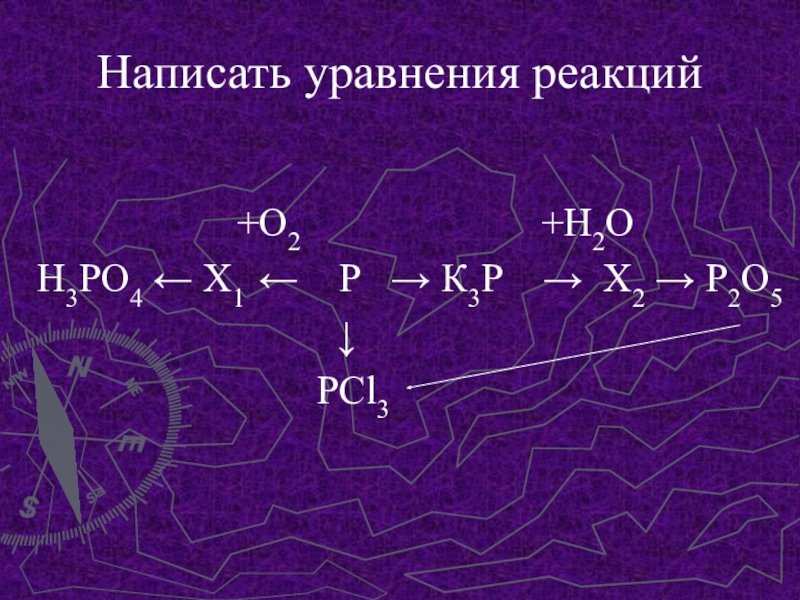
- 12. Написать уравнения реакций
- 13. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Электронная формула, степени окисления
1S22S22p63S23p3
-3 , 0 , +3 , +5
Открытие
фосфора: Х.Бранд (1669г.)
Слайд 3Картина Джозефа Райта «Алхимик, открывающий фосфор» предположительно описывающая открытие фосфора
Хеннигом Брандом, 1771 год.
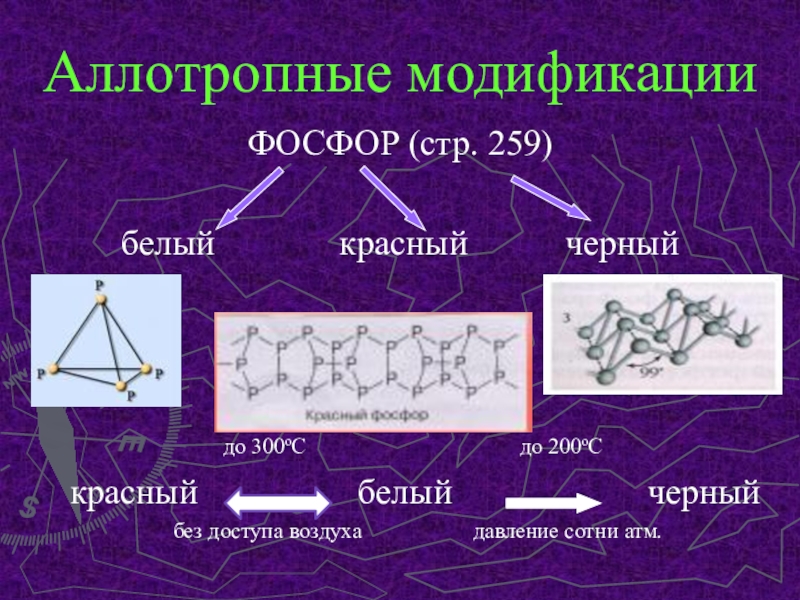
Слайд 4Аллотропные модификации
ФОСФОР (стр. 259)
белый
красный черный
до 300оС до 200оСкрасный белый черный
без доступа воздуха давление сотни атм.
Слайд 6Аллотропные модификации
Белый фосфор (Р4) – молекулярная кристал-лическая решетка, летуч, пластичен,
ядовит, светится в темноте свечение белого фосфора в темноте (360p)
(via Skyload).mp4Красный фосфор (Р) - атомная кристалли-ческая решетка, порошок, не летуч, не ядовит
Черный фосфор - атомная кристаллическая решетка, блестящее кристаллическое вещество типа графита, не летуч, не ядовит
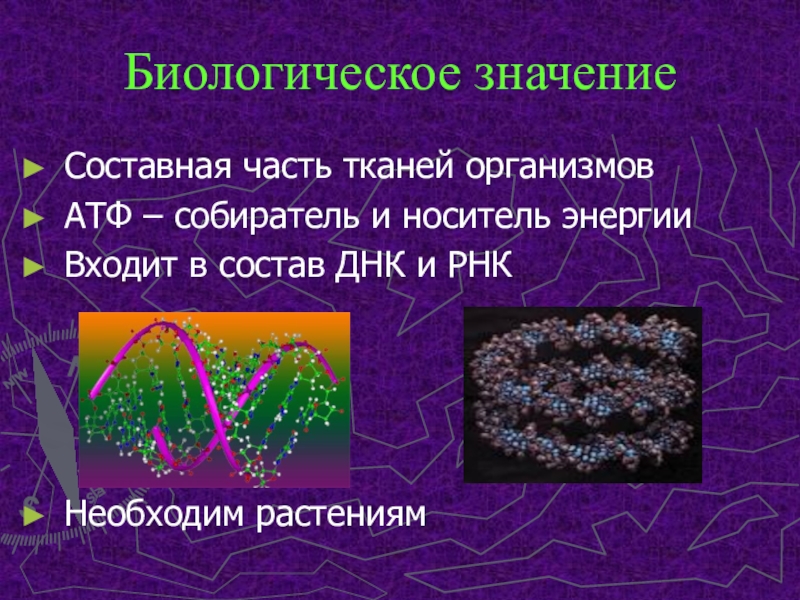
Слайд 7Биологическое значение
Составная часть тканей организмов
АТФ – собиратель и носитель энергии
Входит
в состав ДНК и РНК
Необходим растениям
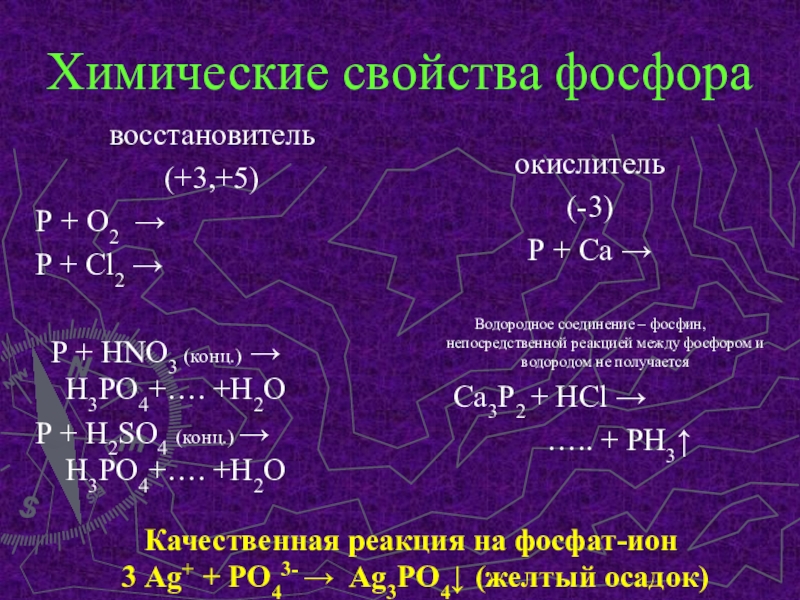
Слайд 8Химические свойства фосфора
восстановитель
(+3,+5)
Р + О2 →
P + Cl2 →
P + HNO3 (конц.) → H3PO4+…. +H2O
P +
H2SO4 (конц.) → H3PO4+…. +H2Oокислитель
(-3)
Р + Са →
Водородное соединение – фосфин, непосредственной реакцией между фосфором и водородом не получается
Са3Р2 + НСl →
….. + PH3↑
Качественная реакция на фосфат-ион
3 Аg+ + PO43- → Ag3PO4↓ (желтый осадок)