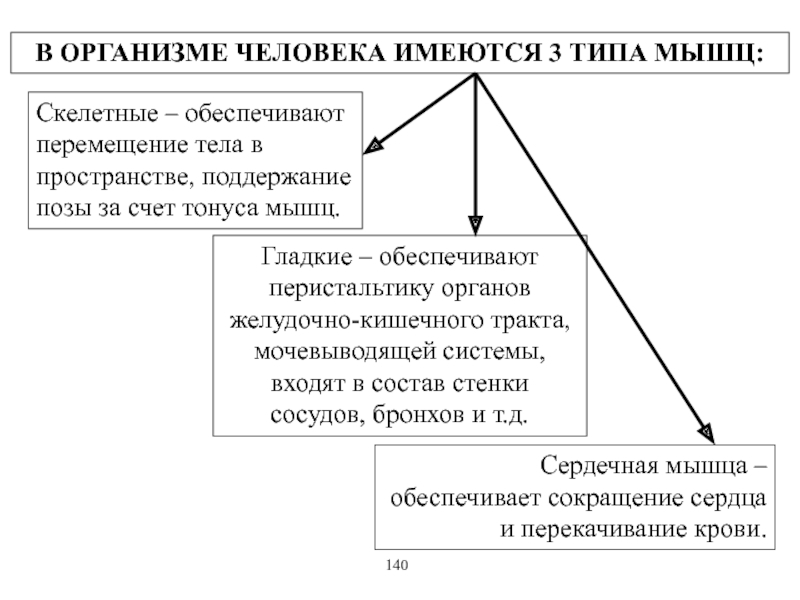
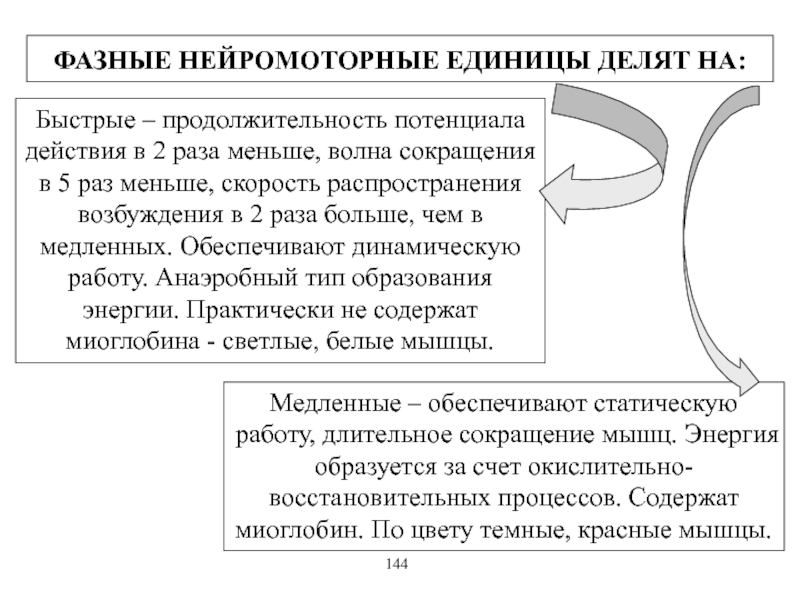
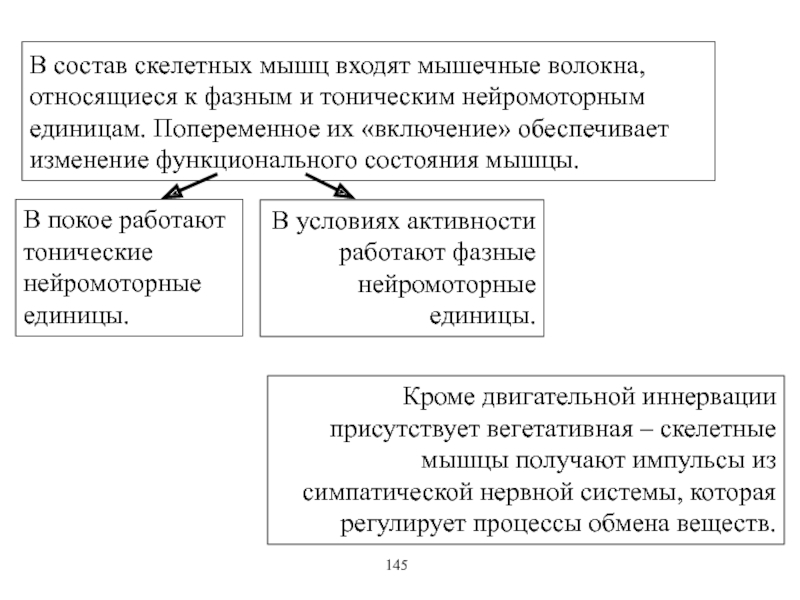
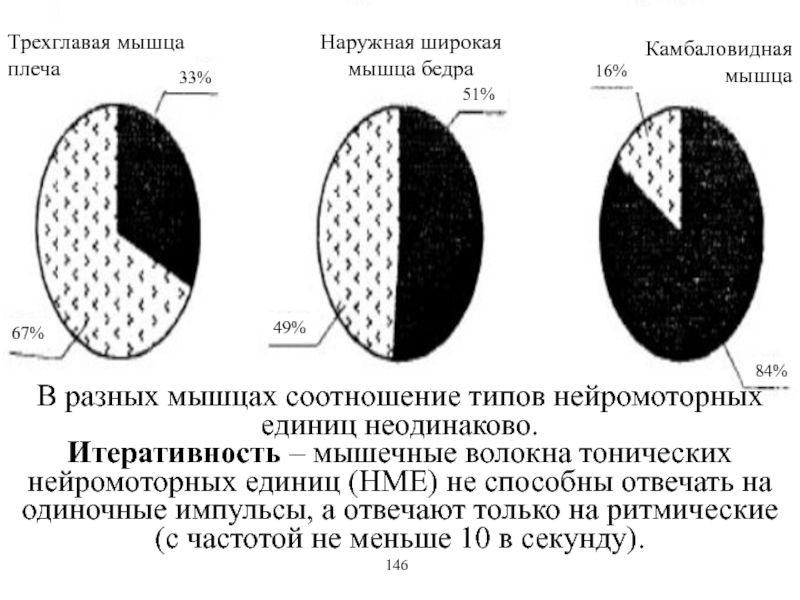
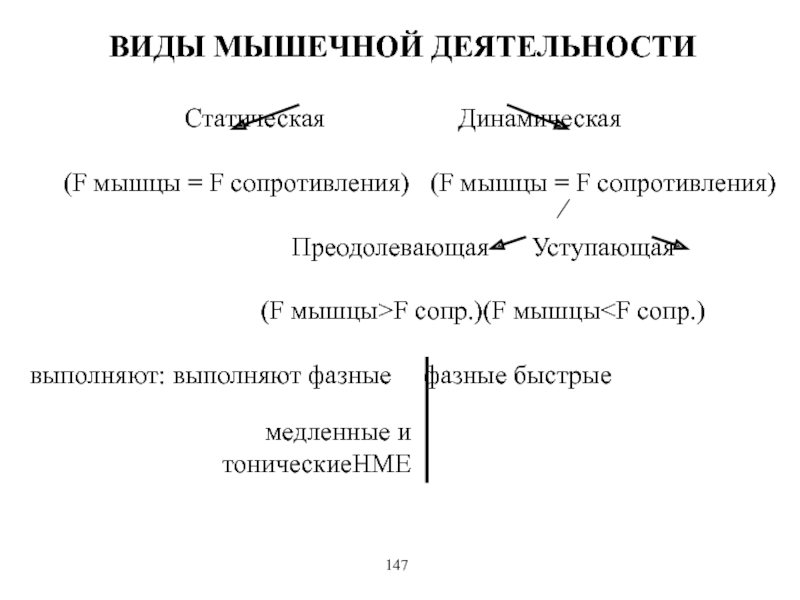
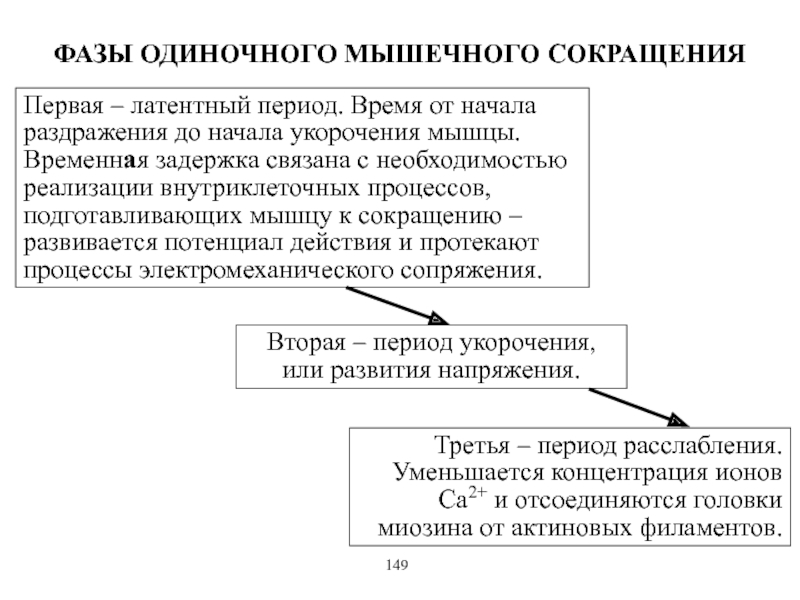
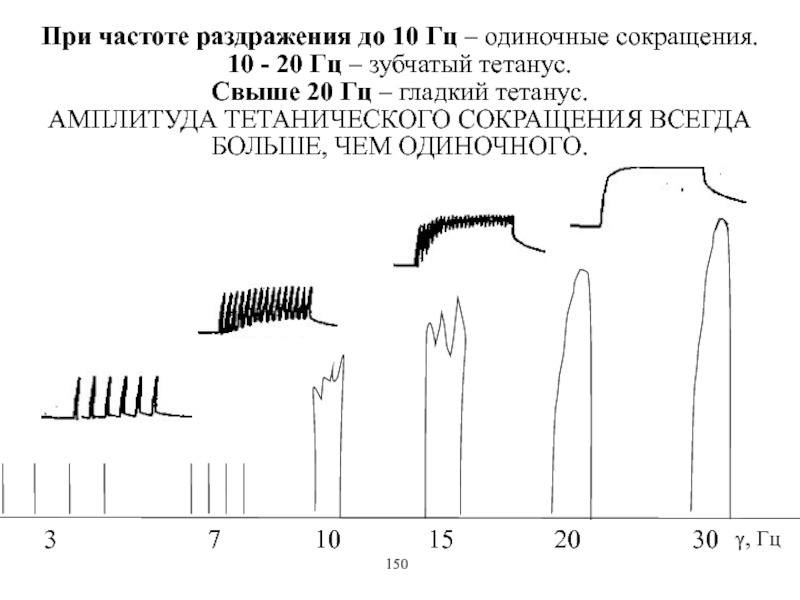
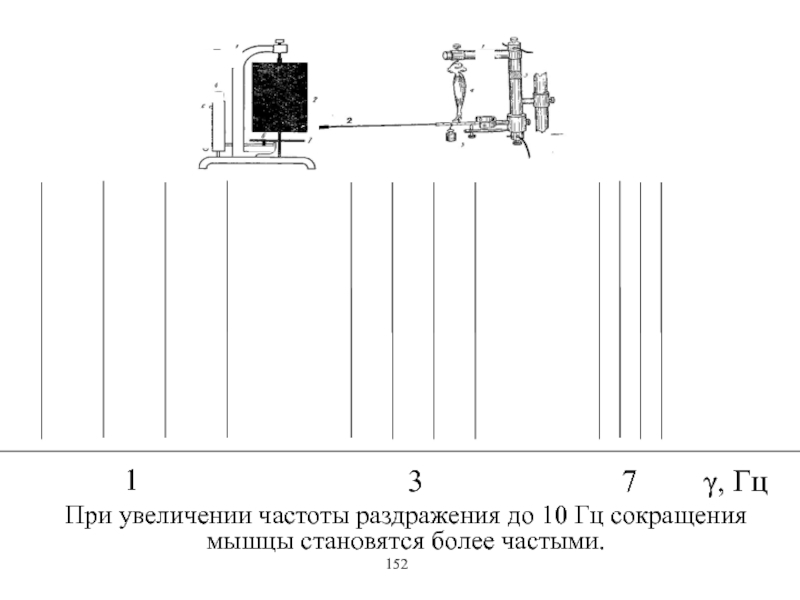
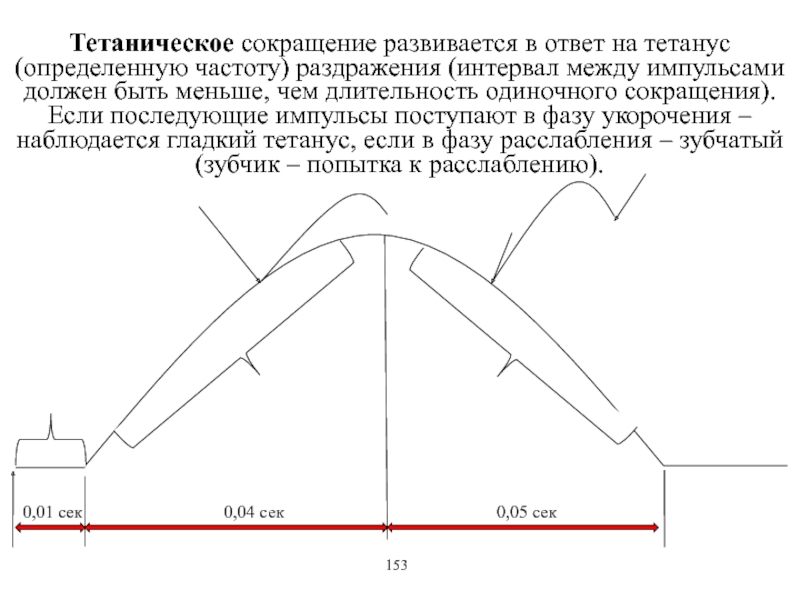
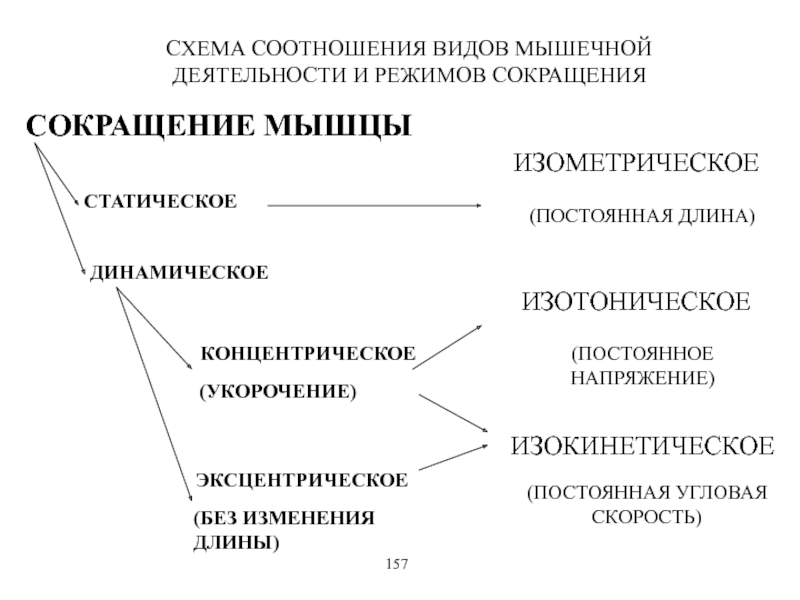
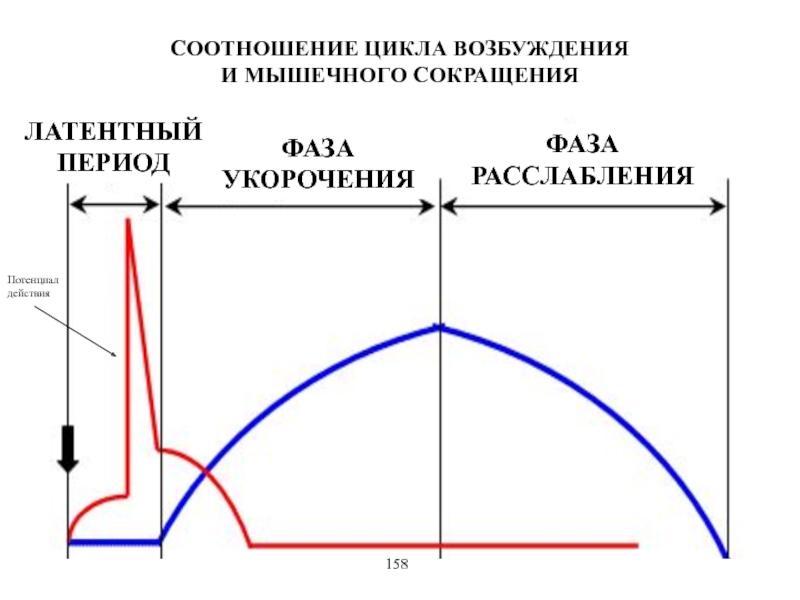
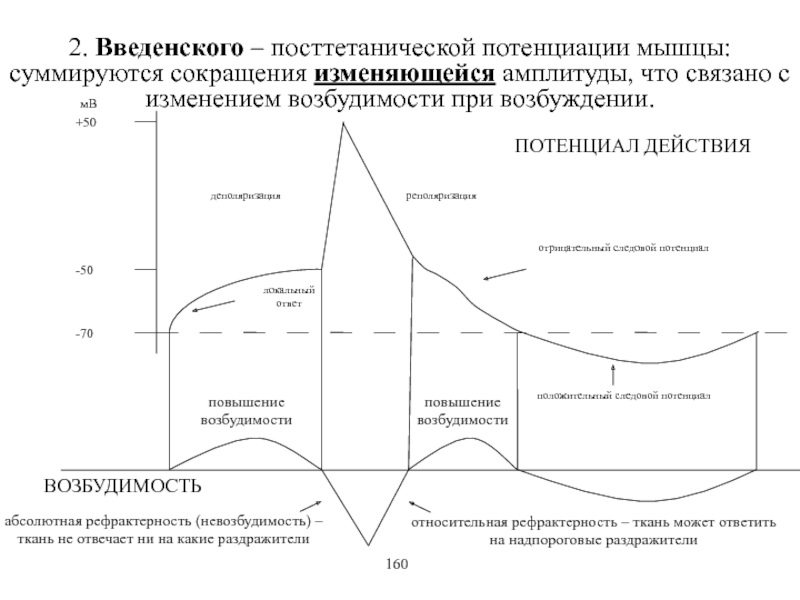
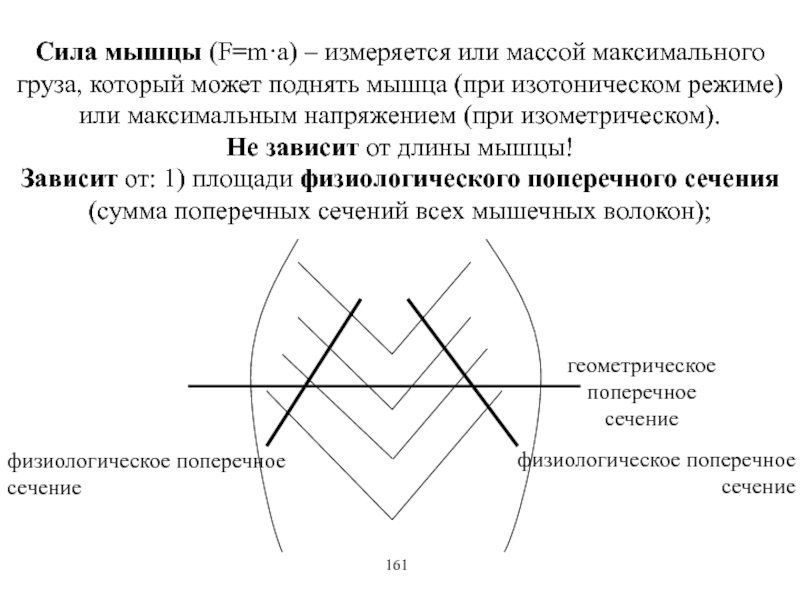
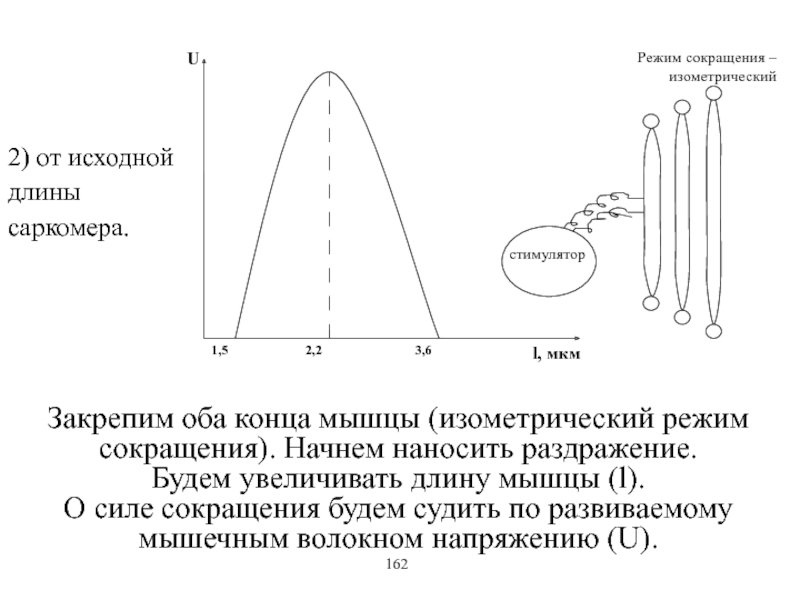
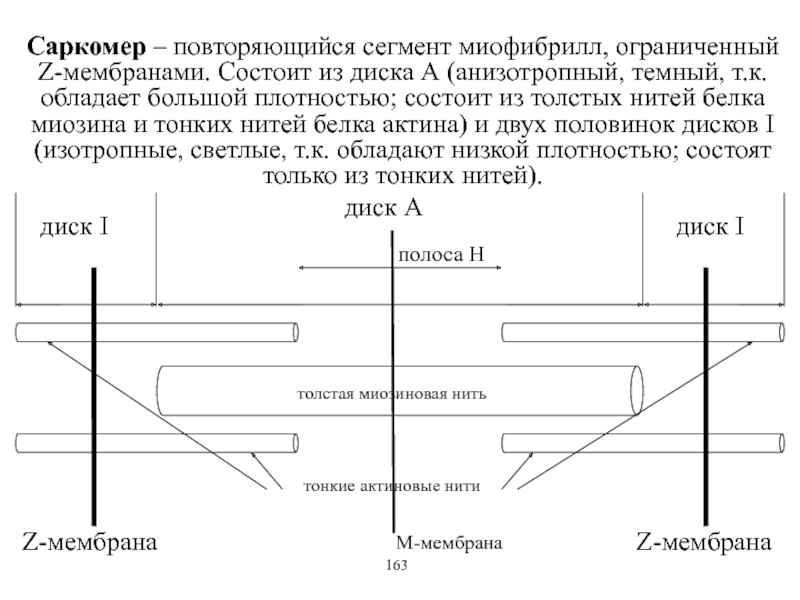
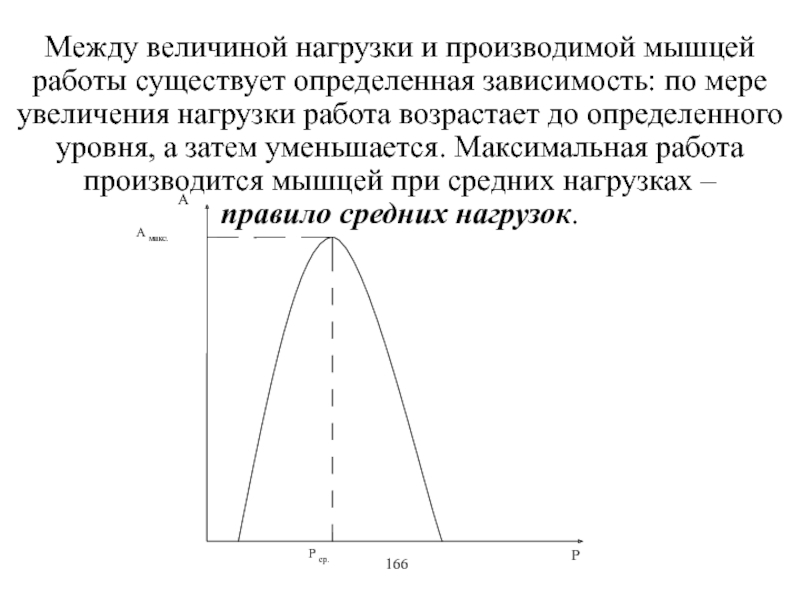
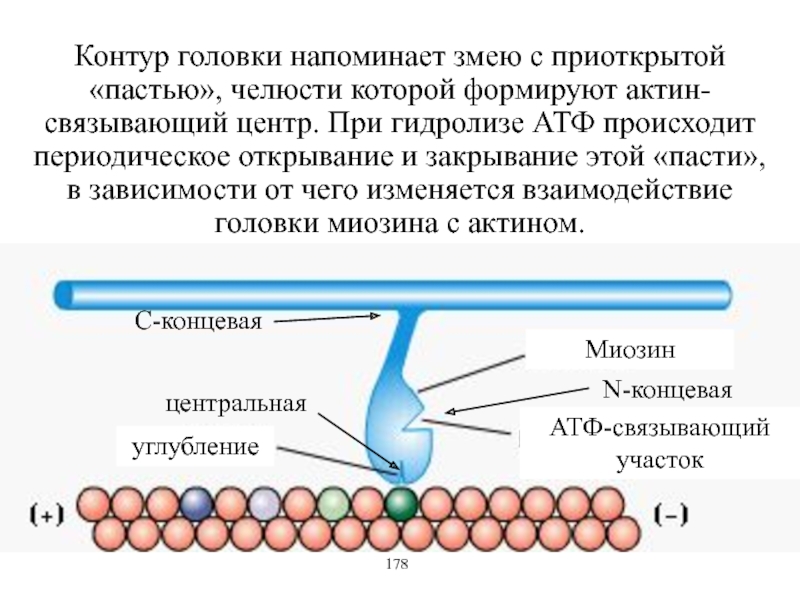
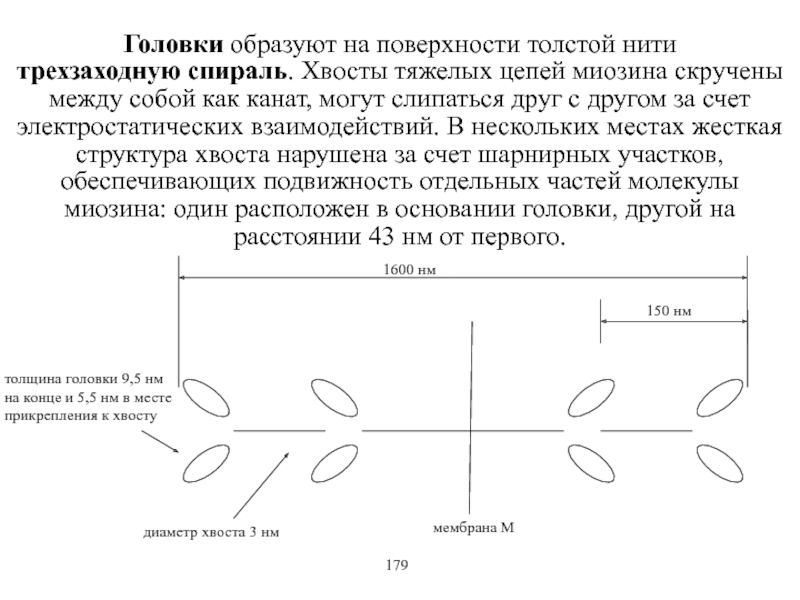
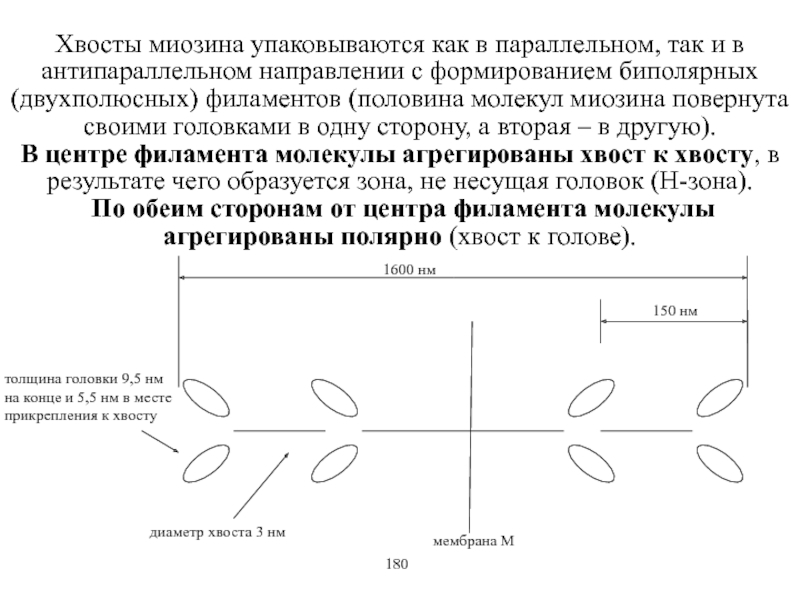
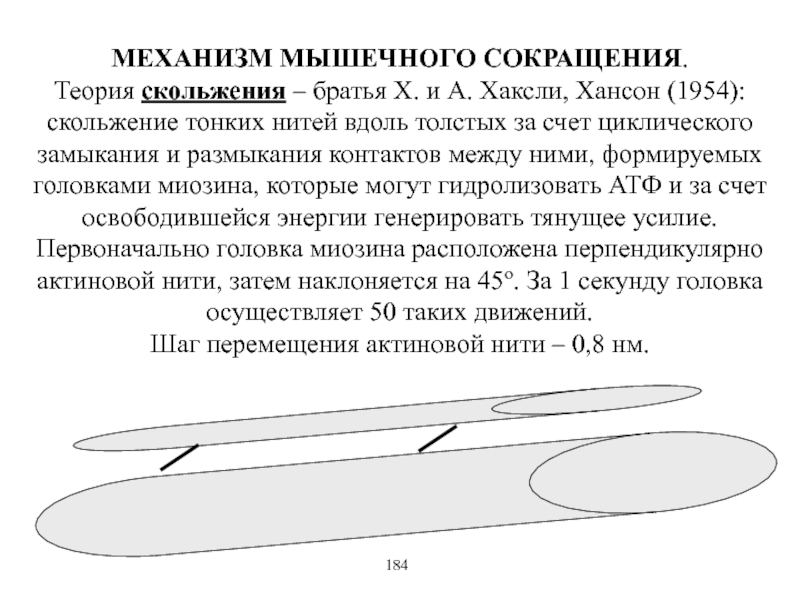
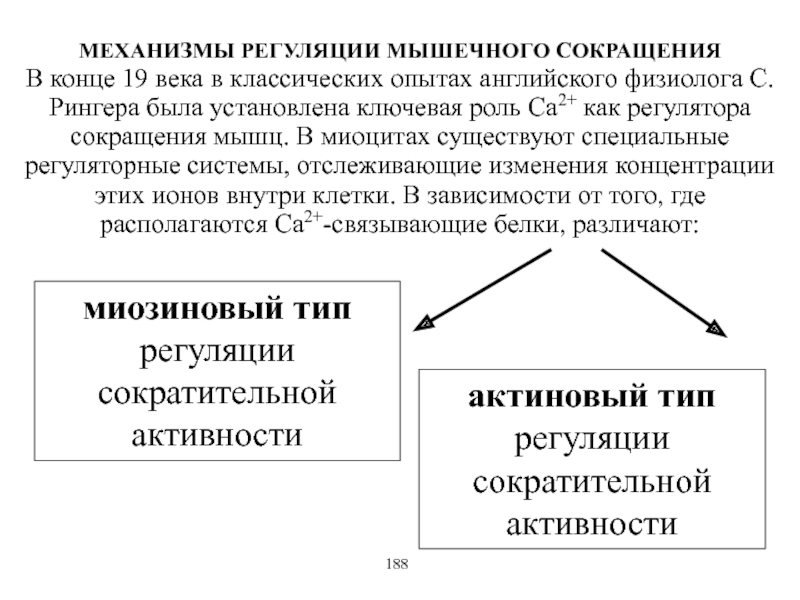
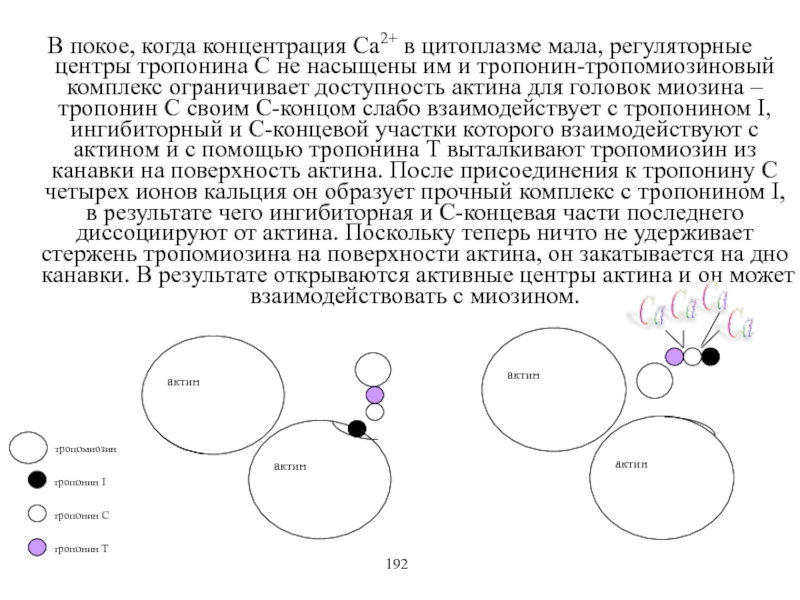
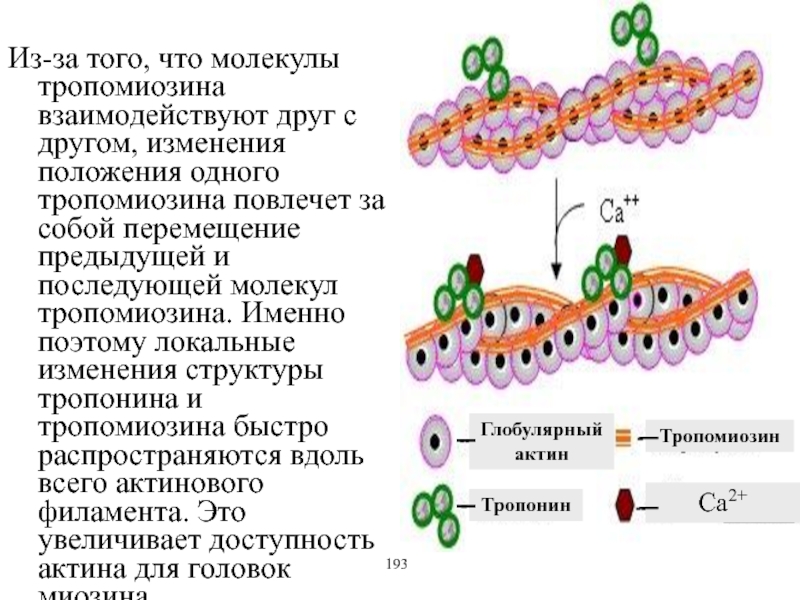
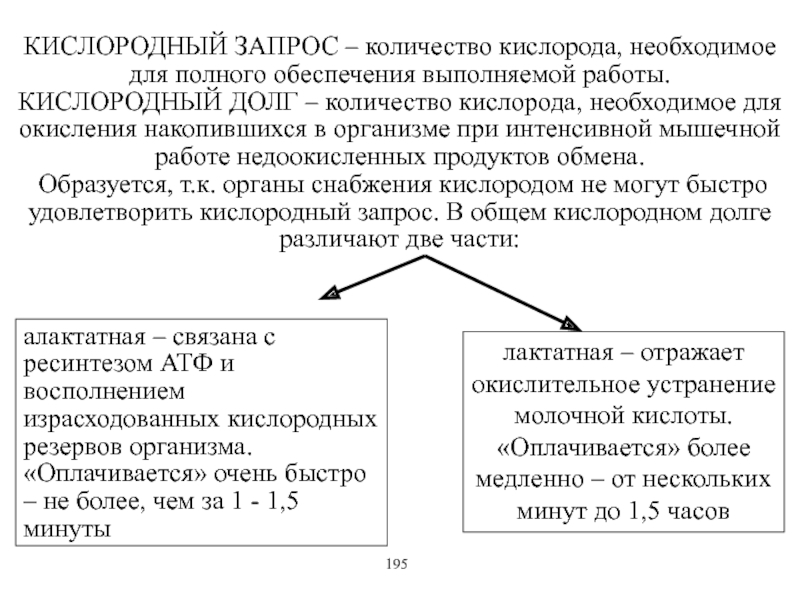
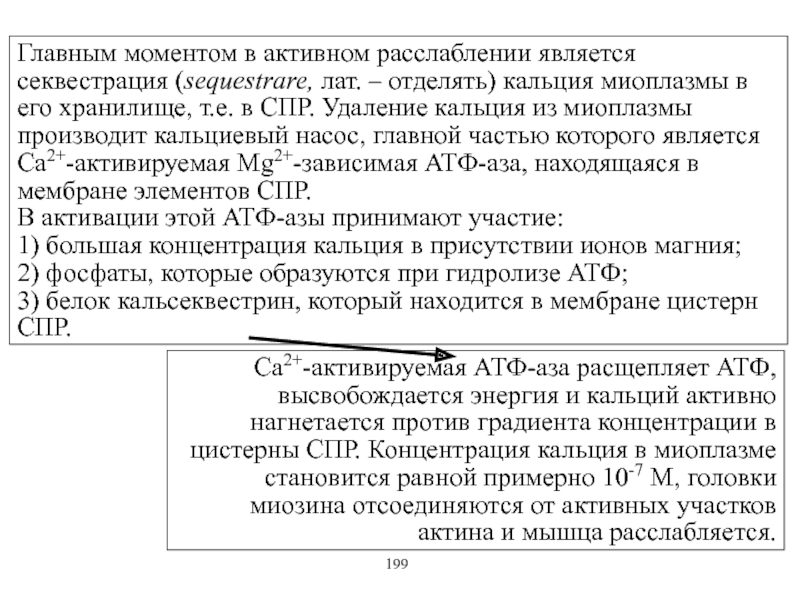
Виды и режимы сокращения скелетных мышц. Соотношение цикла возбуждения и
мышечного сокращения. Суммация одиночных мышечных сокращений. Зависимость амплитуды сокращения от частоты раздражения. Тетанус и его виды. Оптимум и пессимум. Сила и работа мышц. Закон средних нагрузок. Механизм сопряжения возбуждения и сокращения. Современные теории мышечного сокращения и расслабления. Биоэнергетика мышечного сокращения.139