Слайд 2Все типы РНК образуются в результате реакции матричного синтеза, в
большинстве случаев матрицей служит одна из цепей ДНК. Синтез РНК
на матрице ДНК – этот процесс называется транскрипцией, в котором участвуют фермент РНК-полимеразы (транскриптазы).
1.Информационная/матричная РНК – содержит от нескольких 100-1000 нуклеотидов. Представляет незамкнутую цепочку, переносит информацию о структуре белка с ДНК на рибосому.
2.Гетерогенная ядерная РНК (гя-РНК) – является предшественником и-РНК превращается в и –РНК в результате процессинга. Обычно гя-РНК длинее чем и-РНК.
3.Рибосомальная РНК – входит в состав рибосом и выполняет структурную функцию, принимает участие в синтезе полипептидной цепочки, составляет 85% всей РНК. Клетки прокариот содержат 3 вида р-РНК, а эукариот - 4 вида.
4.Транспортная РНК – переносит аминокислоты к месту синтеза белков на рибосомы, каждая молекула т-РНК содержит 80 нуклеотидов. Ее специфичность определяется структурой антикодона – это участок соединения с конкретным триплетом и-РНК.
5. Малые РНК. Кодируются в ядре, но работают как в ядре (small nuclear - SN), так и в цитоплазме (small cytoplasmic - SC). в ядре snРНК входят в состав РНП (рибонуклеопротеидные комплексы), участвующих в полиаденилировании и сплайсинге.
6. Малая интерферирующая РНК (siRNA) обладает способностью "выключать" гены.

Слайд 3Первичные транскрипты, образующиеся в процессе синтеза РНК, часто подвергаются посттранскрипционным
модификациям, или процессингу. В результате процессинга происходит созревание РНК.
Только зрелые РНК способны выполнять возложенные на них задачи.
иРНК (или матричные РНК) – это одноцепочечные молекулы. Молекула
иРНК может кодировать одну или несколько полипептидных цепей.
иРНК, кодирующая информацию об одной полипептидной цепи,
называется моноцистронной, о двух или более – полицистронной.
Информационная РНК прокариот короткоживущая. Средняя
продолжительность жизни – 2 минуты.
иРНК прокариот в большинстве случаев являются полицистронными,
и только некоторые из них – моноцистронными. Полицистронные иРНК
содержат нетранслируемые межцистронные области, которые
разделяют участки, кодирующие полипептидные цепи (цистроны). Со
стороны 5’- конца иРНК располагается лидерная некодирующая
последовательность, содержащая в своем составе консенсусную
последовательность Шайна-Дальгарно.
Слайд 4Это последовательность из шести нуклеотидов AGGAGG . Комплементарная последовательность UCCUCC,
называемая анти последовательностью Шайна-Дальгарно располагается на 3/ конце молекулы 16S
рРНК и определяет правильную ориентацию иРНК на рибосоме в процессе трансляции. Со стороны 3’-конца располагается некодирующая концевая последовательность (трейлер). Кодирующие последовательности начинаются с инициирующего кодона (обычно АУГ, но может быть и ГУГ) и заканчиваются одним из терминирующих кодонов (УАА, УАГ или УГА).
Межцистронные области имеют размер от 1 до 40 и более нуклеотидов.
Иногда межцистронные области могут отсутствовать. Более того,
последний нуклеотид одного цистрона может являться первым
нуклеотидом следующего цистрона, например: АГАУГ.
иРНК эукариот являются моноцистронными и составляют 2 – 6 % от
всей РНК в клетке. У эукариотов гены почти всегда одиночные и только
гены т- и р-РНК собраны в кластеры, напоминающие опероны бактерий.
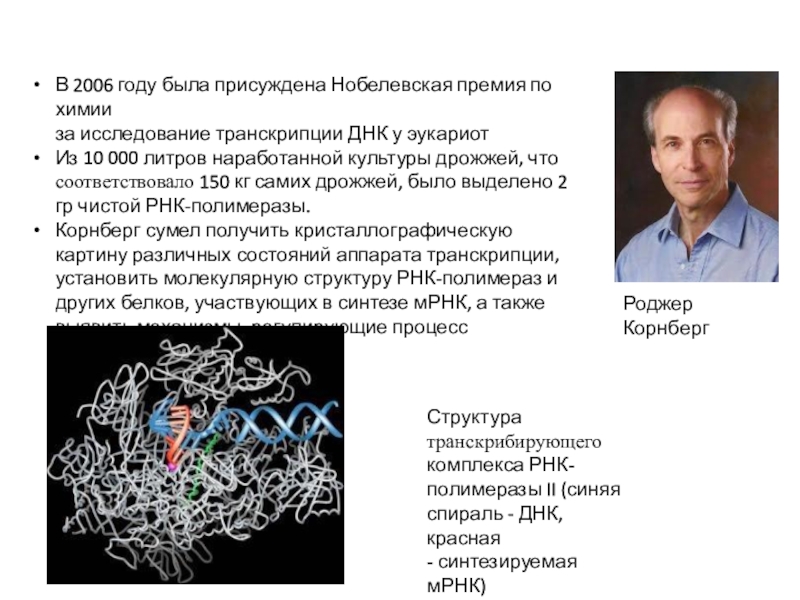
Слайд 5Роджер Корнберг
В 2006 году была присуждена Нобелевская премия по химии
за
исследование транскрипции ДНК у эукариот
Из 10 000 литров наработанной культуры
дрожжей, что соответствовало 150 кг самих дрожжей, было выделено 2 гр чистой РНК-полимеразы.
Корнберг сумел получить кристаллографическую картину различных состояний аппарата транскрипции, установить молекулярную структуру РНК-полимераз и других белков, участвующих в синтезе мРНК, а также выявить механизмы, регулирующие процесс транскрипции
Структура транскрибирующего комплекса РНК- полимеразы II (синяя спираль - ДНК, красная
- синтезируемая мРНК)
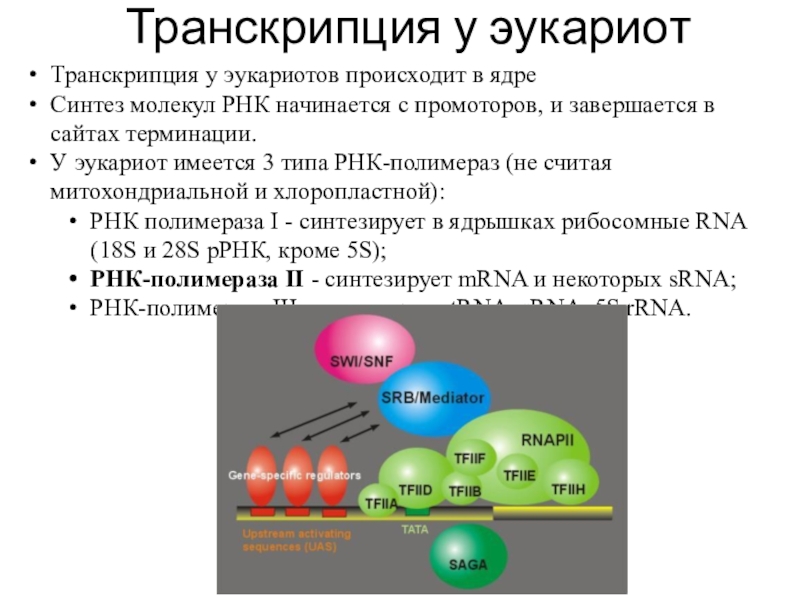
Слайд 6Транскрипция у эукариот
Транскрипция у эукариотов происходит в ядре
Синтез молекул РНК
начинается с промоторов, и завершается в сайтах терминации.
У эукариот имеется
3 типа РНК-полимераз (не считая митохондриальной и хлоропластной):
РНК полимераза I - синтезирует в ядрышках рибосомные RNA (18S и 28S рРНК, кроме 5S);
РНК-полимераза II - синтезирует mRNA и некоторых sRNA;
РНК-полимераза III - синтезирует tRNA, sRNA, 5S rRNA.
Слайд 7Транскрипция у эукариот
ТАТА-бокс содержащие
Около 24% генов человека
ТАТА-бокс не содержащие
Участвуют различные
транскрипционные факторы
На расстоянии 27-30 п.н. от
кэп-сайта расположен TATA-мотив, усредненный вариант которого можно представить как TATA(A/T)A(A/T).
Положение TATA-элемента строго определяет сайт инициации транскрипции, т.е. 5'-конец транскрипта.
При повреждении или удалении TATA-элемента образуется набор молекул РНК с разными 5'-концами.
Отдельные нуклеотидные замены в TATA-элементе могут приводить к резкому снижению эффективности транскрипции.
Промоторы
Слайд 8Транскрипция у эукариот
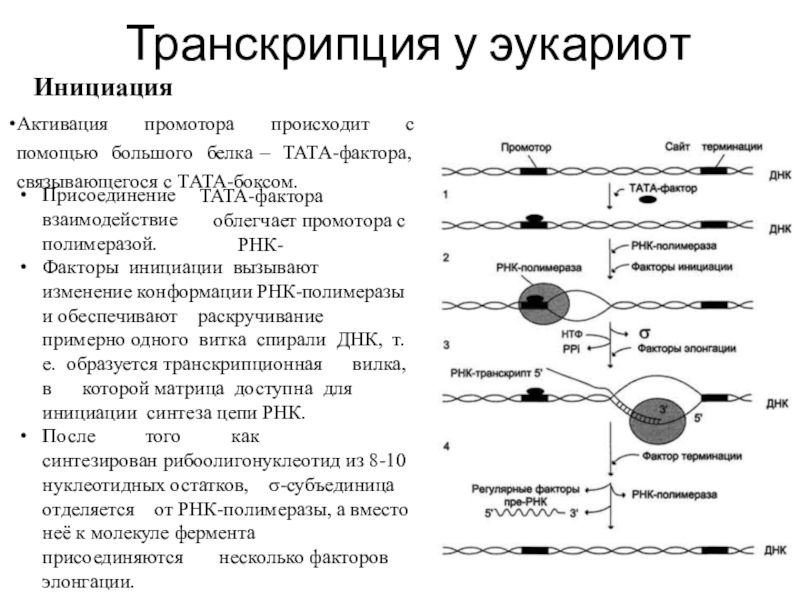
Инициация
Активация промотора происходит
с помощью большого белка – ТАТА-фактора, связывающегося с ТАТА-боксом.
Присоединение
взаимодействие полимеразой.
ТАТА-фактора облегчает промотора с РНК-
Факторы инициации вызывают изменение конформации РНК-полимеразы и обеспечивают раскручивание примерно одного витка спирали ДНК, т.е. образуется транскрипционная вилка, в которой матрица доступна для инициации синтеза цепи РНК.
После того как синтезирован рибоолигонуклеотид из 8-10 нуклеотидных остатков, σ-субъединица отделяется от РНК-полимеразы, а вместо неё к молекуле фермента присоединяются несколько факторов элонгации.
Слайд 9Транскрипция у эукариот
Элонгация
Факторы элонгации повышают активность РНК-полимеразы и облегчают расхождение
цепей ДНК.
На стадии элонгации, в области транскрипционной вилки, одновременно разделены
примерно 18 нуклеотидных пар ДНК.
Растущий конец цепи РНК образует временную гибридную спираль, около 12
пар нуклеотидных остатков, с матричной цепью ДНК.
По мере продвижения РНК-полимеразы по матрице в направлении от 3'- к 5'- концу впереди неё происходит расхождение, а позади - восстановление двойной спирали ДНК.
Слайд 10Транскрипция у эукариот
Терминация
Завершается синтез РНК в строго определенных участках матрицы
- сайты терминации транскрипции
Раскручивание двойной спирали ДНК в области сайта
терминации делает его доступным для фактора терминации.
Фактор терминации облегчает отделение первичного транскрипта (пре-мРНК), комплементарного матрице, и РНК-полимеразы от матрицы. РНК-полимераза может вступить в следующий цикл транскрипции после присоединения субъединицы σ.
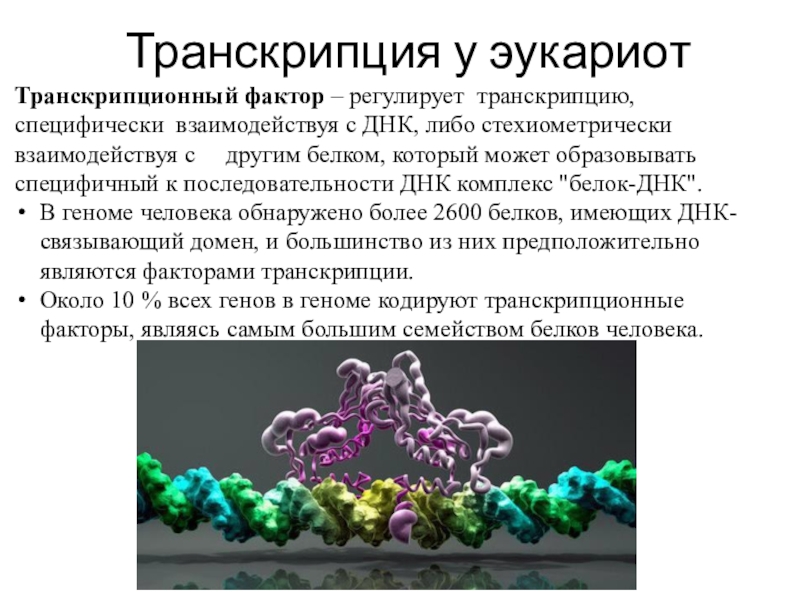
Слайд 11Транскрипционный фактор – регулирует транскрипцию, специфически взаимодействуя с ДНК, либо
стехиометрически взаимодействуя с другим белком, который может образовывать
специфичный к последовательности ДНК комплекс "белок-ДНК".
В геноме человека обнаружено более 2600 белков, имеющих ДНК-связывающий домен, и большинство из них предположительно являются факторами транскрипции.
Около 10 % всех генов в геноме кодируют транскрипционные факторы, являясь самым большим семейством белков человека.
Транскрипция у эукариот
Слайд 12Транскрипция у эукариот
ТФ , связывающиеся с ДНК, могут влиять на
транскрипцию генов через несколько механизмов:
В большинстве изученных к настоящему времени
случаев ТФ стимулируют формирование комплекса преинициации на TATA- боксе - инициаторном элементе за счет взаимодействия их транс- активирующих доменов с компонентами базального транскрипционного комплекса (либо непосредственно, либо через коактиваторы/ медиаторы ).
Некоторые ТФ вызывают изменения структуры хроматина , делая его более доступным для РНК-полимераз .
Другие ТФ являются вспомогательными, создавая оптимальную конформацию ДНК для действия других транскрипционных факторов.
Слайд 13Транскрипция у эукариот
4. Известны ТФ, которые подавляют транскрипцию за счет
непосредственного действия своих ингибирующих доменов , либо нарушая совместное функционирование
комплекса транскрипционных факторов внутри регуляторной области гена (промотора, энхансера).
Наконец, имеются ТФ, которые сами не связываются с ДНК, а объединяются в более сложные комплексы посредством белок- белковых взаимодействий.
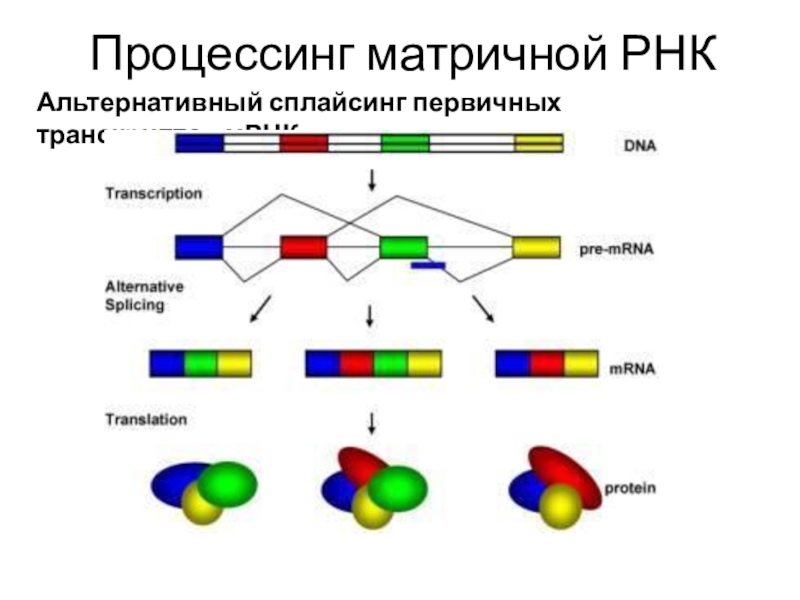
Слайд 14Процессинг матричной РНК
Первичные транскрипты мРНК, прежде чем будут использованы в
ходе синтеза белка,
подвергаются ряду ковалентных модификаций. Эти модификации необходимы для функционирования мРНК в качестве матрицы.
Модификация 5'-конца
Модификация 3'-конца
Сплайсинг первичных транскриптов мРНК
Альтернативный сплайсинг
Слайд 15Процессинг матричной РНК
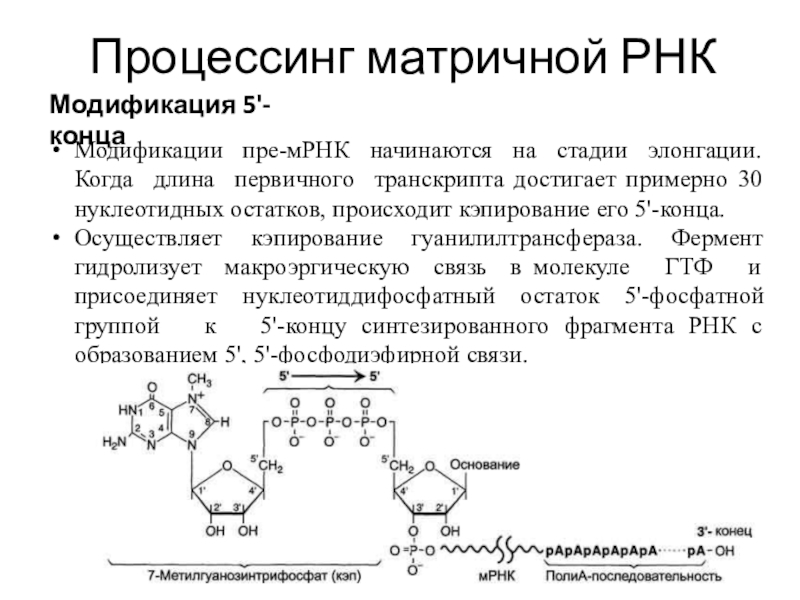
Модификация 5'-конца
Модификации пре-мРНК начинаются на стадии элонгации. Когда
длина первичного транскрипта достигает примерно 30 нуклеотидных остатков, происходит кэпирование
его 5'-конца.
Осуществляет кэпирование гуанилилтрансфераза. Фермент гидролизует макроэргическую связь в молекуле ГТФ и присоединяет нуклеотиддифосфатный остаток 5'-фосфатной группой к 5'-концу синтезированного фрагмента РНК с образованием 5', 5'-фосфодиэфирной связи.
Слайд 16Процессинг матричной РНК
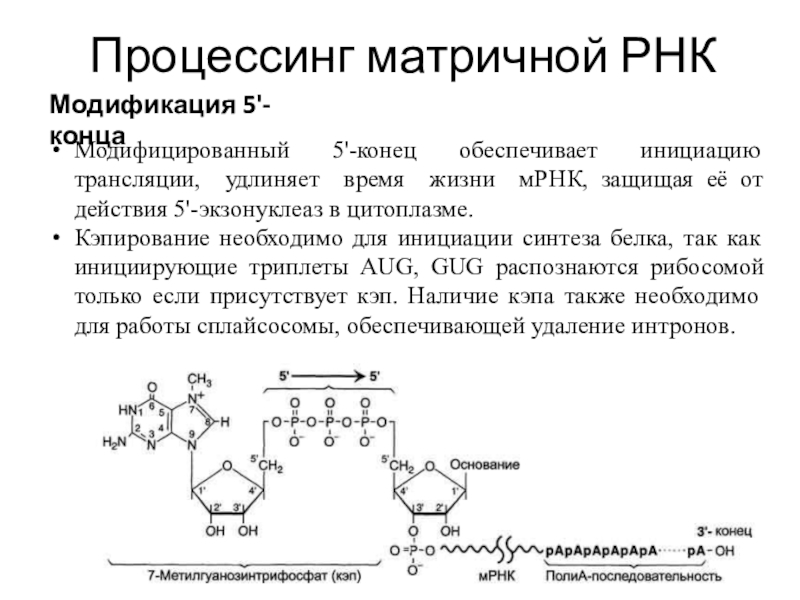
Модификация 5'-конца
Модифицированный 5'-конец обеспечивает инициацию трансляции, удлиняет время
жизни мРНК, защищая её от действия 5'-экзонуклеаз в цитоплазме.
Кэпирование необходимо
для инициации синтеза белка, так как инициирующие триплеты AUG, GUG распознаются рибосомой только если присутствует кэп. Наличие кэпа также необходимо для работы сплайсосомы, обеспечивающей удаление интронов.
Слайд 17Кодирующая, или транслируемая, область и (м)РНК начинается с инициирующего кодона
(АУГ) и заканчивается одним из трех терминирующих кодонов. Консенсусная последовательность
Козак (описана Мерилин Козак в 1986 г.), играющая важную роль в инициации трансляции у эукариот, включает четыре-шесть нуклеотидов, предшествующих старткодону (САСС чаще всего), и один-два (GC) нуклеотида непосредственно после старткодона. (Автор рисунка: TransControl из английской Википедии, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=2296784)
Слайд 18У эукариот имеются два механизма нахождения рибосомой старт-кодона AUG: кэп
– зависимый (сканирующий) и кэп – независимый (механизм внутренней инициации)
за счет элементов IRES (англ. Internal Ribosomal Entry Site) — участок мРНК, обладающий выраженной вторичной структурой, позволяющей ему направлять рибосомы на стартовый AUG.
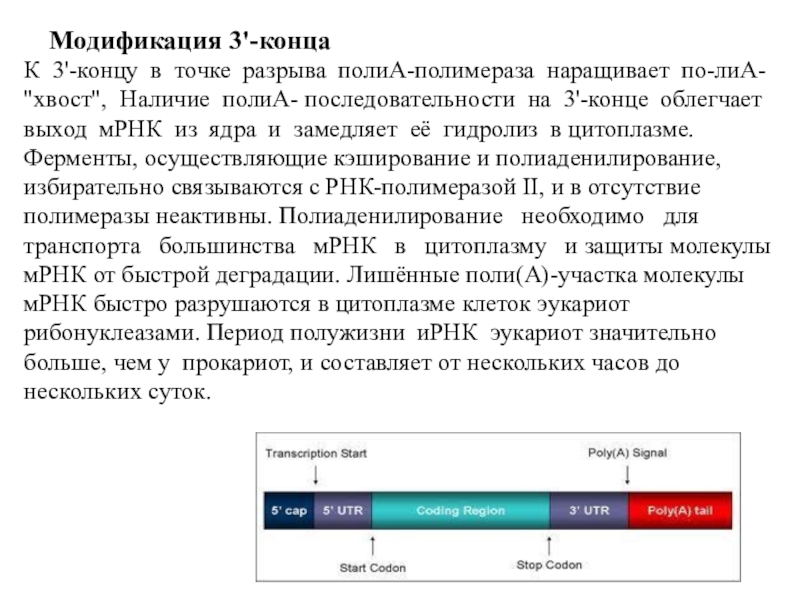
Слайд 19Модификация 3'-конца
3'-Конец большинства транскриптов, синтезированных РНК-полимеразой
II, подвергается модификации
Специальным ферментом полиА-полимеразой
формируется полиА-последовательность (полиА-"хвост"), состоящая из 100-200 остатков аденозина.
Сигналом к началу полиаденилирования является последовательность -AAUAAA- на растущей цепи РНК. Фермент полиА-полимераза, проявляя экзонуклеазную активность, разрывает 3'- фосфоэфирную связь после появления в цепи РНК специфической последовательности - AAUAAA-.
Слайд 20Модификация 3'-конца
К 3'-концу в точке разрыва полиА-полимераза наращивает по-лиА-
"хвост", Наличие
полиА- последовательности на 3'-конце облегчает
выход мРНК из ядра и замедляет
её гидролиз в цитоплазме.
Ферменты, осуществляющие кэширование и полиаденилирование,
избирательно связываются с РНК-полимеразой II, и в отсутствие
полимеразы неактивны. Полиаденилирование необходимо для
транспорта большинства мРНК в цитоплазму и защиты молекулы
мРНК от быстрой деградации. Лишённые поли(А)-участка молекулы
мРНК быстро разрушаются в цитоплазме клеток эукариот
рибонуклеазами. Период полужизни иРНК эукариот значительно
больше, чем у прокариот, и составляет от нескольких часов до
нескольких суток.
Слайд 21Процессинг матричной РНК
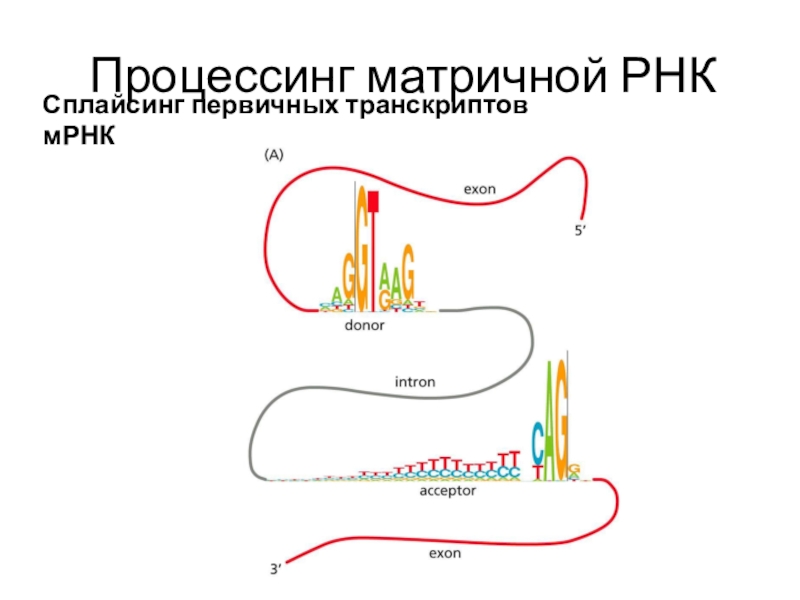
Сплайсинг первичных транскриптов мРНК
Последовательности интронов "вырезаются" из первичного
транскрипта, концы экзонов соединяются друг с другом.
Гены эукариотов содержат больше
интронов, чем экзонов, поэтому очень длинные молекулы пре-мРНК (около 5000 нуклеотидов) после сплайсинга превращаются в более короткие молекулы цитоплазматической мРНК
Слайд 22Процессинг матричной РНК
Сплайсинг первичных транскриптов мРНК
Слайд 23Процессинг матричной РНК
Сплайсинг первичных транскриптов мРНК
Процесс "вырезания" интронов протекает при участии малых ядерных
рибонуклеопротеинов (мяРНП)
На первой стадии процесса мяРНП
связываются с сайтами сплайсинга
Далее к ним присоединяются мяРНП.
другие
При формировании структуры сплайсосомы 3'-конец
одного экзона сближается с 5'- концом следующего экзона.
Сплайсосома катализирует реакцию расщепления 3',5'-фосфодиэфирной связи на границе экзона с интроном.
Последовательность интрона удаляется, а два экзона соединяются.
Образование 3',5'-фосфодиэфирной связи между двумя экзонами катализируют мяРНК (малые ядерные РНК), входящие в структуру сплайсосомы.
Слайд 24Процессинг матричной РНК
Альтернативный сплайсинг первичных транскриптов мРНК
Слайд 25 У высших организмов первичный РНК-транскрипт может подвергаться альтернативному
сплайсингу. При этом в определенных случаях могут удаляться и некоторые
из экзонов вместе с интронами, а некоторые интроны или их части оставаться в зрелой mРНК и служить матрицей для синтеза полипептидной цепи. Именно альтернативным сплайсингом объясняется тот факт, что у человека синтезируется не менее 105 разных типов белков, кодируемых всего ~ 20 * 103 генами. Из всех генов человека, содержащих интроны, более 75 % служат матрицами для синтеза прe-mРНК, подвергаемых альтернативному сплайсингу.
Слайд 26 В результате альтернативного сплайсинга по каждому гену высших
эукариот может образовываться в среднем три разных mРНК, а по
некоторым генам даже несколько тысяч. Так, по гену Slo, экспрессирующемуся в волосковых клетках внутреннего уха человека, теоретически возможно образование более 30 000 разных mРНК. Ген содержит 35 экзонов, 8 из которых альтернативны. Разные формы белка Slo определяют различия в частоте звуков, воспринимаемых клетками. Известно несколько разных механизмов сплайсинга. Наиболее сложным из них является сплайсинг mРНК ядерных генов высших эукариот. Он осуществляется сплайсосомой – рибонуклеопротеидным комплексом, включающим 5 малых ядерных РНК (U1, U2, U4, U5) и более 100 белков.
Слайд 27 Некоторые белки напрямую участвуют в сплайсинге, большая
их часть играет структурную роль и необходима для сборки малых
ядерных рибонуклеопротеидных комплексов и их взаимодействий между собой и с пре-mРНК. Описано несколько десятков белковых комплексов, называемых SRбелками (сплайсинг- регулирующими), которые различны в разных тканях, а также в одной ткани на разных этапах развития организма. Эти богатые серином и аргинином белки связываются с определенными нуклеотидными последовательностями внутри экзонов и сигнализируют о вырезании или сохранении конкретного экзона в mРНК. Если они связываются с экзонным энхансером сплайсинга (ESE),то на 5′-конце соседнего интрона начинается формирование сплайсосомы. Если же другие SR-белки связываются с экзонным супрессором сплайсинга (ESE), тогда блокируется присоединение малых РНК сплайсосомы к фланкирующим интронам, что приводит к вырезанию этого экзона вместе с интронами. (Г.М. Дымшиц, О.В. Саблина «Разорванные» гены и сплайсинг. // Вавиловский журнал генетики и селекции, 2014, Том 18, № 1 C. 71-80.)
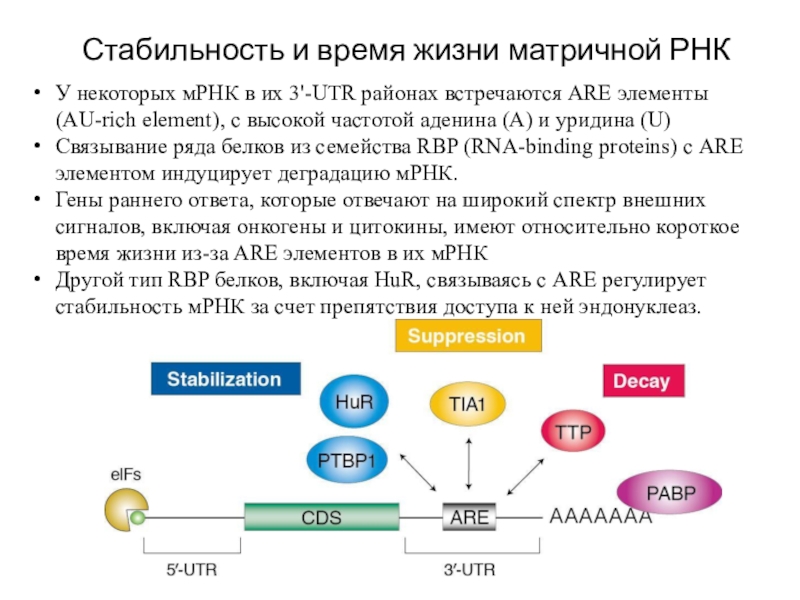
Слайд 28Стабильность и время жизни матричной РНК
У некоторых мРНК в их
3'-UTR районах встречаются ARE элементы (AU-rich element), с высокой частотой
аденина (A) и уридина (U)
Связывание ряда белков из семейства RBP (RNA-binding proteins) с ARE элементом индуцирует деградацию мРНК.
Гены раннего ответа, которые отвечают на широкий спектр внешних сигналов, включая онкогены и цитокины, имеют относительно короткое время жизни из-за ARE элементов в их мРНК
Другой тип RBP белков, включая HuR, связываясь с ARE регулирует стабильность мРНК за счет препятствия доступа к ней эндонуклеаз.
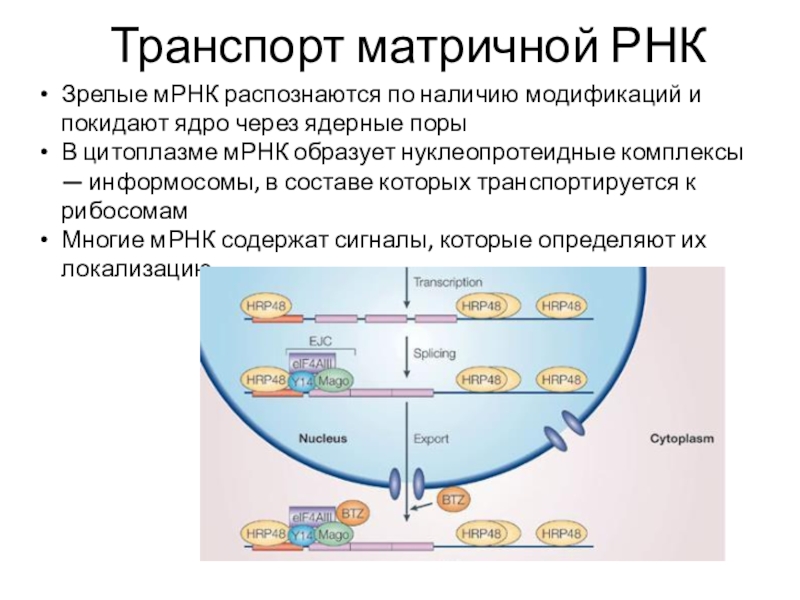
Слайд 29Транспорт матричной РНК
Зрелые мРНК распознаются по наличию модификаций и покидают
ядро через ядерные поры
В цитоплазме мРНК образует нуклеопротеидные комплексы —
информосомы, в составе которых транспортируется к рибосомам
Многие мРНК содержат сигналы, которые определяют их локализацию
Слайд 30Рибосомы. В прокариотических рибосомах присутствуют три вида рРНК и 55-60
рибосомных белков. Образование рРНК у прокариот происходит в результате процессинга
первичного транскрипта, содержащего в своем составе нуклеотидные последовательности всех трех 16S, 23S и 5S рРНК, а также тРНК. При созревании из первичного транскрипта происходит вычленение индивидуальных рРНК и тРНК.
Полная прокариотическая рибосома имеет коэффициент седиментаци
и 70S и диссоциирует на две субъединицы. Малая рибосомальная
субъединица имеет палочковидную форму с несколькими небольшими
выступами и состоит из одной молекулы РНК. Большая субъединица
похожа на полусферу с тремя торчащими выступами. При ассоциации в
полную 70S рибосому малая субчастица ложится одним концом на один
из выступов 50S частицы, а другим в ее желобок. В составе большой
молекулы находятся 2 молекулы РНК.
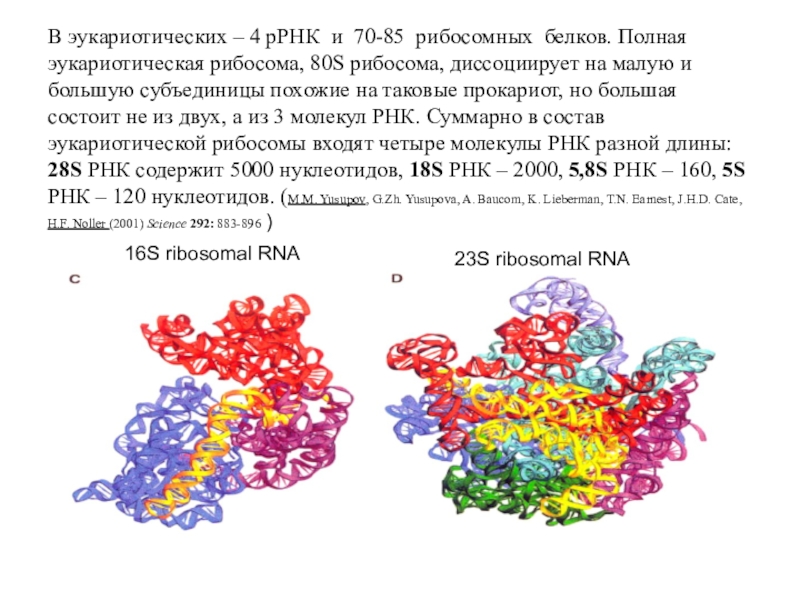
Слайд 31В эукариотических – 4 рРНК и 70-85 рибосомных белков. Полная
эукариотическая рибосома, 80S рибосома, диссоциирует на малую и большую субъединицы
похожие на таковые прокариот, но большая состоит не из двух, а из 3 молекул РНК. Суммарно в состав эукариотической рибосомы входят четыре молекулы РНК разной длины: 28S РНК содержит 5000 нуклеотидов, 18S РНК – 2000, 5,8S РНК – 160, 5S РНК – 120 нуклеотидов. (M.M. Yusupov, G.Zh. Yusupova, A. Baucom, K. Lieberman, T.N. Earnest, J.H.D. Cate, H.F. Noller (2001) Science 292: 883-896 )
16S ribosomal RNA
23S ribosomal RNA
Слайд 32Из них 18S, 5,8S и 28S рРНК синтезируются в
ядрышке РНК полимеразой I в виде единого предшественника (45S), который
затем подвергается модификациям (метилируется, преимущественно остатки рибозы) и нарезанию. 5S рРНК синтезируется РНК полимеразой III в другой части генома и не нуждаются в дополнительных модификациях. Затем при участии 5S рРНК формируют рибосомы. У некоторых примитивных эукариот в составе первичного транскрипта нуклеотидные последовательности, соответствующие 26S РНК, содержат интрон. В результате процессинга из первичного транскрипта не только вырезаются индивидуальные рРНК, но и удаляется интрон посредством аутосплайсинга. Для приобретения функциональной активности РНК в большинстве случаев должна подвергнуться сложнейшим посттранскрипционным модификациям.
Почти вся рРНК находится в виде магниевой соли, что необходимо для поддержания структуры. При удалении ионов магния рибосома подвергается диссоциации на субъединицы. Синтез рибосом у эукариот происходит в специальной внутриядерной структуре - ядрышке.
Слайд 33Количество ядрышек в клетках обычно от1 до 5, но оно
не постоянно, например,
в половых клетках количество ядрышек может достигать несколько
сотен.
Увеличение числа ядрышек называется амплификацией ядрышек. Число
ядрышек зависит от «ядрышковых организаторов», которые локализованы во
вторичных перетяжках хромосом. Чем больше число «ядрышковых
организаторов», тем больше ядрышек. Число ядрышек увеличивается согласно
плоидности ядра. Количество ядрышек меньше числа «ядрышковых
организаторов», так как «ядрышковые организаторы» могут сливаться.
«Ядрышковые организаторы» представляют полицистронные
участки, которые содержат множество одинаковых генов (полиизогенные
участки), т.е. рибосомные гены. В ядрах встречаются ядрышки, не связанные с
ядрышковыми организаторами. Их копии могут либо включаться в состав
хромосом, либо становиться свободными. В структуре ядрышка различают:
Глобулярный центр, фибриллярный центр, плотный фибриллярный компонент
(ПФК), хроматин, белковый сетчатый матрикс. На поверхности фибриллярного
центра происходит активация транскрипционных единиц – связывание с
факторами транскрипции и РНКполимеразой I, которая начинает считывать
первичный транскрипт рРНК. По мере прохождения первой РНК-полимеразы на
освобождающийся участок транскрипционной единицы садится следующая
РНК-полимераза и начинается синтез новой рРНК.

Слайд 34рРНК катализирует пептидилтрансферазную реакцию, в
результате которой происходит образование пептидных связей
в
процессе синтеза белка на рибосомах. Созревание рибосом
заканчивается образованием функционального
рибонуклеопротеида (конмплекс
рРНК и белков).
Рибосомные белки. Во-первых, рибосомные белки располагаются
преимущественно на обращенной к растворителю поверхности
рибосомы, а между субчастицами белков практически нет.
Во-вторых, большинство рибосомных белков имеют глобулярную
конформацию, однако некоторые содержат вытянутые
нерегулярные участки, которые приобретают упорядоченную третичную
структуру при связывании с рРНК. Были обнаружены также белки,
которые не имеют глобулярной формы, например, белок S14.
В-третьих, главной ролью рибосомных белков, по-видимому, является
роль «скрепок», стабилизирующих структуру рРНК. Тем не менее, часть
рибосомных белков может играть самостоятельную роль в составе
рибосомы.
В-четвертых, вторичная структура рРНК почти полностью состоит из
элементов известных ранее для малых фрагментов РНК.
Слайд 35Двухнитевые спиральные элементы рРНК соединены петлями, которые часто
представляют собой нерегулярные
участки А-спиралей РНК, и
взаимодействуют между собой малыми желобками (аналогично упаковке
интрона
I рибозима). Часто такие взаимодействия стабилизированы
внедрением аденина в малый желобок спирали рРНК или взаимодействиями
фосфатной группы одной спирали с малым желобком второй, а также
взаимодействиями неспаренных пуринов в двух перпендикулярных спиралях
РНК. Рибосомные белки, взаимодействующие с рРНК независимо от других
белков и связывающиеся только со специфическими участками рРНК,
Называются сердцевинными или первичными РНК- связывающими
Рибосомными белками. Остальные рибосомные белки также связываются с
рРНК, но участки связывания этих белков формируются только после
Связывания сердцевинных белков. В настоящее время модели рибосомных
субчастиц активно используются для определения положения антибиотиков
на рибосоме и предсказания их контактов с рРНК.
Слайд 36Молекулы тРНК состоят примерно из 75 нуклеотидов и начинаются с
фосфорилированного 5'-конца. Первым основанием обычно является гуанин. На З'-конце всегда
присутствуют три основания - ССА и концевая ОН-группа. На долю тРНК приходится около 10 – 15 % общего количества клеточной РНК. В тРНК присутствуют модифицированные (минорные) азотистые основания (псевдоуридин, дигидроуридин, тимидин, 7-метилгуанозин, инозин и др.). Их доля может достигать до 25 %. Более половины оснований тРНК образуют внутрицепочечные пары по принципу комплементарности.
тРНК узнает соответствующий кодон в
мРНК и переносит нужную минокислоту
к растущей полипептидной цепи.
Узнавание кодона в мРНК существляется
с помощью трех последовательных
оснований в тРНК, называемых
антикодоном. Между азотистыми
основаниями кодона и антикодона
образуются уотсон-криковские водородные связи
при условии, что полинуклеотидные
цепи антипараллельны.
Слайд 37Участки, в которых посредством Н-связей образовались пары
оснований, называются стеблями,
а одноцепочечные участки —
петлями. Все известные тРНК образуют «клеверный
лист» с
четырьмя стеблями (акцепторным, D, антикодоновым и Т) и тремя
петлями (D, антикодоновой и Т). Некоторые тРНК имеют
дополнительные петли и/или стебли (например, вариабельная
петля дрожжевой фенилаланиновой тРНК). Каждый стебель
состоит из двух антипараллельных цепей, образующих правую двойную
спираль, известную как А-форма РНК. Эта форма содержит 11 пар
оснований на виток, шаг спирали равен 3.1 нм. Плоскости оснований
составляют около 20° с нормалью к оси двойной спирали. А-форма РНК
близка к аналогичной форме ДНК. РНК не способна менять
конформацию и переходить в В-форму, что обусловлено наличием 2'-ОН
группы в рибозе, которой нет в дезоксирибозе. Пространственная
(третичная) структура молекулы тРНК напоминает по форме букву Г.
«Перекладину» этой буквы образует спираль из акцепторного и Т-
стеблей, а антикодоновый и D-стебли формируют «ножку». В каждой
части содержится примерно 10 пар оснований.
Слайд 38Аминокислотный остаток присоединяеться к З'-концу молекулы тРНК.
Специфичность такой системы переноса
обеспечивается тем, что
имеется, по крайней мере, одна тРНК для
каждой аминокислоты. Так,
тРНК для Рhе обозначается тPHKPhe.
Следует подчеркнуть, что Ф, участвующие в транскрипции, являются
мишенями для ряда БАВ, в частности антибиотиков и токсинов. Например,
токсин бледной поганки - α-аманитин - блокирует РНК-полимеразу II эукариот,
что приводит к прекращению синтеза новых молекул мРНК и многих жизненно
важных белков. Таким образом, формируется вторичная структура, получившая
название клеверного листа. В ней выделяют:
а) дигидроуридиловую ветвь, содержащую до 3 остатков дигидроуридина;
б) псевдоуридиловую ветвь, содержащую минорные азотистые основания псевдоуридина;
в) антикодоновую ветвь, в центре которой находится антикодон, который комплементарен в антипаралельном направлении кодону иРНК;
г) дополнительную ветвь. Число составляющих ее нуклеотидов варьирует от 3 до 20. В некоторых тРНК данная ветвь отсутствует;
д) акцепторную ветвь с универсальной 3'-концевой последовательностью ЦЦА, служащей акцептором остатка аминокислоты. Который присоединяется к 3’-или 2’-гироксильной группе остатка рибозы последнего нуклеотида .

Слайд 39Каждая аминокислота, как правило, имеет несколько соответсвующих ей
тРНК, которые называются
изоакцепторными. Изоакцепторные тРНК
отличаются антикодонами и используются для считывания разных
кодонов
иРНК, соответствующих одной и той же аминокислоте. Общее
число генов тРНК в различных организмах сильно варьирует
(у Escherichia coli их около 70, у шпорцевой лягушки Xenopus laevis
около 7 000, у человека – 1300.). Каждый ген тРНК может быть
представлен в геноме десятками копий. Почти все тРНК синтезируются
в виде предшественников – более длинных молекул (пре-тРНК). В
результате процессинга происходит удаление нуклеотидных
последовательностей с флангов пре-тРНК. С 5’-конца фрагмент
нуклеотидной цепи отщепляет фермент, называемой РНКазой Р.
РНКазой P является рибонуклеопротеином, каталитическую функцию в
котором осуществляет РНК-компонент, белок же выполняет структурную
роль. В бактериальной РНКазе P есть участок, комплементарный ЦЦА
участку тРНК. Эукариотическая РНКаза P узнает другие элементы
предшественника тРНК. С 3’-конца пре-тРНК действует экзонуклеаза,
укорачивающая РНК постепенно, удаляя по одному нуклеотиду.

Слайд 40На заключительных стадиях созревания тРНК к 3’-концу
полинуклеотидилтрансфераза присоединяет последовательность ЦЦА.
У
эукариот ЦЦA- последовательность не кодируется в генах тРНК,
Она добавляется посттранскрипционно.
У прокариот первичный
транскрипт может содержать несколько последовательностей тРНК,
их процессинг включает вырезание индивидуальных молекул тРНК. В
процессе созревания тРНК также происходит модификация
азотистых оснований – в результате которой образуются минорные
основания: псевдоуридин, дигидроуридин, тимидин,
7-метилгуанозин, инозин и др.
Канонические последовательности на границе интрона и экзона,
характерные для пре-иРНК, у пре-тРНК отсутствуют. В тоже время в
составе интронов имеются последовательности комплементарные
антикодону. Спаривание этих последовательностей с антикодоном,
по-видимому, и обуславливает формирование структур,
обеспечивающих протекания сплайсинга.
Слайд 41В последние годы была установлена роль коротких отрезков РНК (малых
РНК). Понятно, что с первого взгляда малые РНК, состоящие всего
из нескольких десятков нуклеотидов, могли показаться остатками от своих «больших братьев». И даже несмотря на то, что роль отдельных малых молекул РНК в процессах превращения информационных РНК (сплайсинге), а также при упаковке нитей нуклеиновых кислот, была доказана ранее, истинным «хитом» в биологии малые РНК стали только лишь с открытием своей способности подавлять экспрессию генов у животных.
Слайд 42В нормально работающей клетке каждый ген выполняет собственную, строго определенную
функцию. Например, отвечает за выработку белка, мРНК, или за взаимодействие
с другими регуляторными белками.
При этом говорят о нормальной экспрессии (от лат. expressus - выразительный, явный) гена в клетке. Если же количество продукта данного гена (например, белка) снижается, то говорят о снижении экспрессии данного гена. Эффект «гашения» экспрессии определенных генов малыми РНК получил название РНК - интерференции, а молекулы, вызывающие его, назвали siRNA (small interfering Ribonucleic Acids - малые интерферирующие рибонуклеиновые кислоты). С открытием siRNA - интерференции стало ясно, что этот феномен может иметь огромное практическое значение.
Слайд 43РНК интерференция
Нобелевскую премию за открытия в области медицины и физиологии
в 2006 году получили в равных долях американские ученые Эндрю
Файр (Andrew Z. Fire. Гражданин США. Профессор кафедры патологии и генетики Медицинской школы Стэнфордского университета, США) и Крэйг Меллоу (Craig C. Mello. Гражданин США. Профессор кафедры молекулярной медицины Медицинской школы Университета Массачусетса, США) за "открытие РНК-интерференции - подавления генов двухцепочечной РНК".
Малая интерферирующая РНК (siRNA) обладает способностью "выключать" гены, воздействуя на процесс передачи "инструкций" между ДНК и всей остальной «машинерией» клетки.
Обладает исключительной специфичностью по отношению к своему гену-мишени. Основная функция этого механизма – защита наследственной информации. Механизм, связанный с siRNA предохраняет нас как от спорадических мутаций, так и от внешних атак на нашу наследственную информацию.
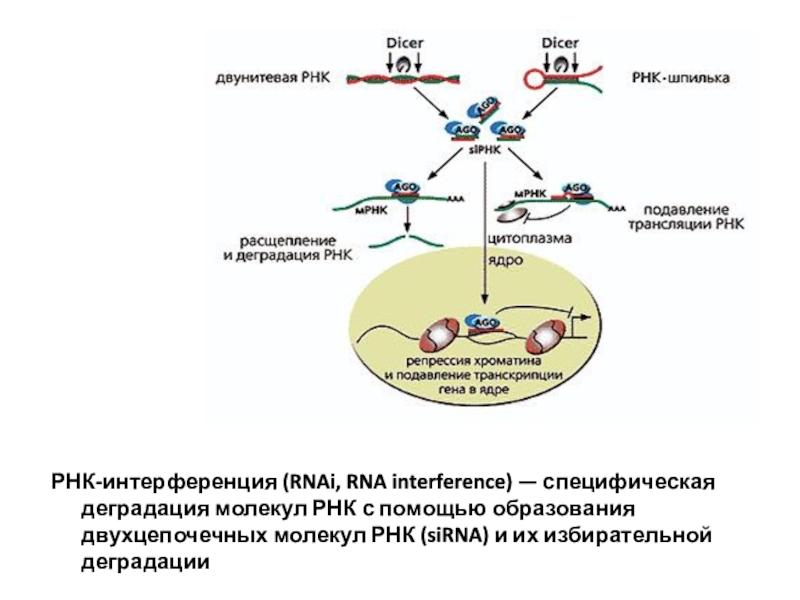
Слайд 44РНК-интерференция (RNAi, RNA interference) — специфическая деградация молекул РНК с
помощью образования двухцепочечных молекул РНК (siRNA) и их избирательной деградации
Слайд 45В класс малых РНК включают молекулы, содержащие от 20 до
300 нуклеотидов. За эффект РНК - интерференции отвечают самые короткие
из них - siRNA, состоящие всего из 21-28 (у млекопитающих из 21-23) нуклеотидов. Особенностью этих молекул является то, что они, в отличие от большинства других клеточных РНК, состоящих всего из одной цепи нуклеотидов, являются двунитчатыми. Нуклеотиды с противоположных нитей (цепей) siRNA спариваются друг с другом по тем же законам комплементарности, которые формируют двунитчатые цепи ДНК в хромосомах. Кроме того, по краям каждой из цепей siRNA всегда остается два неспаренных нуклеотида. Как siRNA появляются в клетке? Очевидно, в клетке должен существовать некий молекулярный механизм, который обеспечивал бы синтез siRNA, их накопление в клетке и позволял бы им выключать гены. Ученым удалось выявить систему ферментов, которая во многом схожа у всех многоклеточных и некоторых одноклеточных организмов.
Слайд 46Если молекула siRNA по тем или иным причинам (например, по
воле исследователя) появляется в клетке, ее сразу же «берет в
оборот» специальная клеточная система белков, для которых появление siRNA является сигналом к немедленному действию. На первом этапе с молекулой siRNA связываются белки-ферменты хеликаза и нуклеаза, формируя комплекс RISC (RNA-induced silencing complex; silence - англ. молчать, замолкать; silencing - замолкание, так в англоязычной и специальной литературе называют процесс «выключения» гена). Хеликаза раскручивает нити siRNA, в результате чего они расходятся. Одна из этих нитей, к которой прикреплен фермент нуклеаза, может теперь связаться с комплементарным участком однонитчатой мРНК, позволяя нуклеазе разрезать ее. Разрезанные же участки мРНК подвергаются действию других клеточных РНКаз, которые доразрезают их на более мелкие куски.
Слайд 47Итак, основная «специальность» siRNA в клетке - это блокирование тех
генов, которые соответствуют одной из цепочек внутри siRNA. С помощью
siRNA клетка может защищать себя от проникновения вирусов. Геном некоторых из этих опасных варваров состоит из ДНК, у некоторых же - из РНК, причем, против обычных правил, РНК у вирусов может быть как одно-, так и двунитчатой. Сам процесс разрезания чужеродной (вирусной) мРНК в этом случае происходит путем активаций комплекса ферментов RISC. Однако для большей эффективности растения и насекомые изобрели своеобразный путь усиления защитного действия siRNA. Присоединяясь к цепи мРНК, участок siRNA может с помощью комплекса ферментов, называемого DICER, сначала достроить вторую цепочку мРНК, а затем разрезать ее в разных местах, создавая, таким образом, разнообразные «вторичные» siRNA. Они, в свою очередь, формируют RISC и проводят мРНК через все стадии, о которых шла речь выше, вплоть до ее полного уничтожения.
Слайд 48Такие «вторичные» молекулы смогут специфично связываться не только с тем
участком вирусной мРНК, к которому была направлена «первичная» молекула, но
также и с другими участками, что резко усиливает эффективность клеточной защиты.
Таким образом, у растений и низших животных организмов siRNA являются важным звеном своеобразного «внутриклеточного иммунитета», позволяющего распознавать и быстро уничтожать чужую РНК. В том случае, если в клетку проник РНК - содержащий вирус, такая система защиты не даст ему размножиться. Если же вирус содержит ДНК, система siRNA будет мешать ему производить вирусные белки (так как необходимая для этого мРНК будет распознаваться и разрезаться), и с помощью этой стратегии, замедлит его распространение по организму.
Слайд 49У млекопитающих же, в отличие от насекомых и растений, работает
и другая система защиты. При попадании в «зрелую» (дифференцированную) клетку
млекопитающего чужой РНК, длина которой больше 30 нуклеотидов, клетка начинает синтез интерферона. Интерферон, связываясь со специфическими рецепторами на клеточной поверхности, способен стимулировать в клетке целую группу генов. В результате в клетке синтезируется несколько видов ферментов, которые тормозят синтез белков и расщепляют вирусные РНК. Кроме того, интерферон может действовать и на соседние, еще не зараженные клетки, блокируя тем самым возможное распространение вируса.
Слайд 50Как можно заметить, обе системы во многом схожи: у них
общая цель и «методы» работы. Даже сами названия «interferon» и
«(RNA) interference» происходят от общего корня. Но есть у них и одно очень существенное различие: если интерферон при первых признаках вторжения просто «замораживает» работу клетки, не позволяя (на всякий случай) производство многих, в том числе и «невиновных» белков в клетке, то система siRNA отличается чрезвычайной разборчивостью: каждая siRNA будет распознавать и уничтожать только свою, специфическую мРНК. Замена всего лишь одного нуклеотида внутри siRNA ведет к резкому снижению эффекта интерференции.
Слайд 51В этом и заключается основное преимущество малых РНК: ни один
из блокаторов генов, известных до сих пор, не обладает такой
исключительной специфичностью по отношению к своему гену-мишени. Однако, как видно на примере многих опасных вирусных заболеваний у людей, ни иммунная, ни интерфероновая защита не всесильны, так что нам самое время позаимствовать у кого-нибудь передовой опыт в борьбе с вирусами. Почему бы не у растений или у насекомых? Ни те, ни другие не обладают системой адаптивного иммунитета. Чтобы выжить, растения были вынуждены «изобрести» РНК - интерференцию, которая до сих пор успешно защищает их клетки от внедрения вирусов. Появляется вполне закономерный вопрос: нельзя ли применить этот же подход в отношении клеток животных и людей?
Слайд 52Геном любого многоклеточного организма включает в себя множество элементов, которые
когда-то были привнесены в него в процессе эволюции извне, например
как результат встраивания вируса. Судите сами: из всего материала, содержащегося в наших с вами хромосомах, 34% приходится на долю элементов, называемых LINEs и SINEs (соответственно, Long и Short Interspersed Nuclear Elements), о функциях которых известно только то, что они могут по временам копировать себя и перемещаться с одного места хромосомы на другое; те участки ДНК, которые достались нам от ретровирусов (8% генома) и транспозоны (3%) также способны менять свое место в геноме. На их фоне всего лишь 2 (два(!)) процента собственно генов, кодирующих наши клеточные белки, кажутся такой же маловажной деталью, как и siRNA среди огромного разнообразия своих больших «сестер».
Слайд 53LINEs, SINEs, остатки вирусной ДНК и транспозоны, за свою способность
к перемещениям именуемые подвижными, или мобильными элементами генома, представляют значительную
опасность для наших хромосом. «Чужие среди своих», они при определенных обстоятельствах могут поднять бунт и привести к внутриклеточному хаосу. Некоторые из них - остатки вирусов, или протоонкогены - способны при «включении» вызывать рак; мобильные элементы, размножаясь и перемещаясь, меняют структуру хромосом, что может привести к мутациям. Например, у излюбленного объекта генетических исследований - плодовой мушки дрозофилы - более 80% спонтанных мутаций возникают именно из-за «хулиганского» поведения ее собственных мобильных элементов. Их перемещения внутри генома так индивидуальны и непредсказуемы, что положение некоторых из них может служить «молекулярным паспортом», точно определяющим личность хозяина, что уже используется на практике.
Слайд 54Система внутриклеточных siRNA выполняет «надзирательскую» функцию за поведением мобильных элементов.
На модели все того же С. elegans, например, было показано,
что отключение генов, кодирующих некоторые из малых РНК, ведет к активизации перемещений мобильных элементов в его хромосомах и, соответственно, к повышению уровня мутаций.
Кроме того, ошибки в развитии органов и тканей при отключении генов, кодирующих систему siRNA у подопытных животных, а также ее активность в «незрелых» клетках указывают на то, что механизм РНК - интерференции активно участвует в регуляции программы «созревания» клеток и, как следствие, может играть одну из ключевых ролей в формировании целостного организма.
Еще одна из предполагаемых нормальных функций siRNA - отслеживание неправильно обработанных копий других типов РНК в клетке.
Имеются данные, что в некоторых случаях siRNA, видимо, воздействует прямо на ДНК, изменяя структуру хроматина и способствуя длительному «замолканию» одних, и, возможно, активизации других генов.
Слайд 55Мультифунк циональность РНК
(1) Кодирующая функция:
программирование белкового синтеза линейными последовательностями полирибонуклеотидов.
(2)
Репликативная функция:
репликация генетического материала через комплементарные последовательности полинуклеотидов.
(3) Структурообразующая функция
(формирование трехмерных структур):
само-сворачивание линейных полирибонуклеотидов в уникальные компактные конформации.
(4) Функция специфического узнавания лигандов:
специфические пространственные взаимодействия с другими макромолекулами и малыми лигандами.
(5) Каталитическая функция:
специфический катализ химических реакций рибозимами.
Слайд 56КОДИРУЮЩИЕ ФУНКЦИИ РНК
(1) РНК (как и ДНК!) могут служить матрицей
для собственного воспроизведения через комплементарные цепи РНК:
1962-1964 – открытие
самовоспроизведения полиовирусной РНК в животных клетках (D. Baltimore).
1965-1966 – открытие самовоспроизведение РНК бактериофагов типа R17 и MS2 в бактериальных клетках (S. Spiegelman).
(2) РНК могут служить матрицей для синтеза ДНК:
1970 – открытие обратной транскрипции
(H.M. Temin, D. Baltimore).
Слайд 57Каталитическая функция РНК
(рибозимы)
(1) Открытие природных рибозимов:
K. Kruger, P.J. Grabowski,
A.J. Zaug, J. Sands, D.E. Gottschling and T.R. Cech (1982)
Self-splicing RNA: Autoexcision and autocyclization of the ribosomal RNA intervening sequences of Tetrahymena. Cell 31: 147-157.
C. Guerrier-Takada, K. Gardiner, T. Marsh, N. Pace and S. Altman (1983) The RNA moiety of ribonuclease P is the catalytic subunit of the enzyme. Cell 35: 849-857.
(2) Создание искусственных рибозимов:
D.L. Robertson and G.F. Joyce (1990) Selection in vitro of an RNA enzyme that specifically cleaves single-stranded DNA. Nature 344: 467-468.
Reviewed in: T.R. Cech and B.L. Golden (1999) Building a catalytic active site using only RNA. In The RNA World, 2nd Edition (Eds. R.F. Gesteland et al.), CSHL Press, New York.
Слайд 58Каталитические (естественная и исскуственная)
функции РНК (рибозимы)
Гидролиз фосфоэфирных связей
Трансэстерификация
Лигирование
и полимеризация нуклеотидов, в том числе на матрице ДНК или
РНК
Алкилирование и аминоацилирование нуклеотидов
Синтез амидных (пептидных) связей между аминокислотами
Транспептидация
Синтез углерод-углеродных связей
Слайд 59Каталитические (естественная и исскуственная)
функции РНК (рибозимы)
Гидролиз фосфоэфирных связей
Трансэстерификация
Лигирование
и полимеризация нуклеотидов, в том числе на матрице ДНК или
РНК
Алкилирование и аминоацилирование нуклеотидов
Синтез амидных (пептидных) связей между аминокислотами
Транспептидация
Синтез углерод-углеродных связей
Слайд 60Функция узнавания малых лигандов (субстратов)
(1) E. Cundliffe (1986) Involvement
of specific portions of ribosomal RNA in defined ribosomal functions:
A study utilizing antibiotics. In Structure, Function, and Genetics of Ribosomes (Eds. B. Hardesty and G. Kramer), p.p. 128-142. Springer-Verlag, New York.
«До сих пор не подозреваемая способность РНК узнавать малые молекулы».
(2) Открытие и создание аптамеров. Методология SELEX’a.
А. Ellington and J. Szostak (1990) In vitro selection of RNA molecules that bind specific ligands. Nature 346: 818-822.
C. Tuerk and L. Gold (1990) Systematic evolution of ligands by exponential enrichment. Science 249: 505-510.
Слайд 61Функция узнавания малых лигандов (субстратов)
(3) Демонстрация специфических взаимодействий природных
РНК с малыми молекулами.
D. Fourmy, M.I. Recht, S.C. Blanchard and
J.D. Puglisi (1996) Structure of the A site of E. coli 16S rRNA complexed with an aminoglycoside antibiotic. Science 274: 1367-1371.
Трехмерные структуры комплексов РНК с аминогликозидными антибиотиками.
(a) Paromomycin-A-site RNA complex.
(b) Tobramycin-RNA aptamers complex.
Reproduced from J.D. Puglisi and J.R. Williamson (1999) In The RNA World,
2nd Edition (Eds. R.F. Gesteland et al.), CSHL Press, New York.
Слайд 62Таким образом, рибонуклеиновые кислоты
способны осуществлять все основные функции, свойственные
как ДНК, так и белкам.
Следовательно, ансамбли молекул РНК
с
разными взаимодополняющими функциями
могут быть самодостаточными в качестве
ассимилирующих, метаболизирующих,
структурообразующих и реплицирующихся систем, т. е. быть прототипами живых систем.