Слайд 2Распространенность в природе
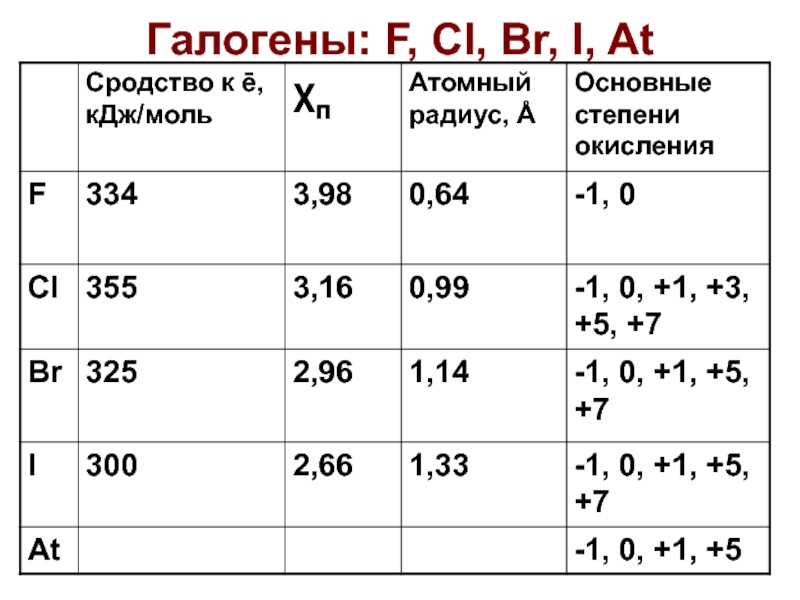
F Cl Br I At (1/2
(210At) = 8,1 часа)
CaF2 – плавиковый шпат (флюорит)
NaCl – галит,
KCl·NaCl – сильвинит, KCl·MgCl2·6H2O - карналлит, NaBr, NaI – месторождения и природные воды
NaIO3 – в месторождениях нитратов щелочных металлов
Слайд 3Открытие элементов
F2 - открыт в 1886 г., Муассан (Франция)
Cl2 -
открыт в 1774 г. Шееле (Швеция)
Br2 – открыт в 1825
г., Левиг (студент университета Хайдельберг, Германия) или Ж. Балар (Франция) в 1826 г.
I2 – открыт в 1811 г., Куртуа (Франция) – фабрикант производства мыла и соды; название дал Гей-Люссак в 1813 г.
At – открыт в 1940 г. Д. Корсон, К. Мак-Кензи и Э. Сегре (США); название дали в 1947г. после войны; получен в циклотроне по ядерной реакции при бомбардировке Bi мишени -частицами
Слайд 4Происхождение названий
F – греческое фторос – разрушение, гибель
Cl – греческое
хлорос – желто-зеленый
Br - греческое бромос – зловонный
I – греческое
иоэдес – темно-синий
At – греческое астатос – неустойчивый
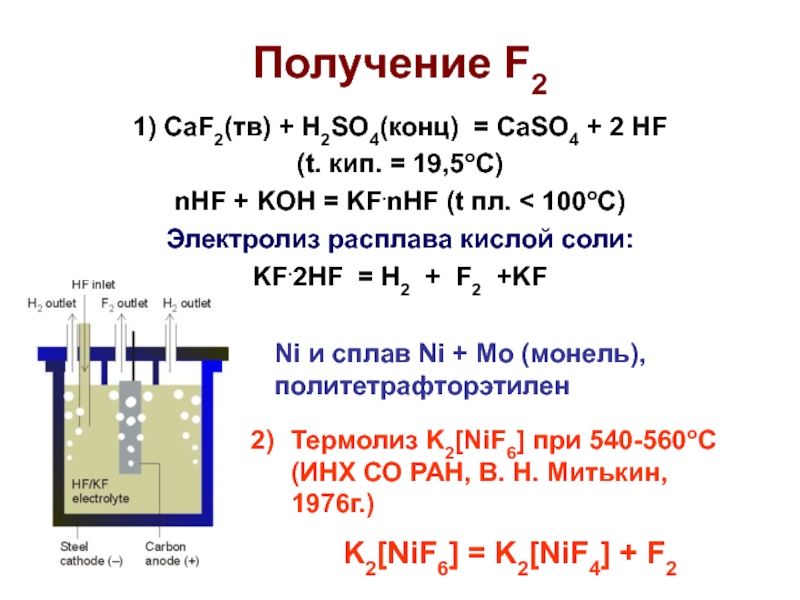
Слайд 5Получение F2
1) CaF2(тв) + H2SO4(конц) = CaSO4 + 2 HF
(t. кип. = 19,5оС)
nHF + KOH = KF.nHF (t пл.
100оС)
Электролиз расплава кислой соли:
KF.2HF = H2 + F2 +KF
Ni и сплав Ni + Mo (монель), политетрафторэтилен
Термолиз K2[NiF6] при 540-560оС (ИНХ СО РАН, В. Н. Митькин, 1976г.)
K2[NiF6] = K2[NiF4] + F2
Слайд 6Получение Cl2
Промышленный способ
NaCl (расплав) = Na + ½ Cl2
Анод: 2Cl-
- 2ē = Cl2
Катод: 2H2O + 2ē = H2 +
2 OH-
Лабораторный способ
Взаимодействие конц. HCl с разными окислителями: KMnO4, K2Cr2O7 (tºC) , MnO2 (tºC), KClO3, PbO2
Слайд 7Получение Br2
Промышленный – хлорирование рассолов, содержащих Br- (морская вода и
вода некоторых озер)
2Br- + Cl2 = 2Cl- + Br2
pH ~
3,5
t кипения = 58,8оС (отгоняют потоком воздуха)
Лабораторный способ (редко)
MnO2 + 2Br- + 4H+ = Mn2+ +2H2O +Br2
Слайд 8Получение I2
Лабораторный способ (редко)
MnO2 + 2I- + 4H+ = Mn2+
+2H2O + I2 (возгоняют)
Промышленный – хлорирование растворов, содержащих I-
2I- +
Cl2 = I2 + 2Cl-
Избыток Cl2:
I2 + 5 Cl2 + 6H2O = 2 HJO3 + 10HCl
Иодаты осторожно восстанавливают:
2JO3- + 5SO2 + 4H2O = I2 + 5SO42- +8H+
I2 + SO2 + 2H2O = 2I- + SO42- +4H+
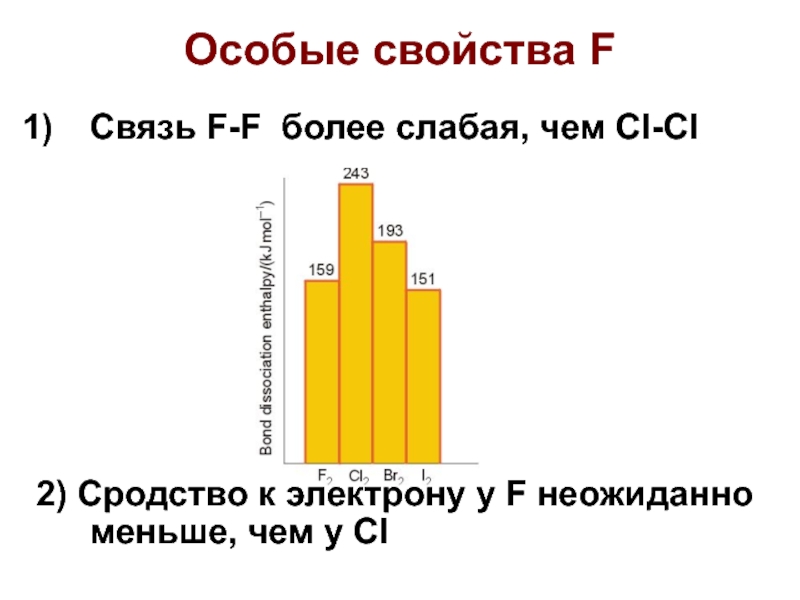
Слайд 9Особые свойства F
Связь F-F более слабая, чем Cl-Cl
2) Сродство к
электрону у F неожиданно меньше, чем у Cl
Слайд 10Особые свойства F
3) Соединения фтора более летучие, по сравнению с
соединениями хлора
t. кип. CF4 = -128oC, t. кип. CCl4
= +77oC
t. кип. PF3 = -101oC, t. кип. PCl3 = +76oC
F менее поляризуемый
дисперсионные взаимодействия меньше
4) Аномально высокая t кип. HF
Слайд 11Особые свойства F
5) F – самый электроотрицательный элемент
6) По способности
стабилизировать высшие степени окисления фтор уступает только кислороду
IF7, PtF6, BiF5,
K[AgF4] , PbF4, K2[NiF6]
7) Фтор не образует устойчивые соединения в низших степенях окисления
CuF – неизвестен, CuX (X = Cl, Br, I) – известны
Слайд 12Галеноводороды НХ
В газовой фазе: H+X- (полярная ковалентная связь)
Кислотность: HF
HCl HBr HI
В водных растворах:
HF – слабая (Ka
= 7,2.10-5)
HCl , HBr, и HI (сильные кислоты)
Нивелирующее влияние воды на кислотные свойства.
Степень диссоциации α в 0,1М растворе (18оС):
HF (10%), HCl (92,6%), HBr (93,5%), HI (95%)
Слайд 13Особенности HF
HF (жидкая) – сильная кислота
HF (газ) - сильная кислота
HF
(в воде) - слабая кислота
Самоионизация жидкой HF
3HF = H2F+ +
HF2-
Прочная водородная связь 165 кДж/моль, энергия ков. cвязи H-F равна 565 кДж/моль.
Жидкий HF – растворитель, реагирует с металлами (если не образуется прочная защитная пленка AlF3, MgF2, NiF2)
Zn + 2HF(ж) = ZnF2 + H2
Слайд 15Галогениды металлов – твердые в-ва, ионные кристаллы, как правило, растворимы
в воде.
Не растворимы в воде: AgX, PbX2, Hg2X2, CuX (X
= Cl, Br, I)
Фториды почти все нерастворимы, за исключением MF (M- щелочной металл), AgF, NH4F
Галогениды неметаллов
Газы: BF3, SiF4, PF3, PF5
Жидкие: BCl3, SiCl4, PCl3, POCl3
Твердые: BI3, PCl5
PCl3 + 3H2O = 3HCl + H3PO3
PCl5 + 8 NaOH = 5NaCl + Na3PO4 + 4H2O
Слайд 16Получение HX
А) Синтез из простых веществ
H2 + X2 = 2
HX, rH 0
Для увеличения выхода надо снижать Т, но
это снижает скорость реакции
HF – Реакция идет со взрывом
Степень диссоциации HX при 1000оС, 1 атм:
HCl – 0,014%
HBr- 0,5%
HI – 33%
Слайд 17Получение HX
Б) Из солей реакцией ионного обмена
CaF2(тв) + H2SO4 (конц)
= CaSO4 + 2HF (газ)
2NaCl (тв) + H2SO4 (конц) =
Na2SO4 + 2HCl (газ)
Но!!!!
2NaBr(тв) + H2SO4 (конц) = Na2SO4 + Br2 + SO2 +H2O
2NaI(тв) + H2SO4 (конц) = Na2SO4 + I2 + H2S +H2O
NaBr + H3PO4 = HBr + Na2H2PO4
Аналогично получают HI
В) Гидролиз галогенидов неметаллов
2P(тв) + 3Br2(ж) = 2PBr3
PBr3 + 3H2O = 3HBr + H3PO3
Слайд 18Взаимодействие Х2 с водой
Особенности F2
Физическое растворение и химические реакции.
При
низких температурах можно выделить гидрат Cl2.7,3H2O
Суммарная растворимость (с учетом всех
форм) при 20оС
Cl2 – 0,73%; Br2 – 3,6%; I2 – 0,03%
KI + J2 = KI3
Экстракция неполярными растворителями: толуол, эфир, CCl4
Слайд 19Химическое взаимодействие с водой
X2 + H2O = H+ + X-
+ HOX
Реакция диспропорционирования обратима.
К = 4.10-4 (X = Cl);
7.10-9 (X = Br); 2.10-13 (X = I)
В щелочной среде равновесие сдвинуто вправо
X2 + 2OH- = X- + OX- + H2O
K = 1015 (X = Cl); 108 (X = Br); 30 (X = I)
Диспропорционирование гипогалогенид- ионов
3OX- = 2X- + XO3-
K 1015, НО для X = Cl, Br реакция кинетически затруднена и идет только при нагревании
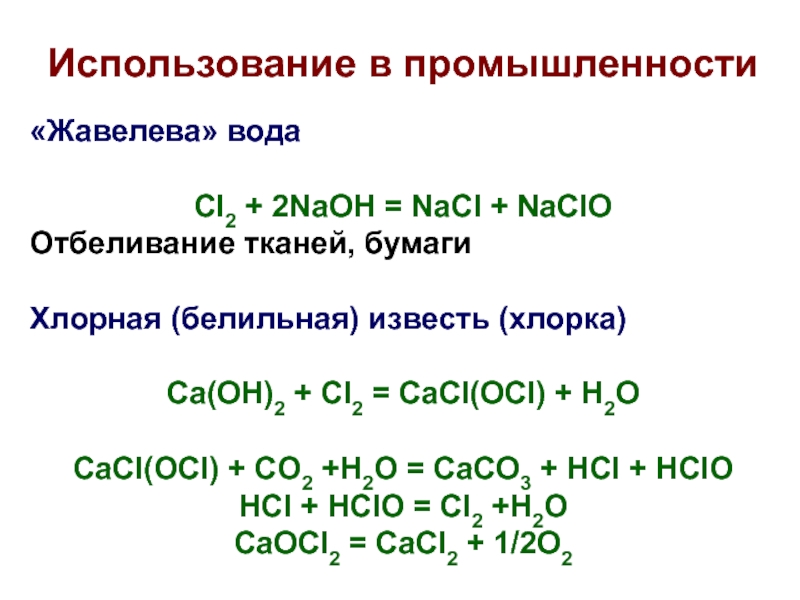
Слайд 20Использование в промышленности
«Жавелева» вода
Cl2 + 2NaOH = NaCl + NaClO
Отбеливание
тканей, бумаги
Хлорная (белильная) известь (хлорка)
Ca(OH)2 + Cl2 = CaCl(OCl) +
H2O
CaCl(OCl) + CO2 +H2O = CaCO3 + HCl + HClO
HCl + HClO = Cl2 +H2O
CaOCl2 = CaCl2 + 1/2O2
Слайд 21Важные замечания
Наиболее устойчивая степень окисления для ВСЕХ ГАГОЛЕНОВ -1 (Х-)
ГАЛОГЕНЫ
ВО ВСЕХ СТЕПЕНЯХ ОКИСЛЕНИЯ (кроме -1) ЯВЛЯЮТСЯ СИЛЬНЫМИ ОКИСЛИТЕЛЯМИ
ВСЕ ФОРМЫ
ОСОБЕННО СИЛЬНЫЕ ОКИСЛИТЕЛИ В КИСЛОЙ СРЕДЕ
ДЛЯ ГАЛОГЕНОВ ХАРАКТЕРНЫ РЕАКЦИИ ДИСПРОПОРЦИОНИРОВАНИЯ
Слайд 22 Кислородсодержащие кислоты и их соли
Степень окисления +1
HXO: HFO(??), HClO,
HBrO, HIO
Ka = 10-8 (X = Cl), 10-9 (X=Br), 10-11
(X=I)
Амфотерные свойства HIO
HIO = H+ + IO-
HIO = OH- + I+, Kb = 10-10
Растворимость I2 в соляной кислоте увеличивается
I2 + H2O = HI + HIO
HIO + HCl = H2O + ICl
Слайд 23Получение кислот HXO
X2 + H2O + CaCO3 (тв) = CaCl2
+ CO2 + HXO
(X = Cl, Br)
I2 + H2O
+ HgO(тв) = HgI2 + 2HIO
Соли подвергаются гидролизу (pH 7)
XO- + H2O = HXO + OH-
Кислоты HXO являются сильными окислителями
Уменьшение окислительных свойств
HClO HBrO HIO
Уменьшение скорости ox/red реакций
HClO HBrO HIO
Характерны реакции диспропорционирования
3OX- = 2X- + XO3-
K 1015, НО для X = Cl, Br реакция кинетически затруднена и идет только при нагревании
Слайд 24Степень окисления +3
Нет HIO2 и нет примеров солей
Нет HBrO2, только
ОДИН пример соли
Ba(BrO)2 +2Br2 + 4KOH = Ba(BrO2)2 + 4KBr
+ 4H2O
(0oC, pH = 11,2)
Для кислоты HClO2 и ее солей характерны реакции диспропорционирования (особенно быстро в кислой среде). Соли взрываются!!
4HClO2 = ClO2 +HClO3 +HCl +H2O
Получение
2ClO2 +2KOH = KClO2 + KClO3 + H2O
Ba(OH)2 + H2O2 + 2ClO2 = Ba(ClO2)2 + 2H2O + O2
Ba(ClO2)2(сусп.) +H2SO4 (разб.) = BaSO4(тв)+ HClO2
Слайд 25Степень окисления +5
Сильные кислоты HXO3 (X = Cl, Br, I)
HClO3
и HBrO3 – только растворы (до 40%)
HIO3 – получена
твердая и в растворах
HIO3 HI3O8 (I2O5.HIO3) I2O5
Разложение при нагревании 40% р-ров:
3HClO3 = HClO4 + 2ClO2 +H2O
8HClO3 = 4HClO4 + 2Cl2 + 3O2 +2H2O
4HBrO3 = 2Br2 + 5O2 + 2H2O
Слайд 26Получение соединений X(+5)
ХЛОРАТЫ
Электрохимическое окисление хлоридов
KCl +3H2O = KClO3 (анод)
+ 3H2(катод)
Или:
6KOH (гор.р-р) + 3Cl2 = KClO3 + 5KCl +3H2O
БРОМАТЫ
Br2
+ 5Cl2 + 12KOH = 2KBrO3 + 10KBr +6H2O
KBr + 3Cl2 +6KOH = KBrO3 + 6KCl + 3H2O
ИОДАТЫ
I2 (тв) + HNO3(конц) = 2HIO3 + 10NO2 +4H2O
I2 + 2NaClO3 = 2NaIO3 + Cl2
Слайд 27Ox/red свойства X(+5)
1) Все X(+5)– сильные окислители
2) В
кислой среде более сильные окислители, чем в щелочной ClO3-
BrO3- IO3-
3) BrO3- и IO3- термодинамически устойчивы к диспропорционированию на XO4- и X-
4) ClO3- термодинамически неустойчив к диспропорционированию на XO4- и X-, но реакция МЕДЛЕННАЯ в растворах
Слайд 28Ox/red свойства X(+5)
Все X(+5)– сильные окислители, как правило, восстанавливаются до
X-
KClO3(тв) + 6HCl (конц) = 3Cl2 + 3 H2O +
KCl
Скорости восстановления IO3- BrO3- ClO3-
4KClO3(тв) + C6H12O6(тв) = 4KCl + 6CO2 + 6H2O
Слайд 29Разложение твердых солей при нагревании
4KClO3 = 3KClO4 + KCl (400oC)
2KClO3
= 2KCl + 3O2 (100oC, MnO2)
2KIO3 = 2KI + 3O2
2Cu(BrO3)2
= 2CuO + Br2 +5O2
Слайд 30Соединения Х(+7)
HClO4 – получены 100% растворы (взрывоопасно!), сильная кислота
HBrO4 –
получены 100% растворы (взрывоопасно!), сильная кислота
HIO4 – метаиодная кислота, Ka
= 3.10-2
H5IO6 – ортоиодная кислоа, Ka1 – 2.10-2; Ka2 = 10-9
Растворимые соли NaXO4, NaH4IO6, Na2H3IO6
Нерастворимые соли KClO4, Ag5IO6, Ba5(IO4)2, Na3H2IO6
Слайд 31Получение соединений X(+7)
Электролиз
XO3- + H2O = XO4-(анод) + H2(катод)
Реакции
в растворах
KBrO3 + O3 = KBrO4 +O2
KBrO3 + F2 +
2NaOH = KBrO4 + 2 NaF + H2O
В качестве окислителя используют XeF2
NaIO3 + Cl2 + 4NaOH = Na3H2IO3 + 2NaCl + H2O
Слайд 32Свойства соединений X(+7)
ПЕРХЛОРАТЫ ВЗРЫВАЮТСЯ!!!!!!!
KClO4(тв) = KCl + 2O2 (выше
500оС)
2NH4ClO4(тв) = N2 + Cl2 + 2O2 + 4H2O
(ВЗРЫВ
при 200оС)
1968 год: облучение нейтронами Rb2SeO4
82Se + n = 83Se
83Se = β + 83Br
RbBrO4 соосаждается с RbClO4
Слайд 33Оксиды галогенов
Неустойчивы, часто взрываются, с ними редко работают
F: OF2, O2F2,
F2O3(?), F2O4(?)
Cl: Cl2O, ClO2, Cl2O6, Cl2O7
Br: Br2O, Br2O3, BrO2
I:
I2O5
Слайд 34Оксиды фтора
F2 + O2 – нет реакции при температурах 100-1000оС
2F2
+ 2H2O = 4HF + O2 (+ получается O3 и
H2O2)
2F2 (газ) + NaOH (1% р-р) = OF2 + 2NaF + H2O
OF2 – бесцветный газ, устойчив, сильный фторокислитель, но более слабый, чем F2 (не реагирует со стеклом).
Дифторид дикислорода O2F2 – газ, разлагается выше -100оС.
F2(ж) + O2 (ж) = O2F2 (фотолиз)
Pu(тв) + 3O2F2(г) = PuF6 (г) + 3O2 (г)
Слайд 35Оксиды хлора: Cl2O
Монооксид хлора Cl2O – желто-коричневый газ, при нагревании
разлагается со взрывом.
Ангидрид кислоты HOCl, но хорошо растворим в воде
и дает очень мало HOCl.
2NaOH +Cl2O = 2NaOCl +H2O
Получение:
2HgO(тв., желтый) + Cl2 = Cl2O + HgO.HgCl2
Слайд 36Диокcид хлора ClO2 – желто-зеленый газ, парамагнитный (но не димеризуется!),
термодинамически неустойчив
(fG = +121 кДж/моль).
Хорошо растворим в воде, но
можно выделить только гидрат ClO2.nH2O (n = 6-10).
ClO2 +H2O = HCl + HClO3
(медленно и на свету)
2ClO2 + 2NaOH = NaClO2 + NaClO3
(быстро в водном растворе)
Оксид хлора ClO2
Слайд 37Оксид хлора ClO2
Получение в промышленности
2NaClO3 + SO2 = 2NaHSO4 +2ClO2
(в 4 М H2SO4)
Лабораторные методы
А) 2KClO3 + K2C2O4 +2H2SO4 =
2ClO2 +2CO2 +2KHSO4 +2H2O
(CO2 разбавляет ClO2 и предотвращает взрыв)
Б) 2AgClO3(тв) + Cl2 (г) = 2ClO2 +O2 +2AgCl (при 90оС)
В) 3KClO3(тв) + 3H2SO4(конц) = 2ClO2 +3KHSO4 +HClO4 +H2O (при 0оС)
Использование: обеззараживание сточных вод и питьевой воды, отбеливание бумаги.
Хлорорганические соединения – потенциальные канцерогены. Но….
Слайд 38Оксид хлора Cl2O6
Оксид Cl2O6 – красная маслянистая жидкость, взрывается при
соприкосновении с органикой
При -70оС – ионное смешанно-валентное соединение [ClO2]+[ClO4]-
В газовой
фазе есть равновесие димер/мономер
Cl2O6 + H2O = HClO3 + HClO4
Получение:
2ClO2 + 2O3 = Cl2O6 +2O2
2NaClO3(тв) + F2(г) = 2NaF(тв) + Cl2O6
Слайд 39Оксид хлора (VII), хлорный ангидрид Cl2O7
Бесцветная маслянистая жидкость, наиболее устойчив
среди оксидов хлора, но взрывает при соприкосновении с органикой, при
ударе, при нагревании
Cl2O7 + H2O = 2HClO4
Строение: газ и твердое
4HClO4 + P4O10 = 2Cl2O7 +4HPO3
НИКОГДА НЕ ДЕЛАЙТЕ ЭТУ РЕАКЦИЮ!!!
Слайд 40Оксиды брома
Br2O – красно-коричневая жидкость, разлагается выше -40оС
Получение
HgO(тв) + Br2(г)
= Br2O + HgBr2
Br2O + 2NaOH(раствор) = 2NaOBr +H2O
Br2O3 –
изучен мало, оранжевые кристаллы, разлагается выше -40оС, взрывает
Строение [Br]+[BrO3]-
Получение
O3 + Br2 = Br2O3 (в растворе CFCl3)
Слайд 41Оксиды брома
BrO2 – желтое кристаллическое вещество, разлагается выше -40оС
2 BrO2
= Br2 + 2O2 (медленное нагревание)
Строение твердого [Br]+[BrO4]-
6BrO2 + 6OH-
= 5BrO3- + Br- +3H2O
Получение Br2(ж) + 2O2(ж) = 2BrO2 (в тлеющем разряде)
Br2 + 4O3 = 2BrO2 + 4O2
(–78°С, CF3Cl)
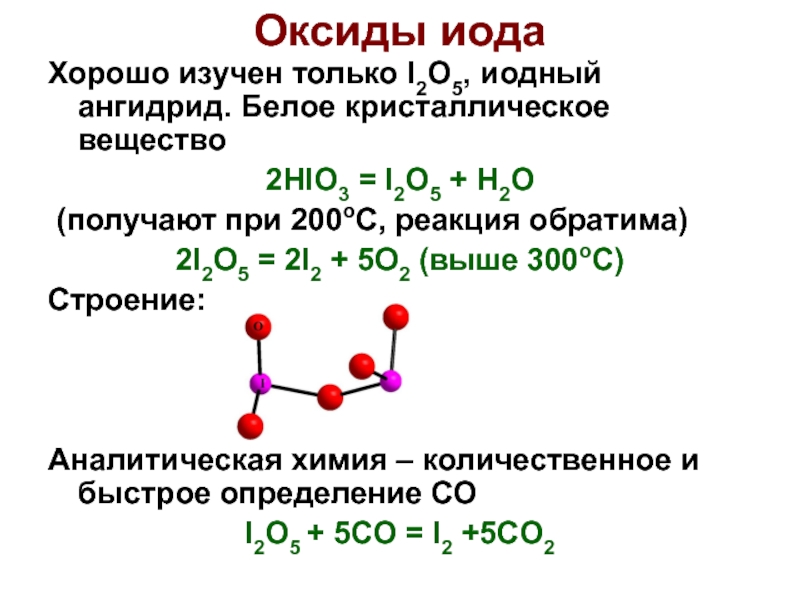
Слайд 42Хорошо изучен только I2O5, иодный ангидрид. Белое кристаллическое вещество
2HIO3 =
I2O5 + H2O
(получают при 200оС, реакция обратима)
2I2O5 = 2I2
+ 5O2 (выше 300оС)
Строение:
Аналитическая химия – количественное и быстрое определение СО
I2O5 + 5CO = I2 +5CO2
Оксиды иода