Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ГЕНЕТИКА МИКРООРГАНИЗМОВ
Содержание
- 1. ГЕНЕТИКА МИКРООРГАНИЗМОВ
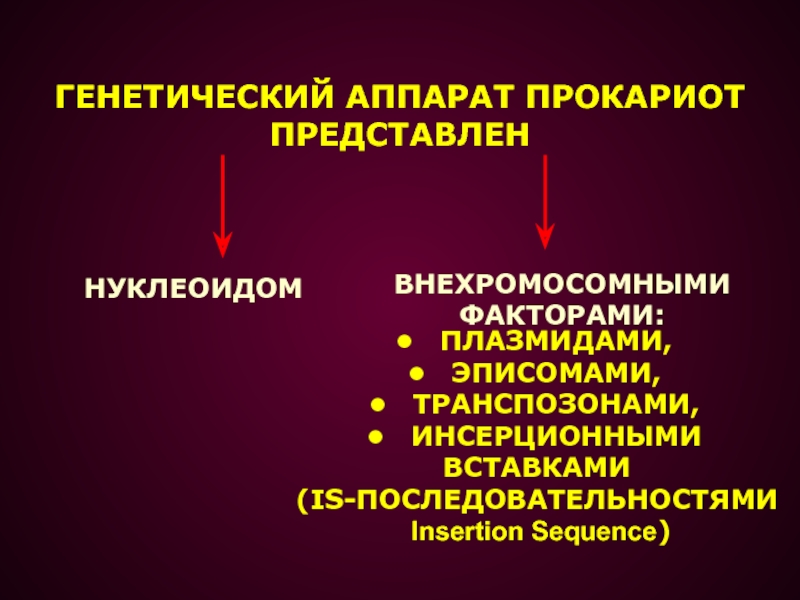
- 2. ГЕНЕТИЧЕСКИЙ АППАРАТ ПРОКАРИОТ ПРЕДСТАВЛЕН НУКЛЕОИДОМ ПЛАЗМИДАМИ, ЭПИСОМАМИ, ТРАНСПОЗОНАМИ, ИНСЕРЦИОННЫМИ ВСТАВКАМИ (IS-ПОСЛЕДОВАТЕЛЬНОСТЯМИ Insertion Sequence)ВНЕХРОМОСОМНЫМИФАКТОРАМИ:
- 3. ПЛАЗМИДЫ - ВНЕХРОМОСОМНЫЕ ГЕНЕТИЧЕСКИЕ СТРУКТУРЫ БАКТЕРИЙ.небольшие молекулы
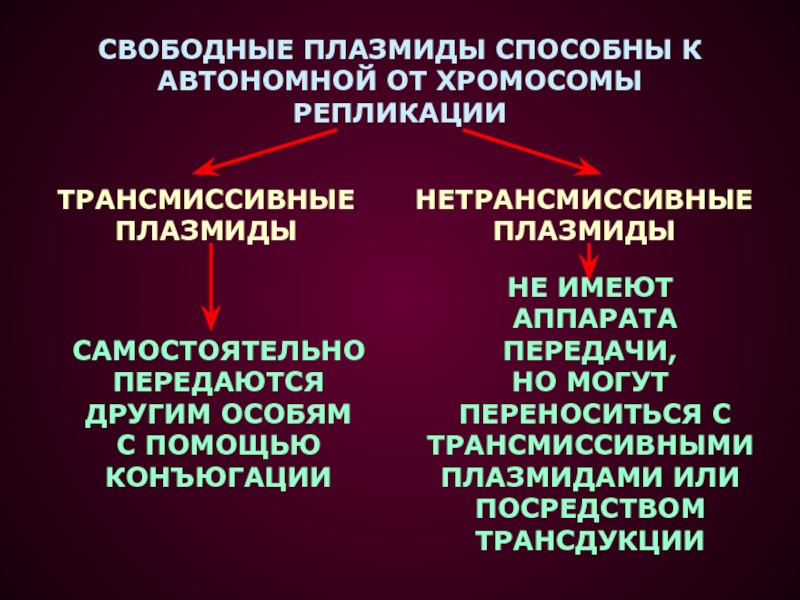
- 4. СВОБОДНЫЕ ПЛАЗМИДЫ СПОСОБНЫ К АВТОНОМНОЙ ОТ ХРОМОСОМЫ
- 5. ПРИОБРЕТЕНИЕ ИЛИ УТРАТА ПЛАЗМИДЫ ПРИВОДИТ К ПРИОБРЕТЕНИЮ
- 6. R-ПЛАЗМИДА (ФАКТОР РЕЗИСТЕНТНОСТИ) - ДЕТЕРМИНИРОВАНИЕ СИНТЕЗА ФЕРМЕНТОВ,
- 7. COL –ПЛАЗМИДЫ - КОНТРОЛИРУЮТ СИНТЕЗ БАКТЕРИОЦИНОВ, КОТОРЫЕ
- 8. F-ПЛАЗМИДА (ФАКТОР ФЕРТИЛЬНОСТИ) – КОНТРОЛИРУЕТ СИНТЕЗ СЕКС-ПИЛИ,
- 9. ИНСЕРЦИОННЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ (IS) – линейные фрагменты двухцепочечной
- 10. ТРАНСПОЗОНЫ – ПОСЛЕДОВАТЕЛЬНОСТИ ДНК (более 2000 п.н.),
- 11. ТРАНСПОЗОНЫ -КОНТРОЛИРУЮТ РЕЗИСТЕНТНОСТЬК АНТИБИОТИКАМ, ИОНАМ ТЯЖЕЛЫХ МЕТАЛЛОВ, СПОСОБНОСТЬ К КАТАБОЛИЗМУЛАКТОЗЫ, РАФФИНОЗЫ, ДЕГРАДАЦИИ ТОЛУОЛА, СИНТЕЗ ЭНТЕРОТОКСИНОВ.
- 12. ОСНОВНАЯ ФУНКЦИЯ ГЕНЕТИЧЕСКОГО АППАРАТА – КОНТРОЛЬНАСЛЕДСТВЕННОСТИ И ИЗМЕНЧИВОСТИ
- 13. ИЗМЕНЧИВОСТЬ - СВОЙСТВО ОРГАНИЗМОВ ПРИОБРЕТАТЬ НОВЫЕ ИЛИ
- 14. В ТО ЖЕ ВРЕМЯ НЕКОТОРЫЕ ВИДЫБАКТЕРИЙ (НАПРИМЕР,
- 15. ГЕНОТИПИЧЕСКАЯ ИЗМЕНЧИВОСТЬ ОБЕСПЕЧИВАЕТСЯМУТАЦИЯМИГЕНЕТИЧЕСКИМИРЕКОМБИНАЦИЯМИ
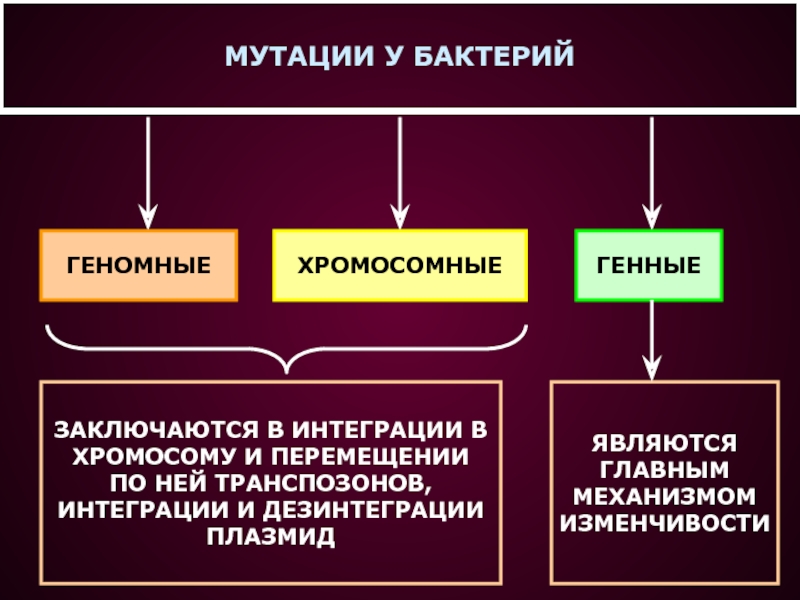
- 16. МУТАЦИИ У БАКТЕРИЙГЕНОМНЫЕХРОМОСОМНЫЕГЕННЫЕЗАКЛЮЧАЮТСЯ В ИНТЕГРАЦИИ В ХРОМОСОМУ И ПЕРЕМЕЩЕНИИ ПО НЕЙ ТРАНСПОЗОНОВ, ИНТЕГРАЦИИ И ДЕЗИНТЕГРАЦИИ ПЛАЗМИДЯВЛЯЮТСЯГЛАВНЫММЕХАНИЗМОМИЗМЕНЧИВОСТИ
- 17. СПОНТАННЫЕ МУТАЦИИ ОБУСЛОВЛЕНЫ ОШИБКАМИ РЕПЛИКАЦИИ ГЕНОМА В
- 18. ИНДУЦИРОВАННЫЕ МУТАЦИИ ПОЯВЛЯЮТСЯВ РЕЗУЛЬТАТЕ ДЕЙСТВИЯ МУТАГЕНОВ, К КОТОРЫМ ОТНОСЯТСЯ УФ-излучение, ИОНИЗИРУЮЩЕЕ ИЗЛУЧЕНИЕ, ХИМИЧЕСКИЕ ВЕЩЕСТВА,ВЕЩЕСТВА МУТАГЕНЫ, КАНЦЕРОГЕНЫ.
- 19. СУДЬБА МУТАНТОВ ОПРЕДЕЛЯЕТСЯ ИХ ЖИЗНЕСПОСОБНОСТЬЮ И ОТБОРОМ.
- 20. ГЕНЕТИЧЕСКИЕ РЕКОМБИНАЦИИИ – ПРОЦЕСС ОБРАЗОВАНИЯ ГЕНОМОВ, СОДЕРЖАЩИХ
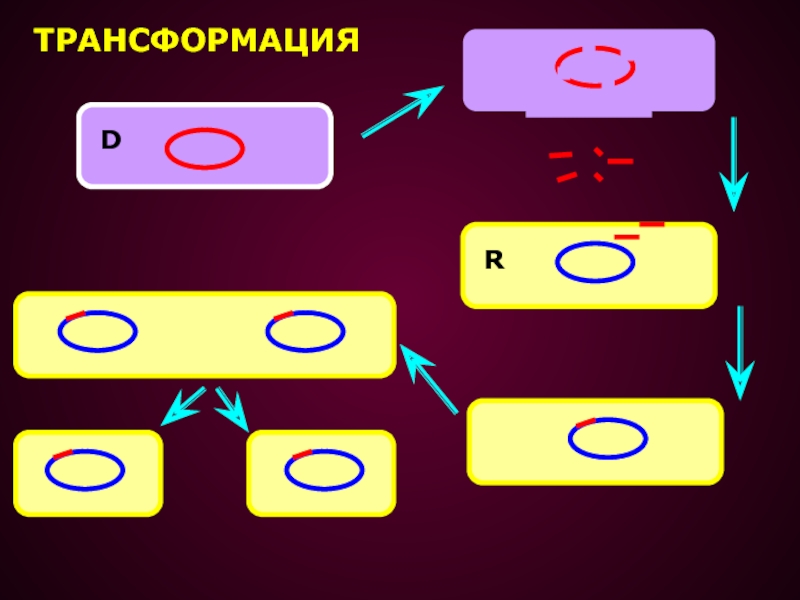
- 21. ТРАНСФОРМАЦИЯ – ПРОЦЕСС ПЕРЕНОСА ГЕНЕТИЧЕСКОГО МАТЕРИАЛА, ПРИ
- 22. СПОСОБНОСТЬ ДНК ПРОНИКАТЬ В КЛЕТКУ РЕЦИПИЕНТА ЗАВИСИТ
- 23. Процесс трансформации включает несколько фаз:адсорбция ДНК-донора на
- 24. ТРАНСФОРМАЦИЯDR
- 25. ТРАНСДУКЦИЕЙ НАЗЫВАЕТСЯ ПЕРЕНОС ГЕНЕТИЧЕСКОГО МАТЕРИАЛА ИЗ ОДНОЙ
- 26. Трансдукция оказывается возможной, если в процессе размножения
- 27. ТРАНСДУКЦИЯDR
- 28. КОНЪЮГАЦИЯ – ПРОЦЕСС ПЕРЕДАЧИ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА ОТ
- 29. ПРИ КОНЪЮГАЦИИ F+ КЛЕТКА ПРИСОЕДИНЯЕТСЯ К
- 30. КОНЪЮГАЦИЯDR
- 31. КОНЪЮГАЦИЯ У БАКТЕРИЙ
- 32. МЕТОДЫ ИЗУЧЕНИЯ ГЕНОМА БАКТЕРИЙОСНОВАНЫ НА ПРИМЕНЕНИИ КОМПЛЕКСАГЕНЕТИЧЕСКИХ, БИОХИМИЧЕСКИХ МЕТОДОВ, А ТАКЖЕ КУЛЬТУРАЛЬНОГО МЕТОДА
- 33. ПЦР – метод амплификации, т.е. получения большого
- 34. ПЦР широко используется для ранней диагностики ВИЧ-инфекции,
- 35. высокий показатель чувствительности и специфичности (до 1000
- 36. Реакционная смесь для получения нужной ДНК содержит:
- 37. Цикл ПЦР включает 3 этапа: Денатурация
- 38. Слайд 38
- 39. Слайд 39
- 40. Эти этапы повторяются многократно в приборе –
- 41. THERMOCYCLER ДЛЯ ПОСТАНОВКИ ПЦР
- 42. Современный амплификатор Corbett
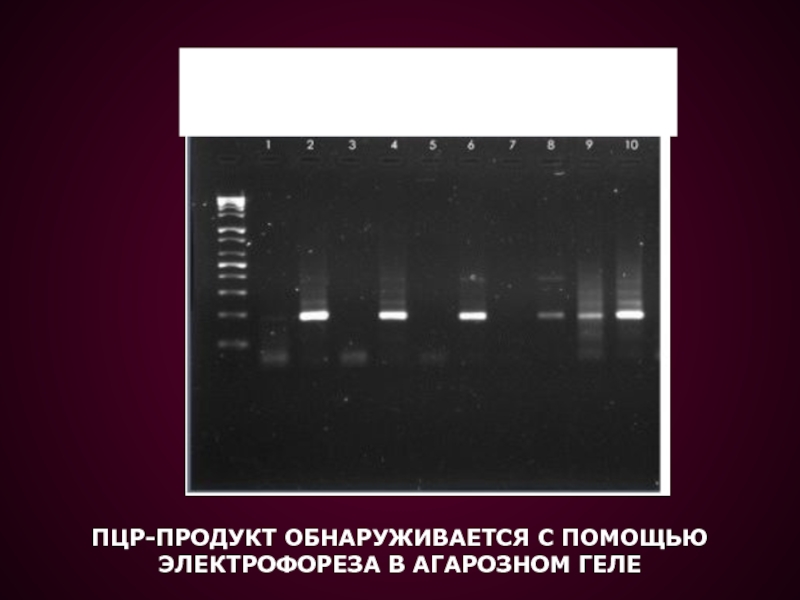
- 43. Амплифицированный фрагмент выявляют в процессе электрофореза в агарозном геле
- 44. ПЦР-ПРОДУКТ ОБНАРУЖИВАЕТСЯ С ПОМОЩЬЮЭЛЕКТРОФОРЕЗА В АГАРОЗНОМ ГЕЛЕ
- 45. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3ПЛАЗМИДЫ - ВНЕХРОМОСОМНЫЕ ГЕНЕТИЧЕСКИЕ
СТРУКТУРЫ БАКТЕРИЙ.
небольшие молекулы ДНК,
способные к автономной
репликации.
ПЛАЗМИДЫ ЛОКАЛИЗУЮТСЯ В ЦИТОПЛАЗМЕ
БАКТЕРИИ
В СВОБОДНОМ ВИДЕ –
ПЛАЗМИДА
В СВЯЗАННОМ С
НУКЛЕОИДОМ
ВИДЕ – ЭПИСОМА
Слайд 4СВОБОДНЫЕ ПЛАЗМИДЫ СПОСОБНЫ К
АВТОНОМНОЙ ОТ ХРОМОСОМЫ
РЕПЛИКАЦИИ
ТРАНСМИССИВНЫЕ
ПЛАЗМИДЫ
НЕТРАНСМИССИВНЫЕ
ПЛАЗМИДЫ
САМОСТОЯТЕЛЬНО
ПЕРЕДАЮТСЯ
ДРУГИМ
ОСОБЯМ
С ПОМОЩЬЮ
КОНЪЮГАЦИИ
НЕ ИМЕЮТ
АППАРАТА ПЕРЕДАЧИ,
НО МОГУТ
ПЕРЕНОСИТЬСЯ С ТРАНСМИССИВНЫМИ
ПЛАЗМИДАМИ ИЛИ
ПОСРЕДСТВОМ
ТРАНСДУКЦИИ
Слайд 5ПРИОБРЕТЕНИЕ ИЛИ УТРАТА ПЛАЗМИДЫ
ПРИВОДИТ К ПРИОБРЕТЕНИЮ ИЛИ УТРАТЕ
ОДНОГО
ИЛИ НЕСКОЛЬКИХ ПРИЗНАКОВ,
В НЕКОТОРЫХ КЛЕТКАХ БАКТЕРИЙ МОЖЕТ
СОДЕРЖАТЬСЯ
НЕСКОЛЬКО ТИПОВ ПЛАЗМИД РАЗЛИЧАЮТ НЕСКОЛЬКО ВИДОВ ПЛАЗМИД:
R-ПЛАЗМИДА
COL –ПЛАЗМИДА
F-ПЛАЗМИДА
ПЛАЗМИДЫ ПАТОГЕННОСТИ
ПЛАЗМИДЫ БИОДЕГРАДАЦИИ
Слайд 6R-ПЛАЗМИДА (ФАКТОР РЕЗИСТЕНТНОСТИ) -
ДЕТЕРМИНИРОВАНИЕ СИНТЕЗА ФЕРМЕНТОВ,
РАСЩЕПЛЯЮЩИХ АНТИБИОТИКИ,
ТОРМОЖЕНИЕ
ПЕРЕНОСА
АНТИБИОТИКА ЧЕРЕЗ КЛЕТОЧНЫЕ МЕМБРАНЫ.
СОСТОИТ ИЗ 2 ОБЛАСТЕЙ: 1
- ЭТО ГЕНЫ, КОНТРОЛИРУЮЩИЕ РЕЗИСТЕНТНОСТЬ,
2 - ГЕНЫ, КОНТРОЛИРУЮЩИЕ
ПЕРЕНОС ПЛАЗМИДЫ В
ДРУГУЮ КЛЕТКУ.
ПЕРЕДАЧА ПЛАЗМИДЫ
ВЫХОДИТ ЗА ПРЕДЕЛЫ ВИДА.
Слайд 7COL –ПЛАЗМИДЫ - КОНТРОЛИРУЮТ СИНТЕЗ
БАКТЕРИОЦИНОВ, КОТОРЫЕ АКТИВНЫ
В ОТНОШЕНИИ
БЛИЗКОРОДСТВЕННЫХ
ВИДОВ БАКТЕРИЙ.
ХАРАКТЕРНО АВТОНОМНОЕ СОСТОЯНИЕ,
ПЕРЕДАЁТСЯ ПРИ КОНЪЮГАЦИИ
БЕЗ СЦЕПЛЕНИЯ
С ХРОМОСОМОЙ ПЛАЗМИДЫ ПАТОГЕННОСТИ -
КОНТРОЛЬ СИНТЕЗА
АДГЕЗИНОВ, ИНВАЗИНОВ, ТОКСИНОВ
ПЛАЗМИДЫ БИОДЕГРАДАЦИИ –
КОНТРОЛЬ УТИЛИЗАЦИИ НЕКОТОРЫХ
ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Слайд 8F-ПЛАЗМИДА
(ФАКТОР ФЕРТИЛЬНОСТИ) –
КОНТРОЛИРУЕТ СИНТЕЗ СЕКС-ПИЛИ,
КОНЪЮГАЦИЮ И ПЕРЕНОС
ГЕНОВ
ХРОМОСОМЫ И НЕТРАНСМИССИВНЫХ
ПЛАЗМИД ОТ ДОНОРА РЕЦИПИЕНТУ
МОЖЕТ НАХОДИТЬСЯ
КАК В АВТОНОМНОМ СОСТОЯНИИ, ТАК И В
СОСТОЯНИИ ИНТЕГРАЦИИ С ХРОМОСОМОЙ.
БАКТЕРИИ, ОБЛАДАЮЩИЕ F-ПЛАЗМИДОЙ,
ЯВЛЯЮТСЯ ДОНОРАМИ ГЕНЕТИЧЕСКОЙ
ИНФОРМАЦИИ И ОТНОСЯТСЯ К ТАК
НАЗЫВАЕМЫМ Hfr-ШТАММАМ
(High Frequency of Recombination)
Слайд 9ИНСЕРЦИОННЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ (IS) –
линейные фрагменты
двухцепочечной ДНК (от 200
до 2000 п. н.),
содержат только гены tnp,
кодирующие синтез фермента
транспозазы,необходимого для их
переМещения (транспозиции).
СПОСОБНЫ К ПЕРЕМЕЩЕНИЮ ИЗ
ХРОМОСОМНОГО ЛОКУСА В ДРУГОЙ,
ИЗ ХРОМОСОМЫ НА ПЛАЗМИДУ.
СПОНТАННОЕ ПЕРЕМЕЩЕНИЕ
ПОСЛЕДОВАТЕЛЬНОСТЕЙ
МОЖЕТ ВЫЗЫВАТЬ МУТАЦИИ В ИСХОДНОМ
ИЛИ НОВОМ УЧАСТКЕ ВНЕДРЕНИЯ.
Слайд 10ТРАНСПОЗОНЫ –
ПОСЛЕДОВАТЕЛЬНОСТИ ДНК (более 2000 п.н.),
СОДЕРЖАТ КРОМЕ ГЕНОВ,
ОТВЕТСТВЕННЫХ ЗА
ТРАНСПОЗИЦИЮ, СТРУКТУРНЫЕ ГЕНЫ,
ОПРЕДЕЛЯЮЩИЕ ФУНКЦИИ, ОТВЕЧАЮЩИЕ ЗА
ПРОЯВЛЕНИЕ
КАКОГО-ЛИБО ФЕНОТИПА.И
ОГРАНИЧЕННЫЕ С ОБЕИХ
СТОРОН ИДЕНТИЧНЫМИ
IS-ПОСЛЕДОВАТЕЛЬНОСТЯМИ, КОТОРЫЕ
ОБЕСПЕЧИВАЮТ ТРАНСПОЗОНАМ СПОСОБНОСТЬ
ПЕРЕМЕЩАТЬСЯ ИЗ ОДНОГО ЛОКУСА ХРОМОСОМЫ
В ДРУГИЕ, С ХРОМОСОМЫ НА ПЛАЗМИДЫ
И НАОБОРОТ
Слайд 11ТРАНСПОЗОНЫ -
КОНТРОЛИРУЮТ РЕЗИСТЕНТНОСТЬ
К АНТИБИОТИКАМ, ИОНАМ ТЯЖЕЛЫХ МЕТАЛЛОВ,
СПОСОБНОСТЬ К КАТАБОЛИЗМУ
ЛАКТОЗЫ,
РАФФИНОЗЫ,
ДЕГРАДАЦИИ ТОЛУОЛА,
СИНТЕЗ ЭНТЕРОТОКСИНОВ.
Слайд 13
ИЗМЕНЧИВОСТЬ - СВОЙСТВО ОРГАНИЗМОВ
ПРИОБРЕТАТЬ НОВЫЕ ИЛИ УТРАЧИВАТЬ
ИСХОДНЫЕ ПРИЗНАКИ.
ИЗМЕНЧИВОСТЬ
У БОЛЬШИНСТВА М/О
ВЫРАЖЕНА В БОЛЬШЕЙ
СТЕПЕНИ, ЧЕМ У ВЫСШИХ
ОРГАНИЗМОВ, ЧТО СВЯЗАНО:
С КОРОТКИМ ПЕРИОДОМ ГЕНЕРАЦИИ,
БОЛЬШЕЙ ЧАСТОТОЙ МУТАЦИЙ,
ГЕНЕТИЧЕСКИМ ОБМЕНОМ,
ВЫХОДЯЩИМ ЗА ПРЕДЕЛЫ ВИДА.
Слайд 14
В ТО ЖЕ ВРЕМЯ НЕКОТОРЫЕ ВИДЫ
БАКТЕРИЙ
(НАПРИМЕР, АРХЕБАКТЕРИИ)
И ОТДЕЛЬНЫЕ
ИХ ПРИЗНАКИ
(ФОРМА, РАЗМЕРЫ, СТРУКТУРА КЛЕТКИ,
СПОСОБЫ ПОЛУЧЕНИЯ ЭНЕРГИИ И ПИТАНИЯ,
ПЕРИОД ГЕНЕРАЦИИ И ДР.)
МАЛО ИЗМЕНИЛИСЬ
В ПРОЦЕССЕ ЭВОЛЮЦИИ
Слайд 16МУТАЦИИ У БАКТЕРИЙ
ГЕНОМНЫЕ
ХРОМОСОМНЫЕ
ГЕННЫЕ
ЗАКЛЮЧАЮТСЯ В ИНТЕГРАЦИИ В
ХРОМОСОМУ И ПЕРЕМЕЩЕНИИ
ПО
НЕЙ ТРАНСПОЗОНОВ,
ИНТЕГРАЦИИ И ДЕЗИНТЕГРАЦИИ
ПЛАЗМИД
ЯВЛЯЮТСЯ
ГЛАВНЫМ
МЕХАНИЗМОМ
ИЗМЕНЧИВОСТИ
Слайд 17СПОНТАННЫЕ МУТАЦИИ ОБУСЛОВЛЕНЫ
ОШИБКАМИ РЕПЛИКАЦИИ ГЕНОМА В ПРОЦЕССЕ
ДЕЛЕНИЯ ОСОБЕЙ
И ОШИБКАМИ РЕПАРАЦИИ
ПОВРЕЖДЕННОГО ГЕНОМА,
А ТАКЖЕ ДЕЙСТВИЕМ СВОБОДНЫХ РАДИКАЛОВ.
ЧАСТОТА ИХ ПОСТОЯННА И НИЗКА (10 - 10 ).
В СВЯЗИ С КОРОТКИМ ПЕРИОДОМ ГЕНЕРАЦИИ
И МНОЖЕСТВЕННОСТЬЮ ПОПУЛЯЦИИ
МУТАЦИИ ЭТОГО ТИПА МНОГОЧИСЛЕННЫ
-7
-12
Слайд 18ИНДУЦИРОВАННЫЕ МУТАЦИИ ПОЯВЛЯЮТСЯ
В РЕЗУЛЬТАТЕ ДЕЙСТВИЯ МУТАГЕНОВ,
К КОТОРЫМ ОТНОСЯТСЯ
УФ-излучение,
ИОНИЗИРУЮЩЕЕ ИЗЛУЧЕНИЕ,
ХИМИЧЕСКИЕ ВЕЩЕСТВА,
ВЕЩЕСТВА МУТАГЕНЫ,
КАНЦЕРОГЕНЫ.
Слайд 19СУДЬБА МУТАНТОВ ОПРЕДЕЛЯЕТСЯ ИХ
ЖИЗНЕСПОСОБНОСТЬЮ И ОТБОРОМ.
В СЕЛЕКТИВНОЙ СРЕДЕ
МУТАНТЫ МОГУТ
ПРИОБРЕСТИ ДОМИНИРУЮЩЕЕ ПОЛОЖЕНИЕ В
ПОПУЛЯЦИИ,
В НЕСЕЛЕКТИВНОЙ СРЕДЕ
ОНИ ПОГИБАЮТ ИЛИ ЗАНИМАЮТ
НИЗКОЧАСТОТНОЕ ПОЛОЖЕНИЕ.
МНОГОЧИСЛЕННЫЕ ПОПУЛЯЦИИ БАКТЕРИЙ
ОБЫЧНО СОДЕРЖАТ БОЛЬШОЕ КОЛИЧЕСТВО
САМЫХ РАЗНЫХ МУТАНТОВ,
ЧТО ОПРЕДЕЛЯЕТ ИХ ВЫРАЖЕННЫЙ
ПОЛИМОРФИЗМ.
Слайд 20ГЕНЕТИЧЕСКИЕ РЕКОМБИНАЦИИИ –
ПРОЦЕСС ОБРАЗОВАНИЯ ГЕНОМОВ,
СОДЕРЖАЩИХ ГЕНЕТИЧЕСКИЙ
МАТЕРИАЛ ОТ
ДВУХ РОДИТЕЛЬСКИХ
ФОРМ – БАКТЕРИИ-ДОНОРА (D) И
БАКТЕРИИ-РЕЦИПИЕНТА (R)
ТРАНСФОРМАЦИЯ
ТРАНСДУКЦИЯ
КОНЪЮГАЦИЯ
Слайд 21ТРАНСФОРМАЦИЯ – ПРОЦЕСС ПЕРЕНОСА ГЕНЕТИЧЕСКОГО МАТЕРИАЛА, ПРИ КОТОРОМ КЛЕТКА РЕЦИПИЕНТ
ПОГЛОЩАЕТ ГЕНЕТИЧЕСКИЙ МАТЕРИАЛ В ФОРМЕ СВОБОДНОЙ ДНК ОТ РАЗРУШЕННОЙ КЛЕТКИ,
ПРИ ЭТОМ НЕ ТРЕБУЕТСЯ НЕПОСРЕДСТВЕННОГО КОНТАКТА МЕЖДУ ДВУМЯ КЛЕТКАМИ.Явление трансформации открыто Гриффитсом в 1928 г.: если в организм мыши ввести убитые нагреванием капсульные пневмококки, а потом живые, не образующие капсул, то последние приобретают способность образовывать капсулы, то есть подвергаются трансформации.
Слайд 22СПОСОБНОСТЬ ДНК ПРОНИКАТЬ В КЛЕТКУ РЕЦИПИЕНТА ЗАВИСИТ
ОТ «СОСТОЯНИЯ»ДНК (ФРАГМЕНТИРОВАННАЯ
МОЛЕКУЛА ДНК)
И ОТ ФИЗИОЛОГИЧЕСКОГО СОСТОЯНИЯ КЛЕТКИ-РЕЦИПИЕНТА
КЛЕТКИ, СПОСОБНЫЕ ВОСПРИНИМАТЬ ДОНОРНУЮ
ДНК, НАЗЫВАЮТСЯ КОМПЕТЕНТНЫМИ В СОСТОЯНИИ КОМПЕТЕНТНОСТИ КЛЕТОЧНАЯ СТЕНКА БАКТЕРИЙ СТАНОВИТСЯ ПРОНИЦАЕМОЙ ДЛЯ ФРАГМЕНТОВ ДНК
Слайд 23Процесс трансформации включает несколько фаз:
адсорбция ДНК-донора на клетке-реципиенте
проникновение ДНК внутрь
клетки-реципиента
соединение ДНК с гомологичным участком хромосомы реципиента с последующей рекомбинацией
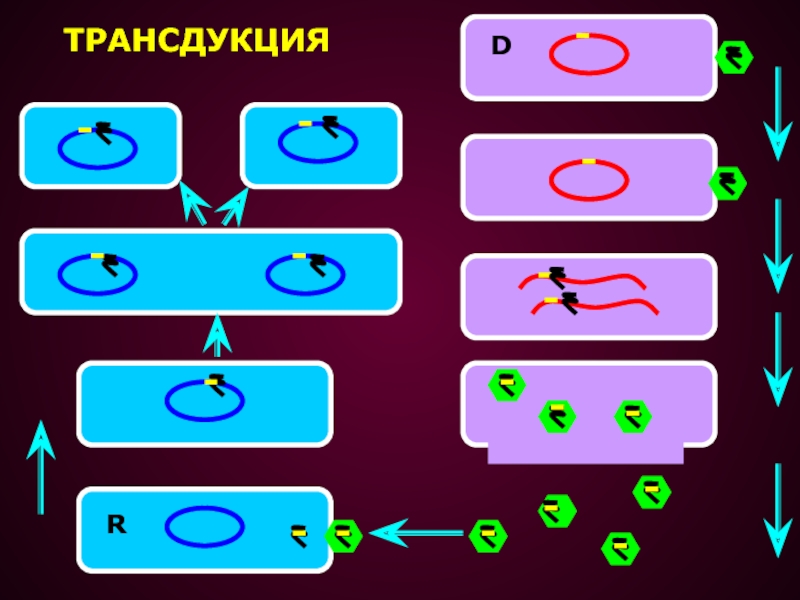
Слайд 25ТРАНСДУКЦИЕЙ НАЗЫВАЕТСЯ ПЕРЕНОС ГЕНЕТИЧЕСКОГО МАТЕРИАЛА ИЗ ОДНОЙ КЛЕТКИ В ДРУГУЮ
С ПОМОЩЬЮ БАКТЕРИОФАГОВ
Этот способ генетического обмена был открыт в
1952 г. Зиндером и Ледербергом Слайд 26Трансдукция оказывается возможной, если в процессе размножения фага одна из
частиц случайно захватывает фрагмент бактериальной хромосомы.
Когда такая фаговая частица заражает
бактерию реципиент, бактериальная ДНК проникает в клетку вместе с фаговой ДНК.Между трансдуцированной бактериальной ДНК и гомологичным участком бактериальной хромосомы может произойти обмен и, возникают рекомбинанты, несущие небольшую часть генетического материала клетки-донора.
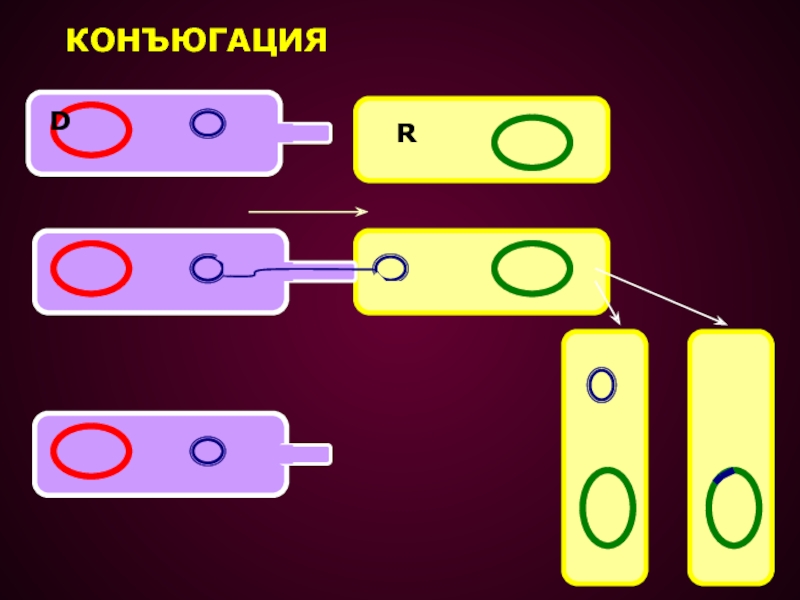
Слайд 28КОНЪЮГАЦИЯ – ПРОЦЕСС ПЕРЕДАЧИ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА ОТ ОДНОЙ КЛЕТКИ К
ДРУГОЙ ПРИ ИХ НЕПОСРЕДСТВЕННОМ КОНТАКТЕ,
ПРИ ЭТОМ ОСУЩЕСТВЛЯЕТСЯ НАПРАВЛЕННЫЙ ПЕРЕНОС
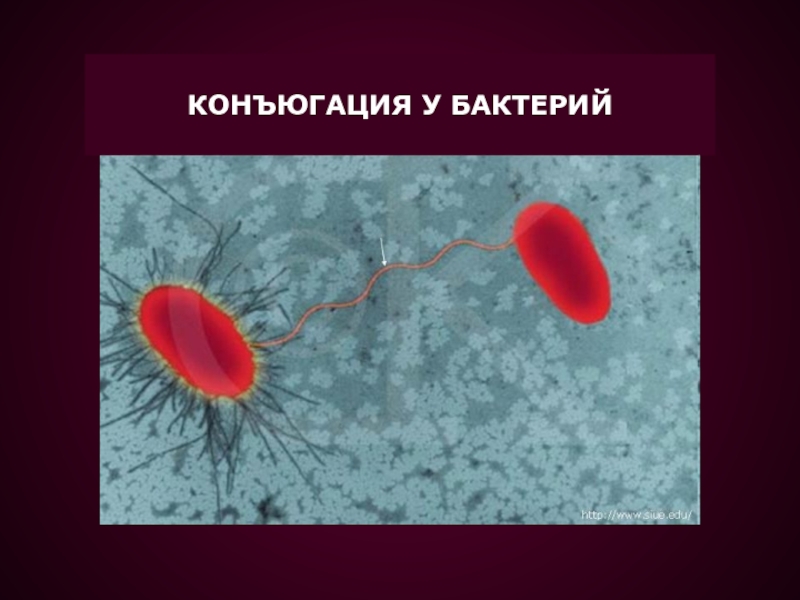
ГЕНЕТИЧЕСКОГО МАТЕРИАЛА ОТ КЛЕТКИ ДОНОРА В КЛЕТКУ РЕЦИПИЕНТА.Конъюгация у бактерий была открыта Ледербергом и Татумом в 1946 г.
Слайд 29
ПРИ КОНЪЮГАЦИИ F+ КЛЕТКА ПРИСОЕДИНЯЕТСЯ К F- КЛЕТКЕ ПРИ
ПОМОЩИ F ПИЛИ
F ПЛАЗМИДА РЕПЛИЦИРУЕТСЯ ПО МЕХАНИЗМУ КАТЯЩЕГОСЯ КОЛЬЦА
И ОДНА ЦЕПЬ ДНК ПЕРЕДАЕТСЯ ЧЕРЕЗ F-ПИЛИ В РЕЦИПИЕНТНУЮ КЛЕТКУ НА ЭТОЙ ЦЕПИ В РЕЦИПИЕНТНОЙ КЛЕТКЕ СИНТЕЗИРУЕТСЯ ДРУГАЯ ЦЕПЬ ДНК И, ТАКИМ ОБРАЗОМ, В РЕЦИПИЕНТНОЙ КЛЕТКЕ ПОЯВЛЯЕТСЯ ТОЧНО ТАКАЯ ЖЕ ПЛАЗМИДА КАК В КЛЕТКЕ-ДОНОРЕ.
В РЕЗУЛЬТАТЕ КОНЪЮГАЦИИ ОБРАЗУЕТСЯ ДВЕ F+ КЛЕТКИ
Слайд 32МЕТОДЫ ИЗУЧЕНИЯ ГЕНОМА БАКТЕРИЙ
ОСНОВАНЫ НА ПРИМЕНЕНИИ КОМПЛЕКСА
ГЕНЕТИЧЕСКИХ, БИОХИМИЧЕСКИХ МЕТОДОВ,
А
ТАКЖЕ КУЛЬТУРАЛЬНОГО МЕТОДА
Слайд 33ПЦР – метод амплификации,
т.е. получения большого числа копий
нужного
гена или его фрагмента в условиях in vitro
В 1983 году
Кэри Мюллис с сотрудниками разработал метод клонирования последовательностей ДНК in vitro.ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ
Слайд 34ПЦР широко используется для ранней диагностики ВИЧ-инфекции, вирусных гепатитов, клещевого
энцефалита, туберкулеза, венерических заболеваний и т.д.
ПЦР позволяет выявлять этиологию инфекции,
даже если в пробе содержится всего несколько молекул ДНК возбудителя. Слайд 35
высокий показатель чувствительности и специфичности (до 1000 м/о в 1
мл);
возможность одновременного выявления нескольких микроорганизмов в одной биологической пробе, в
отличие от бактериологических методов, где для разных возбудителей используются разные способы культивированиявозможность использования разнообразного клинического материала
Слайд 36Реакционная смесь для получения нужной ДНК содержит:
исследуемая ДНК-матрица,
субстраты
реакции-дезоксинуклеозидтрифосфаты (dATP, dCTP, dGTP и TTP)
2 праймера - искусственно синтезированные
короткие однонитевые ДНК (20-30 нуклеотидов), со свободным 3'-ОН-концом фермент - термостабильная Taq-полимераза
Буфер - растворы солей, содержащие ионы Mg2+
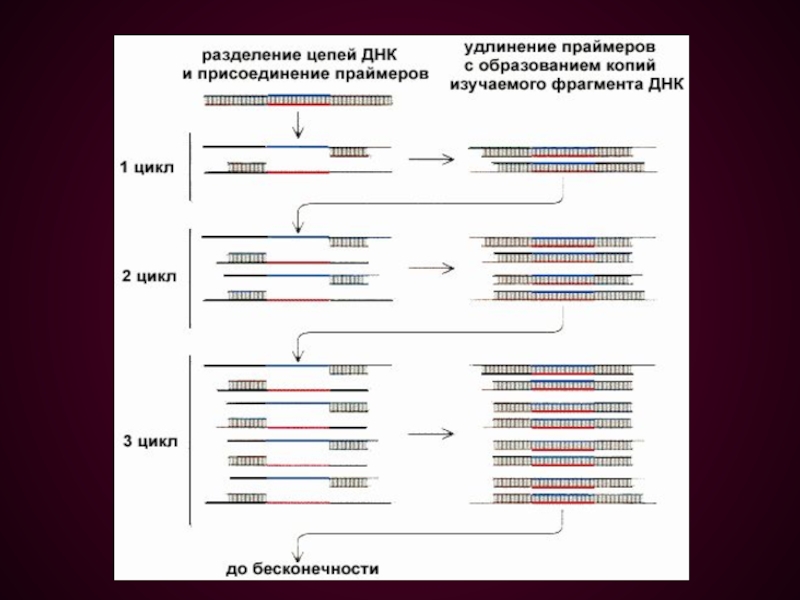
Слайд 37Цикл ПЦР включает 3 этапа:
Денатурация – исходная смесь
нагревается до 94°С, при этом нити ДНК расходятся;
Отжиг
– температура реакционной смеси снижается до 52°С и происходит комплементарное связывание праймеров с нитями матричной ДНК;Полимеризация, в ходе которой Taq-полимераза катализирует удлинение праймеров (с 3'-конца) и синтез новых цепей ДНК. Температура смеси 72°С.