Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гетерогенный катализ
Содержание
- 1. Гетерогенный катализ
- 2. Определение Гетерогенный катализ – каталитические реакции, идущие на
- 3. В промышленности применяют катализаторы:в виде цилиндров, гранул
- 4. Теории катализаИз-за очень малых концентраций нанесенного металла
- 5. КатализаторыДля повышения активности, термодинамической устойчивости, механической жесткости
- 6. ПромоторыПромоторы (активаторы), не имеют каталитические свойства, но
- 7. Для катализируемой металлическим никелем
- 8. Классы гетерогенных катализаторов
- 9. КатализМеталлическая платина (показана стрелками), стабили-зированная на носителе — оксиде алюминия
- 10. Адсорбционная теория гетерогенного катализа Термин адсорбция означает
- 11. Активные центрыДля объяснения особенностей гетерогенно-каталитических процессов Г.
- 12. Активные центрыАктивные центры – свободные участки поверхности,
- 13. Физическая адсобцияФизическая адсорбция протекает уже при низких
- 14. Химическая адсобцияХемосорбция представляет собой поверхностную химическую реакцию,
- 15. Химическая адсобцияЗначения энтальпии хемосорбции лежат в широком
- 16. Мультиплетная теория катализа А.А. БаландинаВ настоящее время
- 17. Теорию мультиплетов называют иногда теорией геометрического подобия
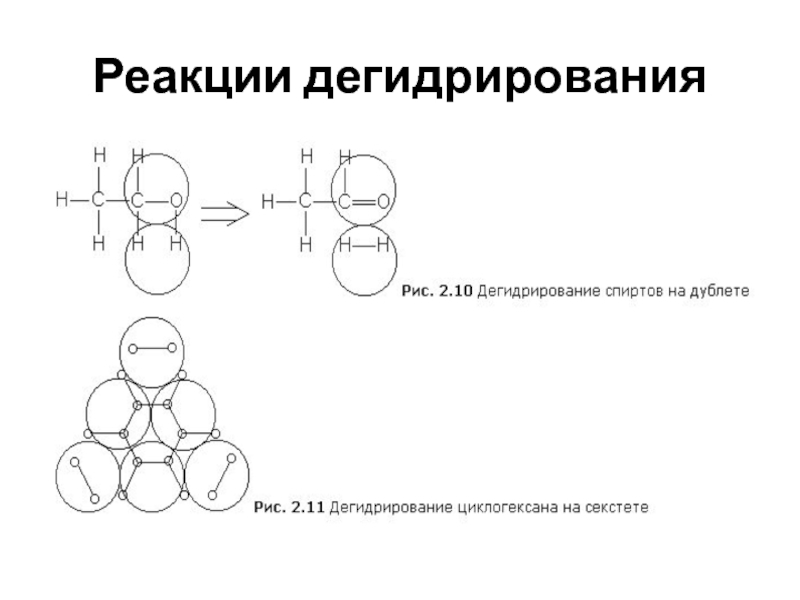
- 18. Реакции дегидрирования
- 19. Основные стадии гетерогенного катализаВ каждой гетерогенно-каталитической реакции
- 20. Стадии процесса2. Адсорбция. Реагирующие молекулы снача-ла адсорбируются
- 21. Полимолекулярная адсорбцияПри физической адсорбции, если энергии межмолекулярных
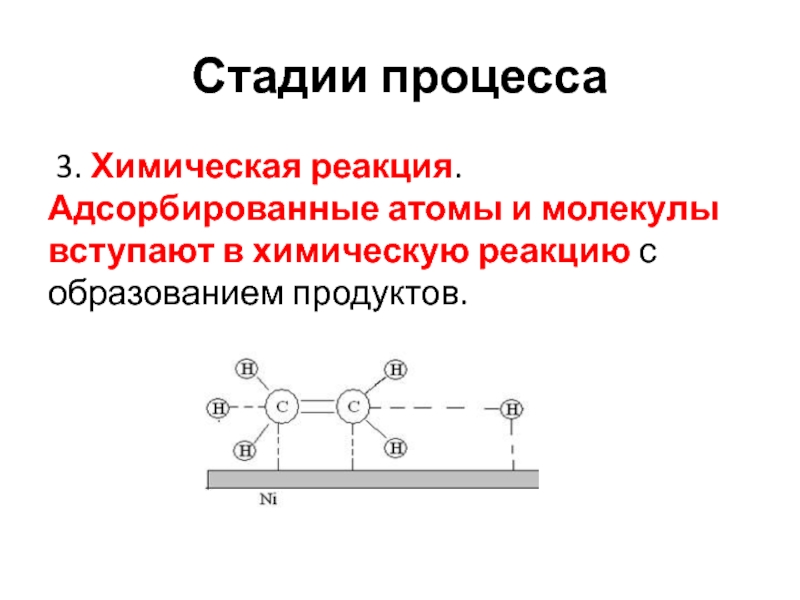
- 22. Стадии процесса 3. Химическая реакция. Адсорбированные атомы и молекулы вступают в химическую реакцию с образованием продуктов.
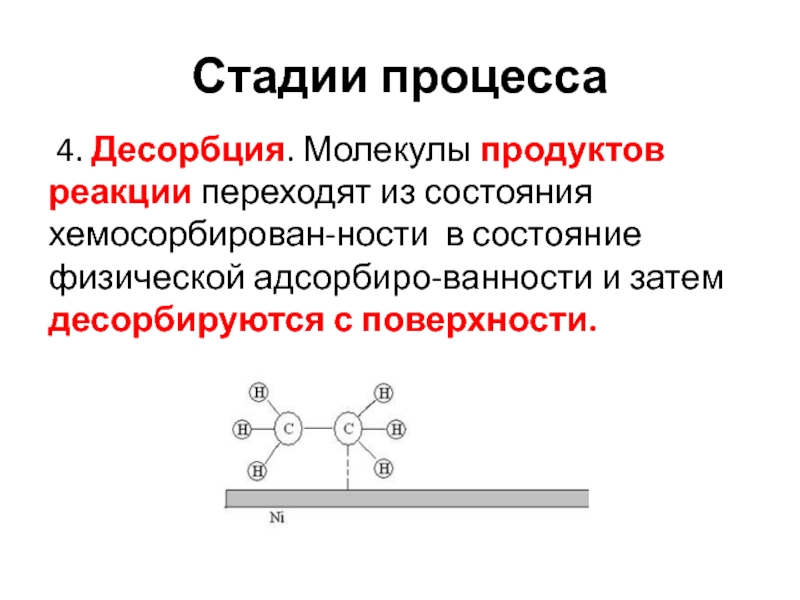
- 23. Стадии процесса 4. Десорбция. Молекулы продуктов реакции
- 24. Обратимость десорбцииВ связи с высокой экзотермичностью большинства
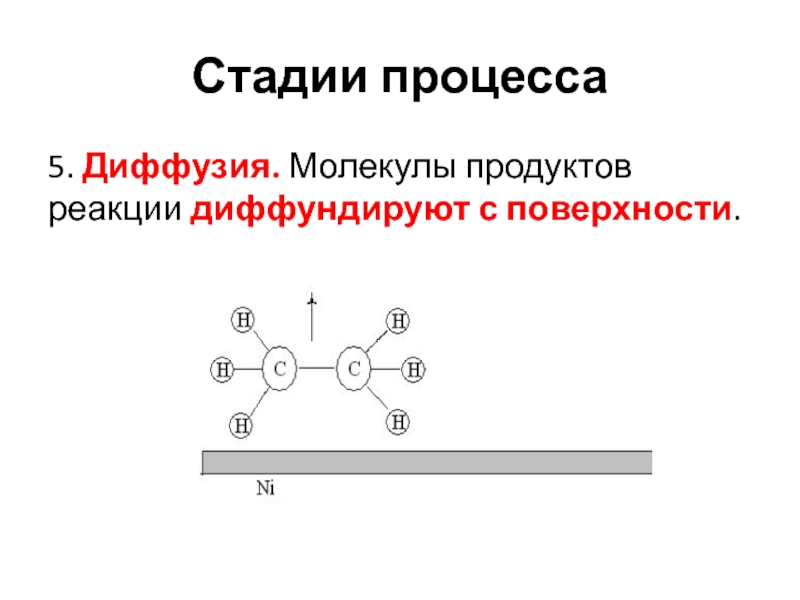
- 25. Стадии процесса5. Диффузия. Молекулы продуктов реакции диффундируют с поверхности.
- 26. Сравнение типов катализаО сходстве механизмов гетерогенного и
- 27. Основные предпосылки к теорииСтадии процесса: 1.
- 28. Основные предпосылки к теорииСтадии процесса: 1.
- 29. Основные предпосылки к теорииСтадии процесса: 2.
- 30. Закономерности обратимой хемосорбции молекул А
- 31. Кинетический закон действующих поверхностей:
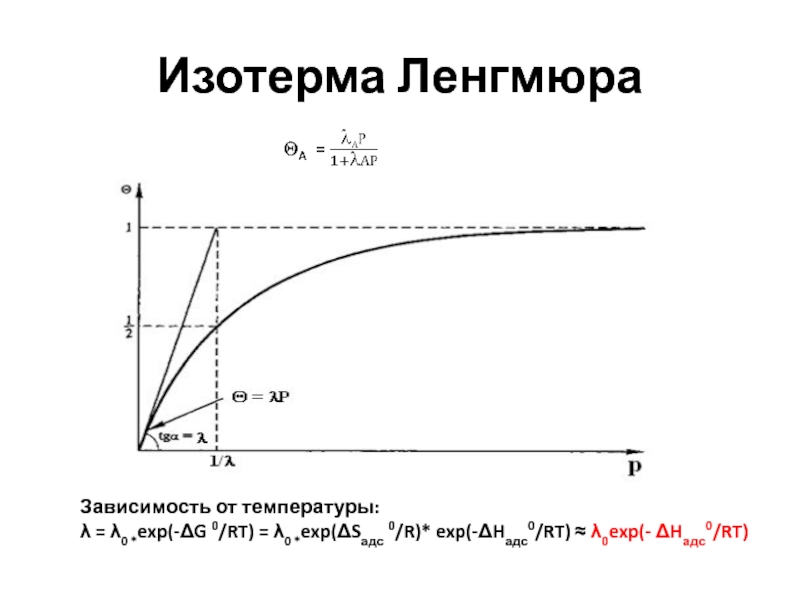
- 32. Изотерма Ленгмюра (1918 г)
- 33. Изотерма ЛенгмюраЗависимость от температуры: = 0 *exp(-G
- 34. Одновременная адсорбция нескольких газов (А и В)
- 35. Механизм Ленгмюра-Хиншельвуда. 1921 г
- 36. Механизм мономолекулярной гетерогенной реакции
- 37. Механизм Лэнгмюра-Хиншельвуда наблюдается для многих промышленных реакций:
- 38. Пример
- 39. ПримерЭнергия активации Eа каталитических реакций значительно меньше,
- 40. Примеры хемосорбционных процессов.
- 41. Механизмы гетерогенного катализаРазличают два механизма:Механизм Ленгмюра-Хиншельвуда;Механизм Или – Ридиела
- 42. Механизм Ленгмюра-ХиншельвудаРассмотрим каталитическую гетерогенную реакцию: А +
- 43. Механизм Ленгмюра-Хиншельвуда
- 44. Механизм Ленгмюра-Хиншельвуда
- 45. Механизм Или – Ридиела
- 46. Механизм Или – Ридиела (1941)Реакция осуществляется между
- 47. Механизм Или – Ридиела
- 48. Примеры по Или - Ридиелу
- 49. Кот в промоторе
- 50. Скачать презентанцию
Определение Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими веществами. Механизм гетерогенно-каталити-ческих процессов значительно более сложен, чем в случае гомогенного катализа. Гетерогенно-каталитические реакции широко применяются в
Слайды и текст этой презентации
Слайд 2Определение
Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз,
Слайд 3В промышленности применяют катализаторы:
в виде цилиндров, гранул диаметром несколько миллиметров,
а также
катализаторы, получаемые нанесением активного агента (платины, палладия) на
пористый носитель - активированный уголь, кизельгур, силикагель, алюмогель. Количество каталитически активного металла в нанесенном катализаторе не превышает нескольких процентов, что дает возможность экономить драгоценные дефицитные металлы.
Слайд 4Теории катализа
Из-за очень малых концентраций нанесенного металла на поверхности носителей
находятся не микрокристаллы, а небольшие группы атомов, которые Кобозев назвал
ансамблями. Он обратил внимание на то, что за увеличением количества нанесенного металла на носителе активность нанесенного катализатора проходит через максимум.Слайд 5Катализаторы
Для повышения активности, термодинамической устойчивости, механической жесткости применяют катализаторы в
виде многокомпонентных систем - смешанные и промотированные. Смешанные катализаторы -
это смесь двух или нескольких оксидов Al2О3, Сr2О3, СаО и МgO, активность которых является функцией состава.Специфической особенностью гетерокаталитических процессов является способность катализатора к промотированию и отравлению.
Слайд 6Промоторы
Промоторы (активаторы), не имеют каталитические свойства, но повышают каталитическую активность
катализатора. Например, для железного катализатора для синтеза аммиака нужен промотор
оксид алюминия. Он покрывает тонкой пленкой поверхность катализатора и защищает его от рекристаллизации, сохраняя дефекты в поверхностном слое, т.е. удельную активность катализатора.Слайд 7 Для катализируемой металлическим никелем реакции
СО + Н2 ––> СН4 + Н2О
введение небольшой примеси церия приводит к резкому возрастанию активности катализатора.
Отравление – резкое снижение активности катализатора в присутствии некоторых веществ (т. н. каталитических ядов).
Для реакции синтеза аммиака (катализатор – губчатое Fe), присутствие в реакционной смеси соединений S вызывает резкое снижение активности железного катализатора; в то же время способность катализатора к адсорбция реагентов снижается очень незначительно.
Слайд 9Катализ
Металлическая платина (показана стрелками), стабили-зированная на носителе — оксиде алюминия
Слайд 10Адсорбционная теория гетерогенного катализа
Термин адсорбция означает накопление молекул на поверхности
раздела фаз. Различают адсорбцию двух типов:
Физическая адсорбция происходит, когда
молекулы связываются с «активными центрами» и поверхности твердого вещества силами Ван-дер-Ваальса. Химическая адсорбция, или хемосорбция, происходит, когда молекулы связываются с активными центрами и поверхности химическими связями.
Слайд 11Активные центры
Для объяснения особенностей гетерогенно-каталитических процессов Г. Тэйлором было высказано
следующее предположение: каталитически активной является не вся поверхность катализатора, а
лишь некоторые её участки – т.н. активные центры, которыми могут являться различные дефекты кристал-лической структуры катализатора (например, выступы либо впадины на поверхности катализатора).Слайд 12Активные центры
Активные центры – свободные участки поверхности, где могут адсорбироваться
молекулы реагирующих веществ. Другая часть поверхности катализатора занята адсорбированными молекулами
примесей. Число активных центров на единицу поверхности зависит от природы и способа приготовления катализатора.Слайд 13Физическая адсобция
Физическая адсорбция протекает уже при низких температурах достаточно быстро
с малой энергией активации. Температурная зависимость скорости физической адсорбции проявляется
слабо, но количество адсорбиро-ванного вещества с ростом температуры быстро уменьшаетсяВеличина физической адсорбции слабо зависит от химической природы адсорбата. Физическая адсорбция, как правило, обратима, так как стандартная энтальпия адсорбции хотя и экзотермична, но невелика и лежит в пределах -(10 - 50) кДж/моль
Слайд 14Химическая адсобция
Хемосорбция представляет собой поверхностную химическую реакцию, не сопровождающееся образованием
объемной фазы.
Cилы, удерживающие молекулы адсорбата на поверхности адсорбента, аналогичны химическим
связям между атомами в молекуле, в результате чего происходит существенное перераспределе-ние электронной плотности в адсорбированном комплексе, приводящее к ослаблению или разрыву некоторых связей в хемосорбированной молекуле.Слайд 15Химическая адсобция
Значения энтальпии хемосорбции лежат в широком интервале, они превышают
в большинстве случаев по абсолютной величине
Н0 >100 кДж/моль.Например, для хемосорбции 02 на молибдене значения Н0 = -720 кДж/моль.
Хемосорбция в отличие от физической адсорбции высоко специфична по отношению к химическому составу адсорбента, поэтому очень чувствительна к чистоте поверхности катализатора.
Слайд 16Мультиплетная теория катализа
А.А. Баландина
В настоящее время нет единой теории гет.
катализа.
Основные положения теории мультиплетов. :
- Активный центр
катализатора представляет собой совокупность адсорбционных центров, на поверхности катализатора в геометрическом соответствии со строением реагирующей молекулы.- При адсорбции реагирующих молекул на активном центре образуется мультиплетный комплекс, в результате чего происходит перерас-пределение связей, приводящее к образованию продуктов реакции.
Слайд 17Теорию мультиплетов называют иногда теорией геометрического подобия активного центра и
реагирующих молекул. Для различных реакций число адсорбционных центров в активном
центре различно – 2, 3, 4 и т.д. Подобные активные центры называются соответственно дублет, триплет, квадруплет и т.д. (в общем случае мультиплет).- Согласно теории мультиплетов, дегидрирование предельных одноатомных спиртов происходит на дублете, а дегидрирование циклогексана – на секстете
- Теория мультиплетов позволила связать каталитическую активность металлов с величиной их атомного радиуса.
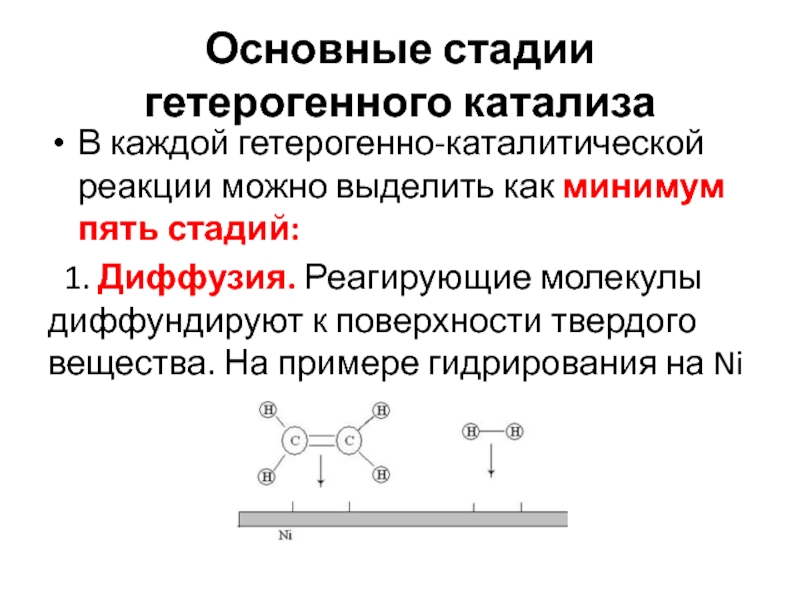
Слайд 19Основные стадии гетерогенного катализа
В каждой гетерогенно-каталитической реакции можно выделить как
минимум пять стадий:
1. Диффузия. Реагирующие молекулы диффундируют к поверхности
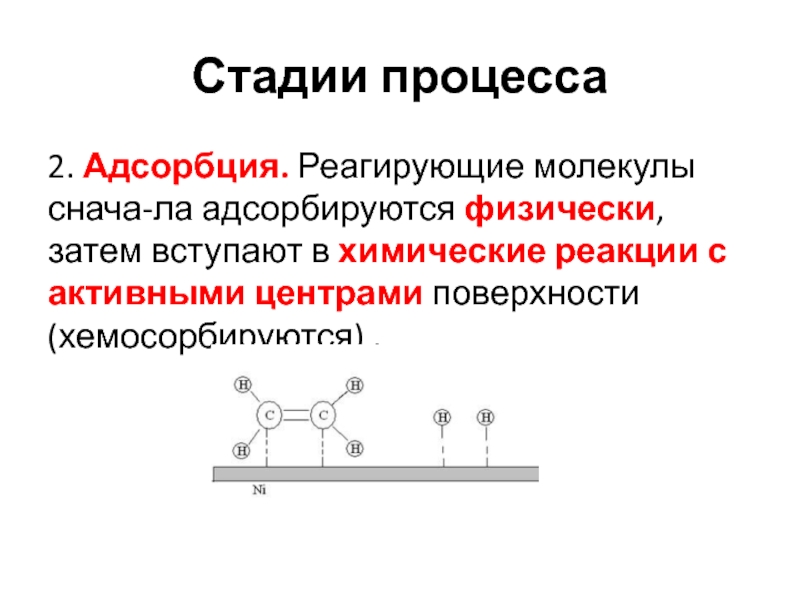
твердого вещества. На примере гидрирования на NiСлайд 20Стадии процесса
2. Адсорбция. Реагирующие молекулы снача-ла адсорбируются физически, затем вступают
в химические реакции с активными центрами поверхности (хемосорбируются) .
Слайд 21Полимолекулярная адсорбция
При физической адсорбции, если энергии межмолекулярных связей соизмеримы, после
насыщения первого адсорбционного слоя наступает полимолекулярная адсорбция с образованием второго
и последующих адсорбционных слоев. Полимолекулярная адсорбция имеет место во многих процессах с участием органических соединений при повышенных давлениях.Слайд 22Стадии процесса
3. Химическая реакция. Адсорбированные атомы и молекулы вступают
в химическую реакцию с образованием продуктов.
Слайд 23Стадии процесса
4. Десорбция. Молекулы продуктов реакции переходят из состояния
хемосорбирован-ности в состояние физической адсорбиро-ванности и затем десорбируются с поверхности.
Слайд 24Обратимость десорбции
В связи с высокой экзотермичностью большинства процессов хемосорбции десорбция
может иметь место только при повышенных температурах.
Хемосорбция является обратимой, если
при десорбции адсорбат переходит в газовую фазу в той же форме, какую он имел до адсорбции.Слайд 26Сравнение типов катализа
О сходстве механизмов гетерогенного и гомогенного катализа можно
судить по тому, что стадия хемосорбции в первом аналогична стадии
образования промежуточного соединения во втором. Различие их состоит в том, что на поверхности гетерогенного катализатора, благодаря наличию нескольких типов активных центров, могут образовываться различные типы активированных комплексов, приводящих к появлению разных продуктов реакции. В результате гетерогенные катализаторы характеризуются более низкой селективностью, чем катализаторы в гомогенном катализе.Слайд 27Основные предпосылки к теории
Стадии процесса:
1. Диффузия к поверхности.
2. Адсорбция (физическая и химическая)
монослойная
или полислойная3. Химическая реакция.
4. Десорбция (обратимая или необратимая)
5. Диффузия от поверхности.
Попробуем уменьшить количество стадий?
Слайд 28Основные предпосылки к теории
Стадии процесса:
1. Диффузия к поверхности
при Т.
2. Адсорбция (физическая и химическая)
монослойная или полислойная3. Химическая реакция.
4. Десорбция (обратимая или необратимая)
5. Диффузия от поверхности при Т.
Увеличим скорость перемешивания и Т и добьёмся, что стадии 1 и 5 станут быстрыми
Слайд 29Основные предпосылки к теории
Стадии процесса:
2. Адсорбция (физическая и
химическая)
монослойная или полислойная
3. Химическая
реакция (лимитирующая).4. Десорбция (обратимая или необратимая)
Выберем температуру, при которой быстро реализуется обратимая химическая адсорбция по стадиям 2 и 4
Останется одна медленная стадия – стадия 3
Слайд 30Закономерности обратимой хемосорбции молекул А
kа
АГ+ S (АS)адс ,
= СAS/CASmaxkд
где S – свободный адсорбционный центр по поверхности;
- доля занятых адсорбированными молекулами центров
kа и kд – константы скорости адсобции и десорбции
Слайд 31Кинетический закон действующих поверхностей:
-
скорость адсорбции пропорциональна
числу столкновений молекул адсорбата
(P) со свободными адсорбционными центрами S на
поверхности адсорбента rадс = kаР(1-);
скорость десорбции пропорциональна числу занятых мест на поверхности rдес = kд;
скорость реакции между адсорбированными молекулами A и В пропорциональна произведению величин адсорбции каждого из веществ. r = k*А*В
Слайд 33Изотерма Ленгмюра
Зависимость от температуры:
= 0 *exp(-G 0/RT) = 0
*exp(Sадс 0/R)* exp(-Hадс0/RT) 0exp(- Hадс0/RT)
Слайд 35
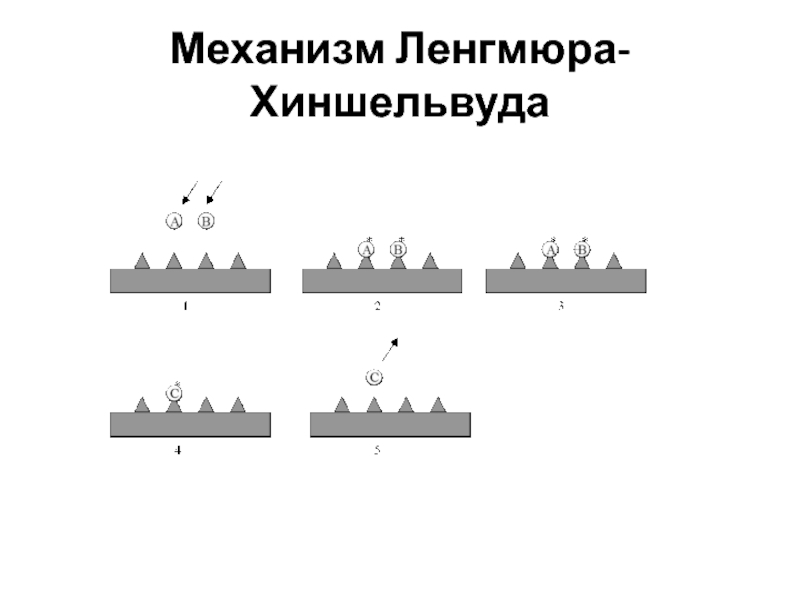
Механизм Ленгмюра-Хиншельвуда.
1921 г
Он основан на следующих предположениях:
Адсорбция мономолекулярная
Реагент и продукт адсорбируются без диссоциации на разных активных центрах.
Хемосорбированные
на соседних центрах реагенты взаимодействуют с образованием адсорбированного продукта .Образовавшийся продукт десорбируется.
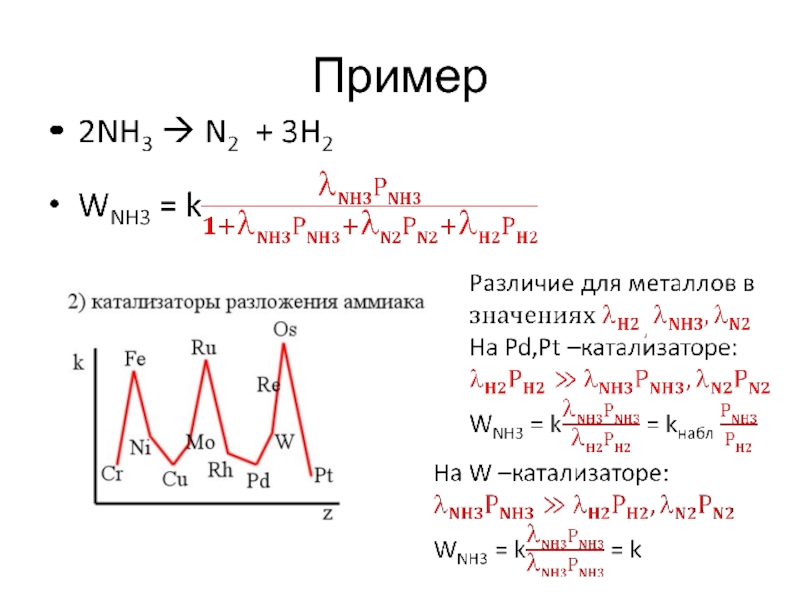
Слайд 39Пример
Энергия активации Eа каталитических реакций значительно меньше, чем для той
же реакций в отсутствие катализатора. Например, для
2NH3 N2 + 3H2 без катализатора В присутствии платины
Eа ~ 320 кДж/моль, Еа ~ 150 кДж/моль
Благодаря снижению E обеспечивается ускорение каталитических реакций по сравнению с некаталитическими:
Еа,эксп = Еа + H0адс,NH3 - H0адс,прод
Слайд 41Механизмы гетерогенного катализа
Различают два механизма:
Механизм Ленгмюра-Хиншельвуда;
Механизм Или – Ридиела
Слайд 42Механизм Ленгмюра-Хиншельвуда
Рассмотрим каталитическую гетерогенную реакцию: А + В С
kа,A
kа,BАГ+ S (АS)адс ; ВГ+ S (ВS)адс
kд,A kд,B
(АS)адс + (ВS)адс C +2S (C плохо адсорб)
Скорость реакции между адсорбированными молекулами A и В пропорциональна произведению величин адсорбции каждого из веществ. r = k*А*В
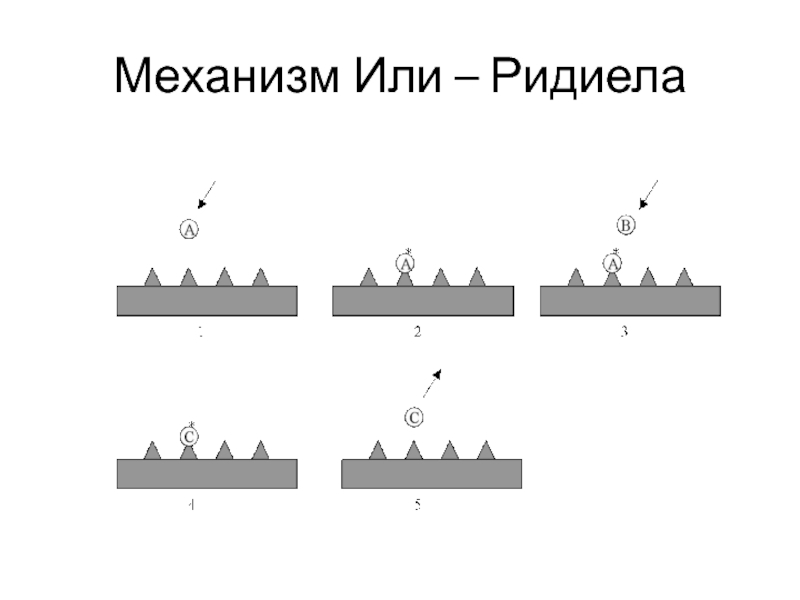
Слайд 46Механизм Или – Ридиела (1941)
Реакция осуществляется между адсорбированной молекулой (АS)адс
и молекулой В в газовой фазе по схеме:
kа,A АГ+ S (АS)адс ;
kд,A
(АS)адс + В C +S
(C, В плохо адсорбируются на поверхности)