Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
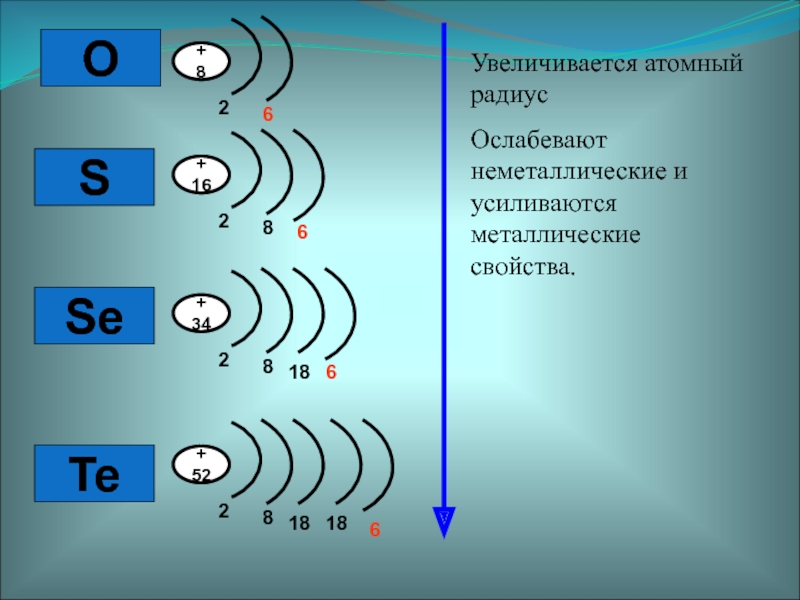
Халькогены
Содержание
- 1. Халькогены
- 2. OSSeTe
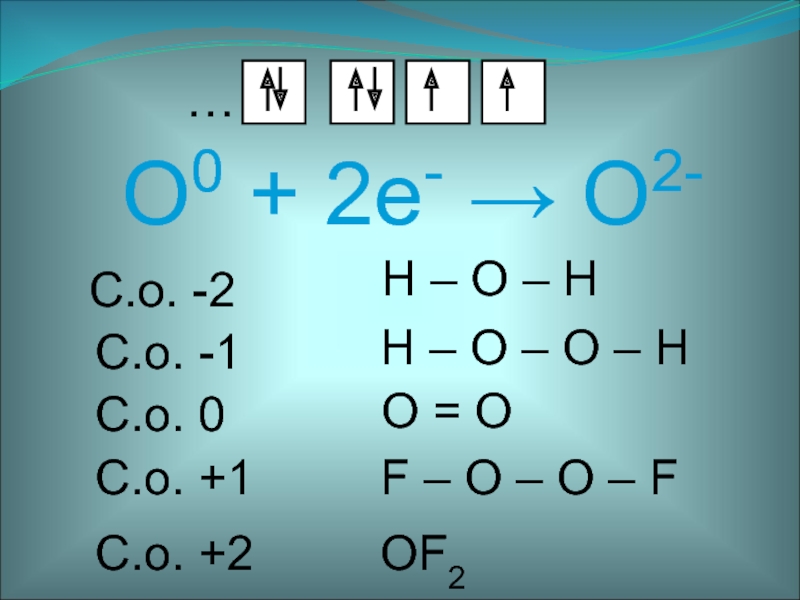
- 3. O0 + 2е- O2-…С.о. 0O = O С.о. -2H – O – H
- 4. Аллотропия кислорода. Кислород и озон
- 5. Распространение в природеКислород В земной коре 47%.В
- 6. Слайд 6
- 7. Слайд 7
- 8. Аллотропия серы. Кристаллическая, пластическая и моноклинная
- 9. Красный железняк (гематит) Fe2O3«Халькогены» - греч.
- 10. Магнитный железняк(магнетит) - Fe3O4
- 11. Серный колчедан ( пирит) - FeS2
- 12. Медный колчедан (халькопирит)-CuFeS2
- 13. Цинковая обманка(cфалерит)- ZnS
- 14. Свинцовый блеск (галенит)- PbS
- 15. Киноварь – HgS
- 16. Гипс – CaSO4 *2 H2O
- 17. Глауберова соль (мирабилит)- Na2SO4* 10H2O
- 18. Самородная сера Cелен
- 19. СераВ Земной коре 0,
- 20. Соединения серы:+4: SO2, H2SO3, MeSO3,MeHSO3+6: SO3, H2SO4, MeSO4,MeHSO4-2: H2S, MeS,MeHS
- 21. Химические свойства+ О2→ SO2+P→ P2S3 +Г2→SГ2+Me→MeS-2( сульфид)+Н2→Н2S+HNO3→NO
- 22. Химические свойстваХалькогеныОкислители (степени окисления +2, +4, +6)По
- 23. Химические свойства серы Окислитель Со всеми
- 24. Задание 1: Определите степени окисления серы
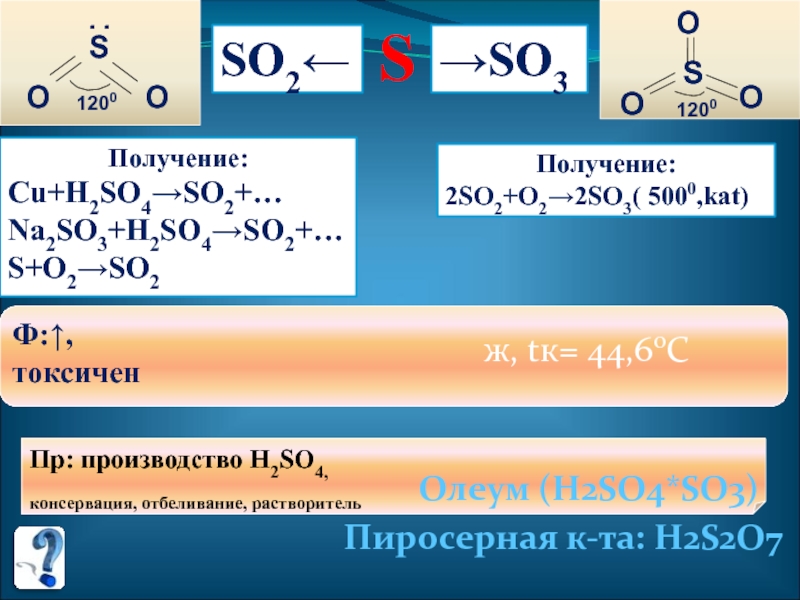
- 25. S→SO3SO2←S. .OO1200SOOO1200Получение:Cu+H2SO4→SO2+…Na2SO3+H2SO4→SO2+…S+O2→SO2Получение:2SO2+O2→2SO3( 5000,kat)Ф:↑, токсичен
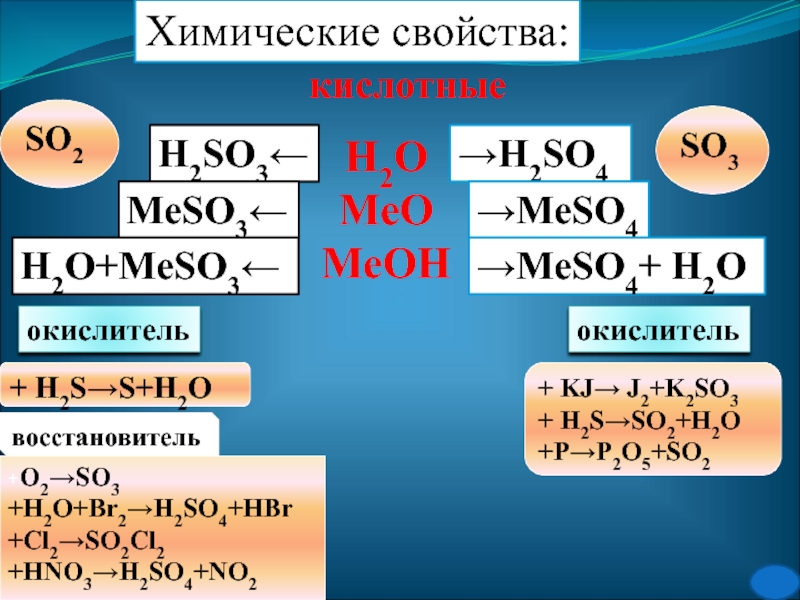
- 26. Химические свойства:кислотныеН2ОМеОМеОН→H2SO4→MeSO4→MeSO4+ H2OH2SO3←MeSO3←H2O+MeSO3←SO2SO3окислительокислитель+ H2S→S+H2O+ KJ→ J2+K2SO3+ H2S→SO2+H2O+P→P2O5+SO2восстановитель+O2→SO3+H2O+Br2→H2SO4+HBr+Cl2→SO2Cl2+HNO3→H2SO4+NO2
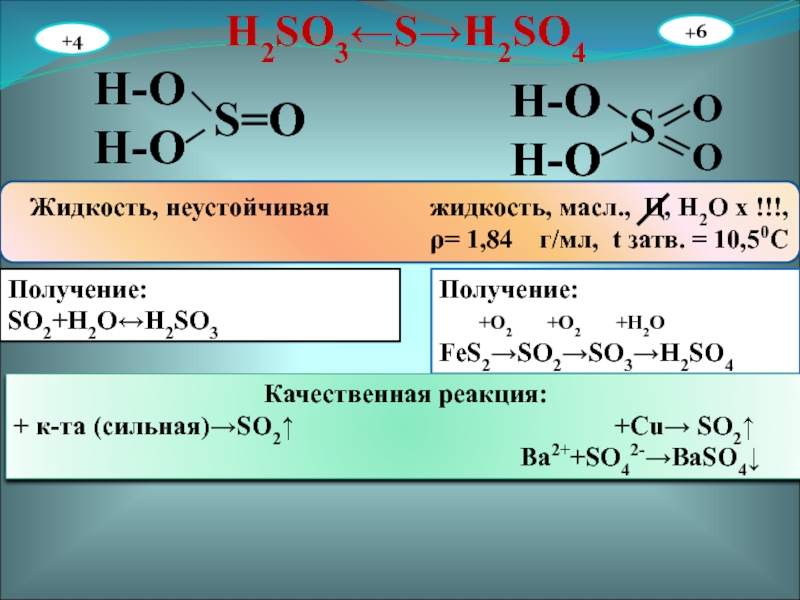
- 27. H2SO3←S→H2SO4H-OH-OS=OH-OH-OSOOЖидкость, неустойчивая
- 28. Химические свойства серной кислоты (разбавленной).Ме(до водорода) +
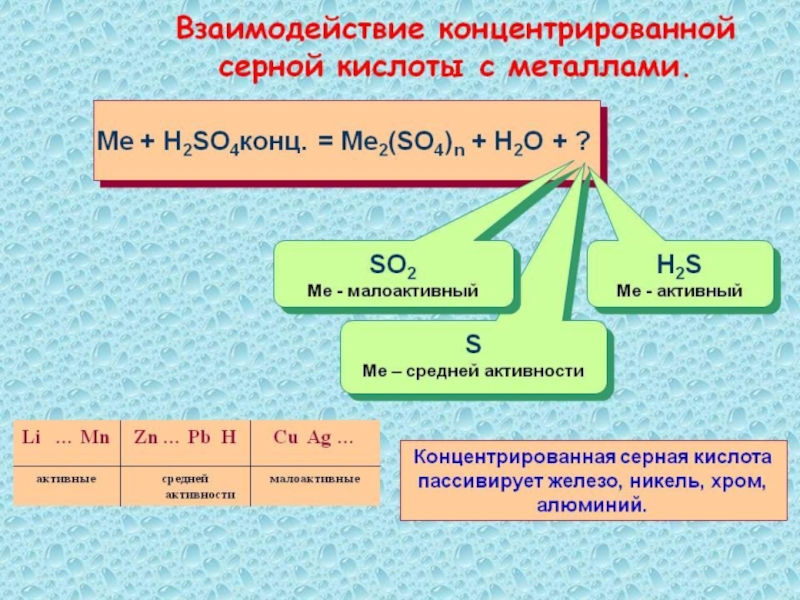
- 29. Химические свойства серной кислоты(концентрированной)H2SO4 + Ме
- 30. Слайд 30
- 31. Применение серы
- 32. Задание 2: Какой процесс называют
- 33. Биологическое значение серыВходит в состав белков (белки
- 34. Se и Te -минералов не образуют Ро - очень редкий радиоактивный элемент
- 35. Практическая часть1. Просмотр минералов2. Синтез кристаллов алюмокалиевых квасцов и медного купороса3. Свойства серной кислоты (конц, разб)
- 36. Скачать презентанцию
Слайды и текст этой презентации
Слайд 5Распространение в природе
Кислород
В земной коре 47%.
В воздухе 23 %(атмосфера).
В
воде 89%(гидросфера).
На высоте 25 км над Землёй образует
озон ( О3).Слайд 9
Красный железняк (гематит) Fe2O3
«Халькогены» -
греч. «рождающие руды»
Основные руды –
соединения данной подгруппы – оксиды и сульфиды
Слайд 19Сера
В Земной коре 0, 05%
Самородная сера (S)
Пирит (FeS2)
Цинковая обманка (ZnS)
Молибденовый блеск (MoS2)
Гипс ( CaSO4*2H2O)
Горькая соль
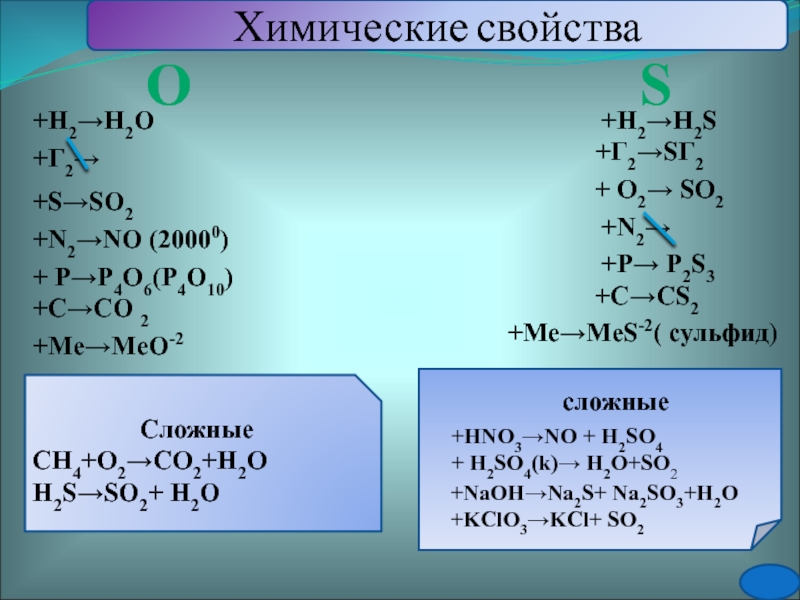
(MqSO4*7H2O)Слайд 21Химические свойства
+ О2→ SO2
+P→ P2S3
+Г2→SГ2
+Me→MeS-2( сульфид)
+Н2→Н2S
+HNO3→NO + H2SO4
+ H2SO4(k)→
H2O+SO2
+NaOH→Na2S+ Na2SO3+H2O
+KClO3→KCl+ SO2
сложные
О
S
+Н2→Н2O
+Г2→
+Me→MeO-2
+S→SO2
+C→CO 2
Сложные
СН4+О2→СО2+Н2О
Н2S→SO2+ Н2О
+N2→NO (20000)
+N2→
+ P→P4O6(P4O10)
+C→CS2
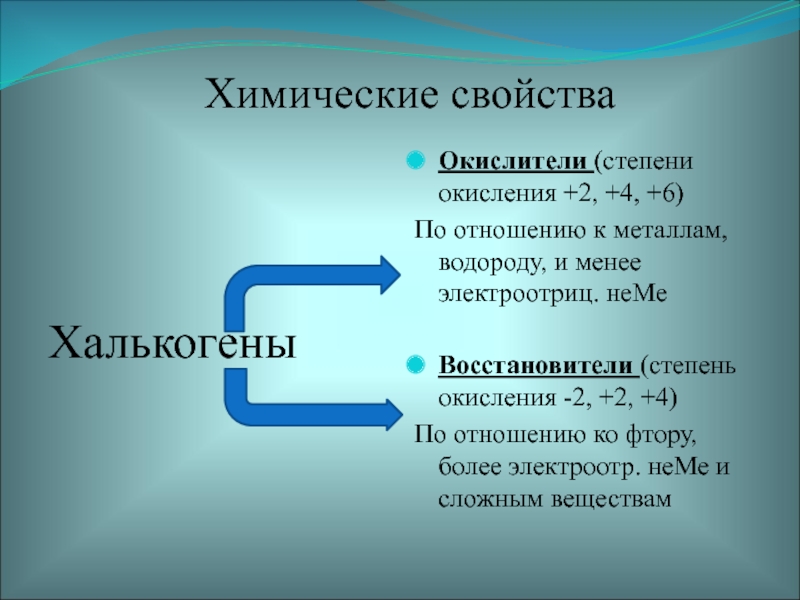
Слайд 22Химические свойства
Халькогены
Окислители (степени окисления +2, +4, +6)
По отношению к металлам,
водороду, и менее электроотриц. неМе
Восстановители (степень окисления -2, +2, +4)
По
отношению ко фтору, более электроотр. неМе и сложным веществамСлайд 23 Химические свойства серы
Окислитель
Со всеми Ме, кроме Au
и Pt
А) S + Cu→
http://www.youtube.com/watch?v=quQ9GBdlnxE
Б) S + Zn→
http://www.youtube.com/watch?v=xfOFS2mGuw0
В) S +
Na → http://www.videolica.com/videos/uoA__29o09s/%D0%B2%D0%B7%D0%B0%D0%B8%D0%BC%D0%BE%D0%B4%D0%B5%D0%B9%D1%81%D1%82%D0%B2%D0%B8%D0%B5-%D1%81%D0%B5%D1%80%D1%8B-%D1%81-%D0%BD%D0%B0%D1%82%D1%80%D0%B8%D0%B5%D0%BC
Восстановитель
А) S + O2→для религиозных обрядов
http://www.youtube.com/watch?v=5nVtpd3xuD8
Б) S + KClO3→
Слайд 24Задание 1:
Определите степени окисления серы в соединениях :
SO2,
H2S, SO3, CaS, Na2SO4, NaHS,
KHSO4, MgSO4, H2SO4, K2SO3.
Слайд 25S
→SO3
SO2←
S
. .
O
O
1200
S
O
O
O
1200
Получение:
Cu+H2SO4→SO2+…
Na2SO3+H2SO4→SO2+…
S+O2→SO2
Получение:
2SO2+O2→2SO3( 5000,kat)
Ф:↑,
токсичен
Пр: производство H2SO4,
консервация, отбеливание, растворитель
ж, tк= 44,60С
Олеум (H2SO4*SO3)
Пиросерная к-та: H2S2O7
Слайд 26Химические свойства:
кислотные
Н2О
МеО
МеОН
→H2SO4
→MeSO4
→MeSO4+ H2O
H2SO3←
MeSO3←
H2O+MeSO3←
SO2
SO3
окислитель
окислитель
+ H2S→S+H2O
+ KJ→ J2+K2SO3
+ H2S→SO2+H2O
+P→P2O5+SO2
восстановитель
+O2→SO3
+H2O+Br2→H2SO4+HBr
+Cl2→SO2Cl2
+HNO3→H2SO4+NO2
Слайд 27H2SO3←S→H2SO4
H-O
H-O
S=O
H-O
H-O
S
O
O
Жидкость, неустойчивая жидкость,
масл., Ц, Н2О х !!!,
ρ= 1,84 г/мл, t затв. = 10,50СПолучение:
SO2+H2O↔H2SO3
Получение:
+O2 +O2 +H2O
FeS2→SO2→SO3→H2SO4
Качественная реакция:
+ к-та (сильная)→SO2↑ +Cu→ SO2↑
Ba2++SO42-→BaSO4↓
+4
+6
Слайд 28Химические свойства серной кислоты (разбавленной).
Ме(до водорода) + H2SO4
соль + Н2
МеО + H2SO4
соль + Н2ОМеОН + H2SO4 соль + Н2О
Соль( растворимая, слабой кислоты) + H2SO4
новая соль + новая кислота
Качественная реакция на сульфат- ион:
ВаСL2 + H2SO4 BaSO4 +2 HСL
Слайд 29Химические свойства серной кислоты(концентрированной)
H2SO4 + Ме соль+
Н2О+SO2,H2S,S
H2SO4 + органические вещества
обугливание
Слайд 32Задание 2:
Какой процесс называют демеркуризацией?
При разливании ртути труднодоступные для её извлечения места можно засыпать
порошкообразной серой. Какое вещество при этом образуется?Напишите уравнение реакции.
Слайд 33Биологическое значение серы
Входит в состав белков (белки волос, рогов, шерсти)
Составная
часть витаминов, ферментов и гормонов (инсулин)
Принимает участие в окислительно –
восстановительных процессах ( при недостатке хрупкость и ломкость костей и выпадение волос)Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца.