Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Характеристика элемента по Периодической системе Д.И. Менделеева
Содержание
- 1. Характеристика элемента по Периодической системе Д.И. Менделеева
- 2. Периодическая система химических элементов Д.И. Менделеева
- 3. Если от элемента бора (В) провести условную
- 4. МЕТАЛЛЫ И НЕМЕТАЛЛЫ
- 5. В побочных подгруппах находятся только металлы. Для
- 6. Каждый элемент занимает строго отведенную ему ячейку,
- 7. ХАРАКТЕРИСТИКИ ЭЛЕМЕНТАХимический элемент можно характеризовать по следующим
- 8. ПОЛОЖЕНИЕ В СИСТЕМЕПо положению в Системе можно
- 9. План – алгоритм характеристики элемента по
- 10. Подсказка! Число электронов = числу протонов
- 11. СТРОЕНИЕ АТОМА Атомы имеют сложное строение: вокруг положительно
- 12. Вид элемента (s, p, d, f) Подсказка!s-элементы: это
- 13. Подсказка! Для написания схемы нужно знать следующее:Заряд
- 14. Общее число электронов в атоме равно числу
- 15. У d - элементов на последнем уровне число
- 16. Максимальное возможное число электронов на уровнях определяют
- 17. Схема строения атома (распределение электронов по
- 18. Электронная и электронно-графическая формулы строения атома Подсказка!Для написания электронной формулы используют шкалу энергий:s
- 19. ВЗАИМОДЕЙСТВИЯ АТОМОВДля атомов присуще стремление приобрести более
- 20. ФОРМУЛЫ АТОМОВВ современной химии строение атомов принято
- 21. ФОРМУЛЫ АТОМОВНа таких формулах квадратом обозначается электронная
- 22. Металл или неметалл Подсказка!К неметаллам относятся:
- 23. Высший оксид (только для s, p) Подсказка!Общая формула высшего оксида дана под группой химических элементов (R2O, RO и т.д.)
- 24. Летучее водородное соединение (только
- 25. План описания химического элементаНаходим химический элемент в
- 26. Скачать презентанцию
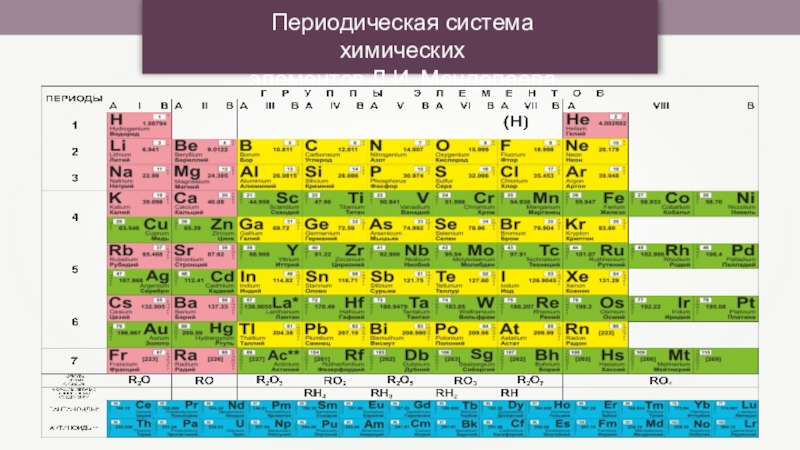
Периодическая система химических элементов Д.И. Менделеева
Слайды и текст этой презентации
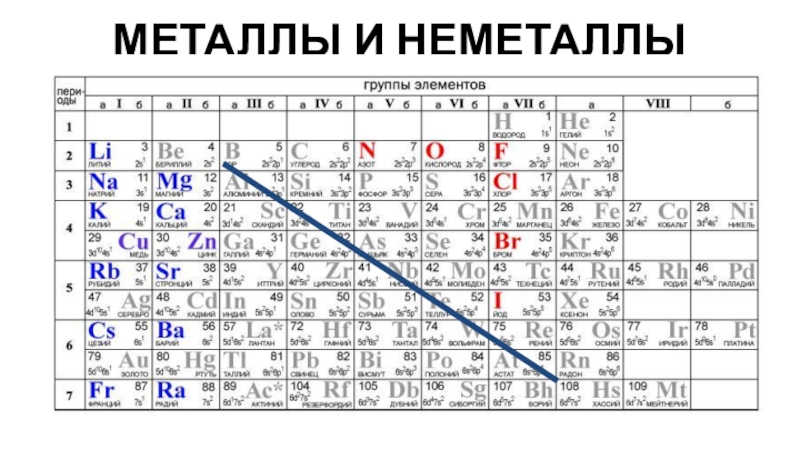
Слайд 5В побочных подгруппах находятся только металлы. Для металлов характерно небольшое
число электронов на внешнем энергетическом уровне (1-3) и электроотрицательность ниже
2. Неметаллам присуща высокая электроотрицательность, 4 и более электронов на внешнем уровне. При образовании химических связей атомы металлов отдают внешние электроны, а атомы неметаллов их захватывают.Слайд 6 Каждый элемент занимает строго отведенную ему ячейку, которая расположена в
определенном периоде и определенной группе.
В каждой ячейке содержится информация об
элементе:- символ элемента
название элемента
порядковый номер
его атомная масса
Слайд 7ХАРАКТЕРИСТИКИ ЭЛЕМЕНТА
Химический элемент можно характеризовать по следующим пунктам:
Положение в Периодической
системе;
Металл или неметалл;
Электроотрицательность, то есть сила притяжения электронов к ядру;
Степень
окисления, то есть число отданных или захваченных в процессе образования данного вещества, электронов (применяется к любым химическим элементам);Валентность, то есть число образованных в данном веществе общих пар электронов (корректнее применять эту характеристику только к неметаллам).
Слайд 8ПОЛОЖЕНИЕ В СИСТЕМЕ
По положению в Системе можно определить:
Заряд ядра, число
протонов в ядре и общее число электронов = порядковый номер
элемента;Число энергетических уровней (электронных оболочек) = номер периода;
Число электронов на внешнем уровне у элементов главных подгрупп = номер группы;
Металл или неметалл – по расположению относительно линии «B-At».
Слайд 9 План – алгоритм характеристики элемента по его положению в ПСХЭ
Д. И. Менделеева
1. Название
2. Химический знак, относительная атомная масса (Ar)
3.
Порядковый номер4. Номер периода (большой 4-7 или малый 1-3)
5. Номер группы, подгруппа (главная «А» или побочная «Б»)
6. Состав атома: число электронов, число протонов, число нейтронов
Слайд 10
Подсказка!
Число электронов = числу протонов = порядковому номеру;
Число нейтронов =
атомная масса (Ar из таблицы Менделеева) – число протонов.
Слайд 11СТРОЕНИЕ АТОМА
Атомы имеют сложное строение: вокруг положительно заряженного массивного ядра
движутся по определённым орбитам с огромной скоростью практически невесомые отрицательно
заряженные электроны.Ядро состоит из нуклонов – протонов(+) и нейтронов(0). По форме орбиты электроны бывают 4 типов: s, p, d и f и образуют электронные облака (орбитали) 4 видов.
Слайд 12
Вид элемента (s, p, d, f)
Подсказка!
s-элементы: это первые два элемента в 1-7
периодах;
p-элементы: последние шесть элементов1-6 периодов;
d-элементы: это элементы больших периодов (по
10 штук) между s- и p-элементами;f- элементы: это элементы 6 и 7 периодов – лантаноиды и актиноиды, они вынесены вниз таблицы.
Слайд 13Подсказка! Для написания схемы нужно знать следующее:
Заряд ядра атома =
порядковому номеру атома;
Число энергетических уровней определяют по номеру периода, в
котором находится элемент;У s- и p-элементов на последнем (внешнем) от ядра энергетическом уровне число электронов равно номеру группы, в которой находится элемент. Например, Na+11)2)8)1=номеру группы
Слайд 14Общее число электронов в атоме равно числу протонов в ядре,
а число электронов на внешнем уровне (у элементов главных подгрупп)
равно номеру группы.Число энергетических уровней (электронных слоёв) в атоме равно номеру периода.
Слайд 15У d - элементов на последнем уровне число электронов всегда равно
2 (исключения – хром, медь, серебро, золото и некоторые другие
на последнем уровне содержат 1 электрон).Например, Ti+22)2)8)10)2 ; Cr++24)2)8)13)1– исключение
Слайд 16Максимальное возможное число электронов на уровнях определяют по формуле: Nэлектронов = 2n2,
где n – номер энергоуровня.
Например, I уровень – 2 электрона, II – 8 электронов, III – 18 электронов, IV–
32 электрона и т.д.Слайд 17
Схема строения атома (распределение электронов по энергоуровням), завершённость внешнего уровня.
Подсказка!
Внешний уровень завершён у элементов VIII группы главной подгруппы "А"
- Ne, Ar, Kr, Xe, Rn.Слайд 18
Электронная и электронно-графическая формулы строения атома
Подсказка!
Для написания электронной формулы используют
шкалу энергий:
s
на d – 10, на f – 14 электронов.Например, +11Na 1s22s22p63s1; +22Ti 1s22s22p63s23p64s23d2
Слайд 19ВЗАИМОДЕЙСТВИЯ АТОМОВ
Для атомов присуще стремление приобрести более устойчивую и энергетически
выгодную электронную конфигурацию, характерную для благородных газов (завершённый внешний энергетический
уровень – «электронный октет»). В результате взаимодействия между собой, атомы более электроотрицательных элементов захватывают электроны на внешний уровень, а атомы менее электроотрицательных элементов – отдают свои внешние электроны.Слайд 20ФОРМУЛЫ АТОМОВ
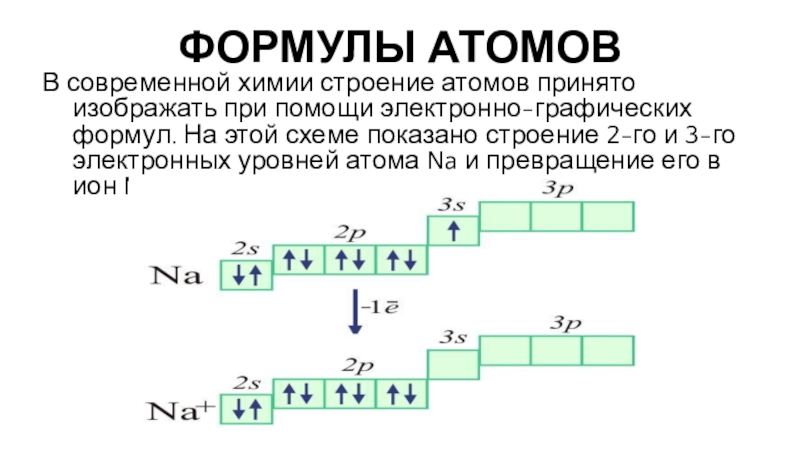
В современной химии строение атомов принято изображать при помощи
электронно-графических формул. На этой схеме показано строение 2-го и 3-го
электронных уровней атома Na и превращение его в ион Na+:Слайд 21ФОРМУЛЫ АТОМОВ
На таких формулах квадратом обозначается электронная орбиталь, стрелки внутри
квадрата символизируют электроны, этажное расположение обозначает уровни и подуровни электронов.
Графическая часть формулы подтверждается буквенно-цифровым обозначением. Отсюда их название: электронно-графические формулы.Слайд 22
Металл или неметалл
Подсказка!
К неметаллам относятся: 2 s-элемента - водород и гелий
и 20 p-элементов – бор, углерод, азот, кислород, фтор, неон, кремний,
фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат и радон.К металлам относятся: все d- и f-элементы, все s-элементы (исключения водород и гелий), некоторые p-элементы.
Слайд 23
Высший оксид (только для s, p)
Подсказка!
Общая формула высшего оксида дана под группой
химических элементов (R2O, RO и т.д.)
Слайд 24
Летучее водородное соединение
(только для s, p)
Подсказка!
Общая формула летучего водородного соединения дана
под группой химических элементов (RH4, RH3 и т.д.) – только для элементов
4 -8 групп.Слайд 25План описания химического элемента
Находим химический элемент в таблице. Название, обозначение
и по его положению описываем строение его атомов. Порядковый номер,
период, группа.Планетарная модель атома, атомная масса, масса протонов и нейтронов.
Электронная формула и электронный паспорт до последнего уровня.
S2 p6 d10 f14
5. Возможные валентности (определяются по числу неспаренных электронов)
6. Возможные степени окисления (определяются по числу электронов , которые атом может «принять»– «отдать»)
7. Высший оксид и водородное соединение.