Слайд 1Химическая кинетика и катализ
Слайд 2Понятие о химической кинетике
Химической кинетикой называется учение о скорости химических
реакций и ее зависимости от различных факторов – природы и
концентрации реагирующих веществ, давления, температуры, катализаторов. Скорости химических реакций могут значительно различаться. Например, некоторые реакции совершаются в тысячные доли секунды (взрыв), другие же протекают в течение значительно более длительного времени.
Вопрос о скорости химических реакций имеет исключительно большое практическое и теоретическое значение.
От скорости реакции в различных технологических процессах зависят производительность и габариты заводской аппаратуры, течение тех или иных биологических процессов, эффективность действия на живой организм различных лекарственных препаратов.
Слайд 3О скорости химической реакции судят по изменению концентрации реагирующих веществ
в единицу времени. При этом учитывается изменение концентрации– исходных или
продуктов, т.к. с какой скоростью расходуются исходные вещества, с той же скоростью и накапливаются продукты реакции.
Различают два вида скоростей: среднюю и истинную. Средняя скорость представляет собой отношения изменения концентрации к промежутку времени:
ср
где С1 и С2 – концентрации вещества в начальный (1) и конечный (2) момент времени.
Слайд 4Истинная скорость – это скорость химической реакции в данный момент
времени и представляет собой первую производную концентрации по времени:
ист =
Слайд 5Скорость всегда положительна, знак ± относится к изменению концентрации, если
концентрация в ходе процесса увеличивается, то знак «+», а если
уменьшается то знак «−».
За скоростью процесса можно следить по изменению концентрации хотя бы одного из реагентов, учитывая его стехиометрический коэффициент. Для реакции вида
аA + вB → сC + dD
Слайд 6Факторы, влияющие на скорость химических реакций. Закон действующих масс
На скорость
химических реакций оказывают влияние следующие факторы: природа и концентрации реагирующих
веществ; температура, природа растворителя, присутствие катализатора и т.д.
Зависимость скорости химических реакций от концентрации устанавливает закон действующих (действия) масс, сформулированный Гульдбергом и Вааге (1867), этот закон и является основным законом кинетики: скорость химической реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, взятых в степени их стехиометрических коэффициентов.
Слайд 7Для гомогенной реакции общего вида
аA + вB → сC
+ dD
пр =
k1CАа CВв,
обр = k2Cсс CDd,
где пр – скорость прямой реакции;
обр – скорость обратной реакции;
СА,CB,CC и CD – концентрации реагирующих веществ, например, моль/дм3;
а, в, с, и d – стехиометрические коэффициенты участников реакции;
k1 и k2 – коэффициенты пропорциональности, названные константой скорости химической реакции.
Слайд 8Для газов вместо концентрации можно использовать давления пр
= k1РАа РВв.
Определим физический смысл константы скорости.
Примем концентрации веществ
А и В равными 1 моль/дм3 (СА = CB = 1 моль/дм3), тогда
пр = k1
Константа скорости – это скорость реакции, если концентрации реагирующих веществ равны 1 моль/дм3.
Константа скорости зависит от тех же факторов, что и скорость, за исключением концентрации веществ. Причем, чем больше величина константы скорости, тем больше скорость процесса. Константу скорости можно найти опытным путем или посчитать, используя уравнения, описывающие механизм химической реакции.
Слайд 9Зависимость константы скорости (и скорости) процесса от температуры определяет приближенное
правило Вант-Гоффа: увеличение температуры на каждые 10 ОС увеличивает скорость
процесса в 2 - 4 раза.
Аналитическое выражение этого правила в общем виде:
где k1 и k2 – константы скорости при температуре t1 и t2,
γ – температурный коэффициент Вант-Гоффа (γ = 2 4).
Слайд 10Правило Вант-Гоффа применяют при изменении температуры ниже 30 ºС. При
более высоких изменениях температуры используют уравнение Аррениуса
lnk = B
– , где А и В – постоянные величины для данной реакции.
k = kоe–Eа/RT
lnk = lnkо – Eа/RT , (5.29)
где k – константа скорости при обычных условиях;
kо – константа скорости при условии, что все столкновения приводят к реакции.
Слайд 11
Если реакция идет между атомами или свободными радикалами, то обычно
Еа не превышает 40 кДж/моль,
между молекулами – 150-250 кДж/моль,
в полимерах - 400 кДж/моль.
Если Ea выше наибольшей величины, то такая реакция невозможна.
Скорость химической реакции зависит от величины энергии активации: чем она больше, тем медленнее будет протекать данная реакция.
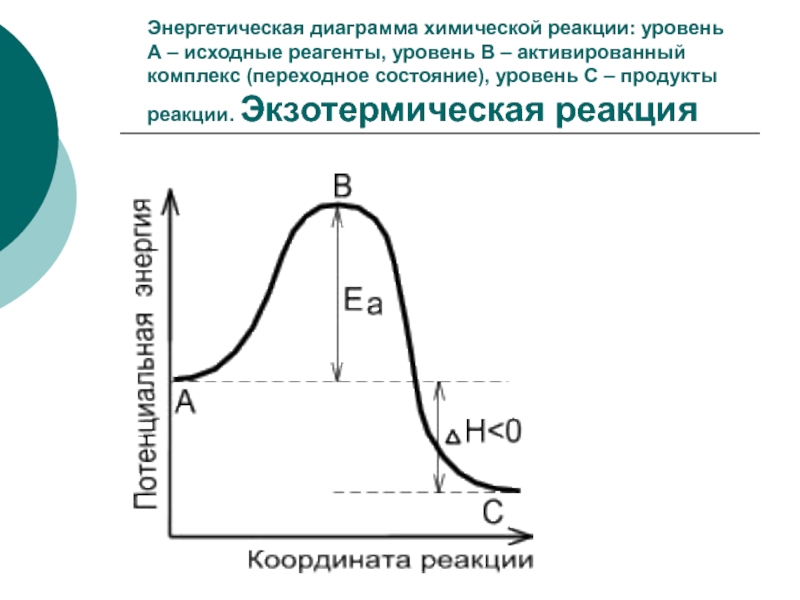
Слайд 12Энергетическая диаграмма химической реакции: уровень
А – исходные реагенты, уровень
В – активированный комплекс (переходное состояние), уровень С – продукты
реакции. Экзотермическая реакция
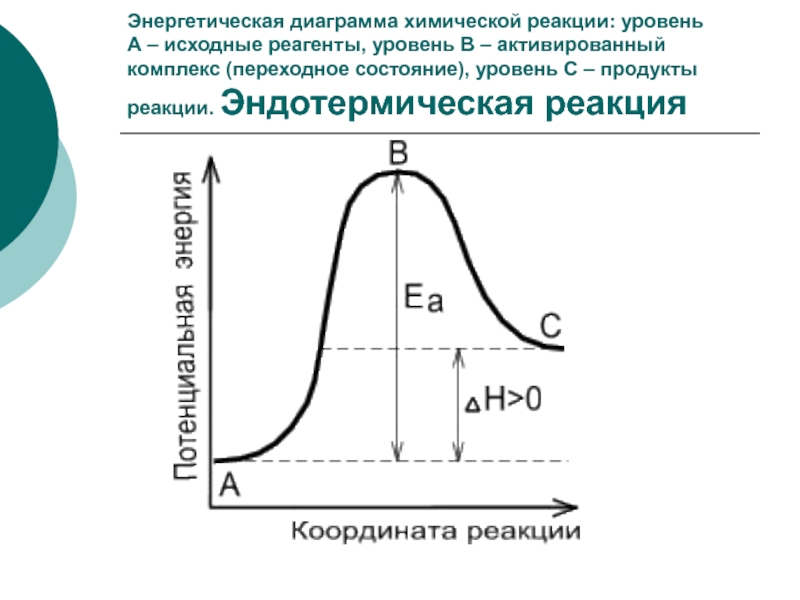
Слайд 13Энергетическая диаграмма химической реакции: уровень
А – исходные реагенты, уровень
В – активированный комплекс (переходное состояние), уровень С – продукты
реакции. Эндотермическая реакция
Слайд 14Скорость гетерогенных реакций
Поэтому первой особенностью кинетики этих реакций является влияние
площади реакционной поверхности на скорость реакции. Вместо концентрации твердой фазы
в уравнение вводят площадь поверхности этого вещества (S)
пр = k1CАа SВ
Слайд 15Классификация химических реакций по молекулярности и по порядку
Все кинетические реакции
различают по молекулярности и по порядку реакции.
Молекулярность реакции определяется
числом молекул, участвующих в элементарном акте химического взаимодействия. По этому признаку реакции разделяют на мономолекулярные, бимолекулярные и тримолекулярные.
Слайд 16Сложные реакции классифицируют по порядку, то есть, по сумме стехиометрических
коэффициентов при концентрации реагирующих веществ.
В простейшем случае порядок и
молекулярность совпадают.
Например, для реакции окисления NO до NO2 порядок и молекулярность совпадает и равны трем.
Если = k 1С2(NO)С(O2), то порядок равен n = 2 + 1= 3.
Слайд 17Сложные реакции
Сложные реакции описываются кинетическим уравнением, содержащим несколько констант скоростей.
К сложным реакциям относятся обратимые, параллельные, последовательные, сопряженные, цепные и
другие реакции.
Слайд 18Параллельными реакциями называют реакции, которые имеют вид
А В + Д
С + К, т. е. при которых одни и
те же исходные вещества, одновременно реагируя, образуют разные реакции. Например, при разложении бертолетовой соли возможны процессы
6КСlО3 2КСl + О2
3КСlО4 + КCl.
Слайд 19Последовательными называют реакции, которые протекают через ряд последовательных стадий по
схеме
А → В→ С→ D…
Примером служит гидролиз полисахаридов до моносахаридов.
Сопряженными
называют реакции, протекающие по схеме:
А + В → М 1)
А + С → N 2)
Реакция 1) может протекать самостоятельно, а реакция 2) только при наличии реакции 1).
Например, йодоводород окисляется пероксидом водорода только при окислении сульфата железа пероксидом водорода.
Побочный процесс называют химической индукцией, вещество А – актором,
В – акцептором, С – индуктором.
Слайд 20Обратимыми называют реакции, скорость которых равна разности между прямой и
обратной реакцией
реакции = пр - обр
Например, образование сложного эфира.
Цепные реакции протекают путем образования цепи следующих друг за другом реакций, в которых участвуют активные частицы с насыщенными свободными валентностями –свободными радикалами.
В целом скорость сложного процесса зависит от скорости самой медленной стадии, лимитирующей. Чаще всего, по какому механизму протекает самая медленная стадия, таков и механизм процесса в целом. Порядок реакции меняется от 0 до 3 и может быть так целым, так и дробным числом.
Слайд 21Особенности каталитических реакций. Теории катализа
Скорость химической реакции можно регулировать с
помощью катализатора. Вещества, которые участвуют в реакциях и изменяют (чаще
всего увеличивают) ее скорость, оставаясь к концу реакции в первоначальном виде и количестве, называются катализаторами.
Само изменение скорости химической реакции в присутствии катализаторов получило название катализа.
Если от добавления катализатора к реагирующей смеси скорость реакции увеличивается, катализ называют положительным, если же реакция замедляется, то катализ называют отрицательными, а катализатор ингибитором.
Слайд 22Катализаторами могут быть вещества : кислоты, соли, основания, оксиды, металлы,
их атомы, молекулы или ионы, различные органические и органоминеральные соединения,
газообразные вещества.
В ряде случаев - примеси (например, пыль), поверхность стенок сосуда, а также продукты реакции (в этом случае реакция называется автокаталитическая).
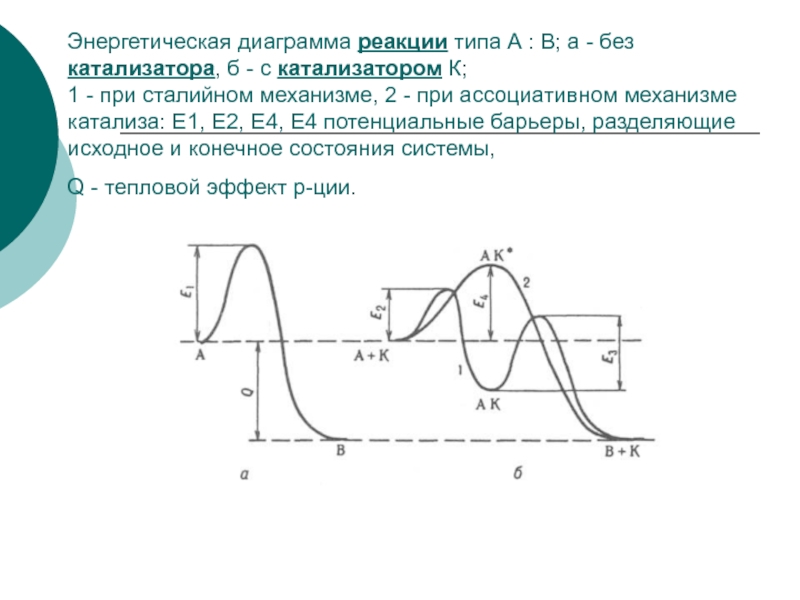
Слайд 23Энергетическая диаграмма реакции типа А : В; а - без
катализатора, б - с катализатором К;
1 - при сталийном
механизме, 2 - при ассоциативном механизме катализа: E1, E2, E4, E4 потенциальные барьеры, разделяющие исходное и конечное состояния системы,
Q - тепловой эффект р-ции.
Слайд 24В ряде случаев присутствие посторонних веществ изменяет действие катализаторов: те
вещества, которые усиливают положительную активность катализаторов, сами по себе являясь
неактивными, называются промоторами или активаторами; те вещества, которые замедляют или практически полностью подавляют действие катализатора, называются каталитическими ядами; существуют вещества, присутствие которых не влияет на активность катализаторов (нейтральные).
Слайд 25На скорость каталитических реакций влияет площадь поверхности катализатора или его
степень дисперсности, температура (обычно увеличивает скорость процесса), давление (для реакций,
идущих с изменением объема, увеличение давления обычно увеличивает скорость), природа растворителя (особенно его полярность).
В настоящее время наиболее распространенными промышленными катализаторами являются Pt, Pd, Rh, Fe, Ni, CuO, RuO2, V2O5, NiO, Fe2O3, ZnO, SiO2, Cr2O3, Al2O3, Al2Cl3, Ag2O, WO3, алюмосиликаты. Их используют при получении аммиака, азотной и серной кислот, метанола, водорода, хлора, этилена и других продуктов химической промышленности.
Слайд 26Обратимые и необратимые реакции. Признаки химического равновесия
Обратимые реакции не доходят
до конца, до полного исчезновения исходных веществ и превращения их
в продукты реакции. Пределом протекания обратимых реакций при заданных условиях является достижение состояния химического равновесия, которое характеризуется следующими основными признаками:
1) в момент химического равновесия скорость протекания прямой реакции равна скорости протекания обратной реакции, а концентрации всех участвующих веществ в этой реакции достигают определенного значения и называются равновесными;
2) химическое равновесие подвижно, т. е. незначительное изменение внешних условий (температуры, давления или концентрации) приводит к сдвигу химического равновесия;
3) к одному и тому же химическому равновесию можно подойти с двух сторон: осуществляя процесс слева направо и наоборот;
4) в момент достижения химического равновесия запас свободной энергии минимален, а энтропия достигает своего максимального значения, изменение этих функций будет равно нулю (F = 0 или G = 0, S = 0).
Слайд 27Константа химического равновесия
Рассмотрим обратимую химическую реакцию общего вида, в которой
все вещества находятся в одном агрегатном состоянии, например, жидком: аA
+ вB сC + dD,
где A и B – исходные вещества прямой реакции; C и D – продукты прямой реакции; а, в, с, и d – стехиометрические коэффициенты.
В начальный момент времени, когда концентрация веществ A и B наибольшая, скорость прямой реакции также будет наибольшей и по закону действующих масс равна
пр = k1CАаCВв
где k1 – константа скорости прямой реакции.
Слайд 28Скорость обратной реакции и она будет равна
обр = k2CCсCDd
(6.2)
где k2 – константа скорости обратной реакции. В момент равновесия пр = обр,
k1CАаCВв = k2CCсCDd (6.3)
Перенесем константы скорости в одну сторону, а концентрации в другую:
(6.4)
Слайд 29Отношение двух постоянных величин есть величина постоянная, и называется она
константой химического равновесия:
Константа равновесия показывает во сколько раз скорость
прямой реакции больше или меньше скорости обратной реакции.
Константа равновесия – это отношение произведения равновесных концентраций продуктов реакции, взятых в степени их стехиометрических коэффициентов к произведению равновесных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов.
Слайд 30Величина константы равновесия зависит от природы реагирующих веществ и температуры,
и не зависит от концентрации в момент равновесия, поскольку их
отношение – всегда величина постоянная, численно равная константе равновесия.
Если гомогенная реакция идет между веществами в растворе, то константа равновесия обозначается KС, а если между газами, то KР.
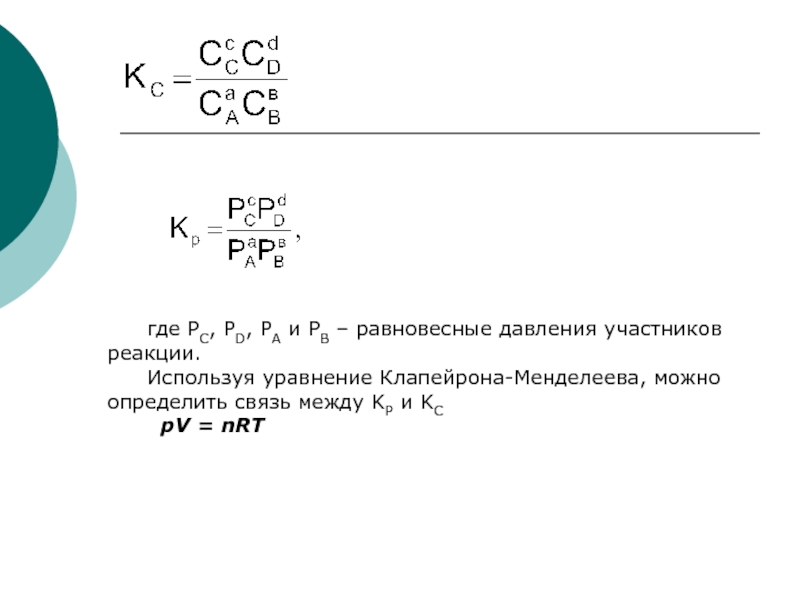
Слайд 31где РС, РD, РА и РВ – равновесные давления участников
реакции.
Используя уравнение Клапейрона-Менделеева, можно определить связь между KР и KС
рV = nRT
Слайд 32где n – изменение числа молей газообразных участников реакции
n = (с + d) – (а + в)
(6.11)
KР = КС(RT)n (6.12)
Например, константа равновесия для реакции вида 2А + 3В = С + 4D, при условии, что все вещества газы и имеет вид
а если D – твердое, то
Слайд 33Константа равновесия имеет большое теоретическое и практическое значение. Численное значение
константы равновесия позволяет судить о практической возможности и глубине протекания
химической реакции.
Если K > 1, то данная реакция протекает со значительным выходом продуктов реакции; если K > 104, то реакция необратима;
если K < 1, то такая реакция нетехнологична; если K < 10-4, то такая реакция невозможна.
Зная константу равновесия, можно определить состав реакционной смеси в момент равновесия и рассчитать константу выхода продуктов реакции. Константу равновесия можно определить, используя экспериментальные методы, количественный состав реакционной смеси в момент равновесия, или применяя теоретические расчеты. Для многих реакций при стандартных условиях константа равновесия – это табличная величина.
Слайд 34Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье
При воздействии на систему
происходит смещение химического равновесия, т. е. изменяются равновесные концентрации веществ.Влияние
факторов на смещение химического равновесия отражает принцип Ле-Шателье (1884):
если на систему, находящуюся в устойчивом химическом равновесии воздействовать извне, изменяя температуру, давление или концентрацию, то химическое равновесие смещается в том направлении, при котором этот эффект уменьшается.
Катализатор не смещает химическое равновесие, а только ускоряет его наступление.
Слайд 35Рассмотрим влияние каждого фактора на смещение химического равновесия для реакции
общего вида:
аA + вB = сC + dD Q.
Влияние
изменения концентрации. Согласно принципу Ле-Шателье, увеличение концентрации одного из компонентов равновесной химической реакции приводит к сдвигу равновесия в сторону усиления той реакции, при которой происходит химическая переработка этого компонента. И наоборот. Схематично можно записать:
CА или CВ
CС или CD
CА или CВ
CС или CD
Слайд 36Влияние температуры. Общее правило, определяющее влияние температуры на равновесие, имеет
следующую формулировку: повышение температуры способствует сдвигу равновесия в сторону эндотермической
реакции (- Q); понижение температуры способствует сдвигу равновесия в сторону экзотермической реакции (+ Q).
+Q Т ; Т ;
-Q Т ; Т
Слайд 37Влияние давления. Давление оказывает заметное влияние на смещение только тех
равновесных реакций, в которых участвуют газообразные вещества, и при этом
изменение числа молей газообразных участников реакции (n) не равно нулю.
При увеличении давления равновесие смещается в сторону той реакции, которая сопровождается образованием меньшего количества молей газообразных веществ, а при понижении давления – в сторону образования большего количества молей газообразных веществ.
при n = 0 Р не влияет;
при n <0 Р, Р;
при n >0 Р , Р