Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ХИМИЧЕСКАЯ СВЯЗЬ
Содержание
- 1. ХИМИЧЕСКАЯ СВЯЗЬ
- 2. Химическая связь - взаимодействие между атомами, приводящее
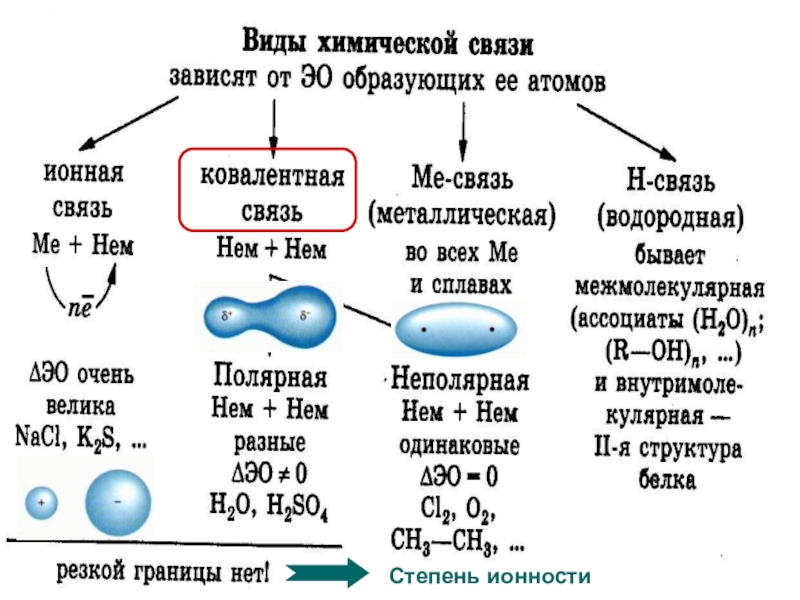
- 3. Степень ионности
- 4. Термодинамика процесса образования химической связиПроцесс самопроизвольный,
- 5. Слайд 5
- 6. Изменение потенциальной энергии в системе из двух
- 7. Характеристики ковалентной связи1) Длина связи – расстояние
- 8. Характеристики некоторых ковалентных связейhttp://rsmu.ru
- 9. Теории химической связиМетод валентных связей (ВС)Метод молекулярных
- 10. Механизмы образования ковалентной связиОбменныйДонорно-акцепторный
- 11. Свойства ковалентной связи1) Направленность: связь атомов осуществляется
- 12. Насыщаемость ковалентной связиЧисло химических связей, которые образует
- 13. Направленность ковалентной связи: σ- и π-связи http:// www.chemistry.ssu.samara.ru
- 14. Гибридизация атомных орбиталейАтом, взаимодействуя с несколькими одинаковыми
- 15. Основные положения теории гибридизацииГибридизуются орбитали атома, реализующего
- 16. Образование молекулы ВеН2
- 17. sp2sp3
- 18. Тип гибридизации и пространственная конфигурация молекул
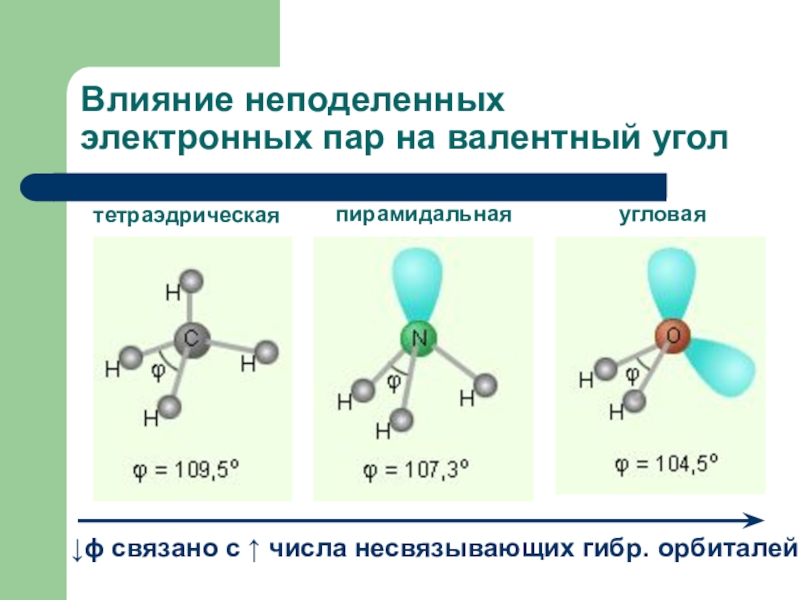
- 19. Влияние неподеленных электронных пар на валентный уголтетраэдрическаяпирамидальнаяугловая
- 20. Полярность ковалентной связи. Дипольный момент связи и
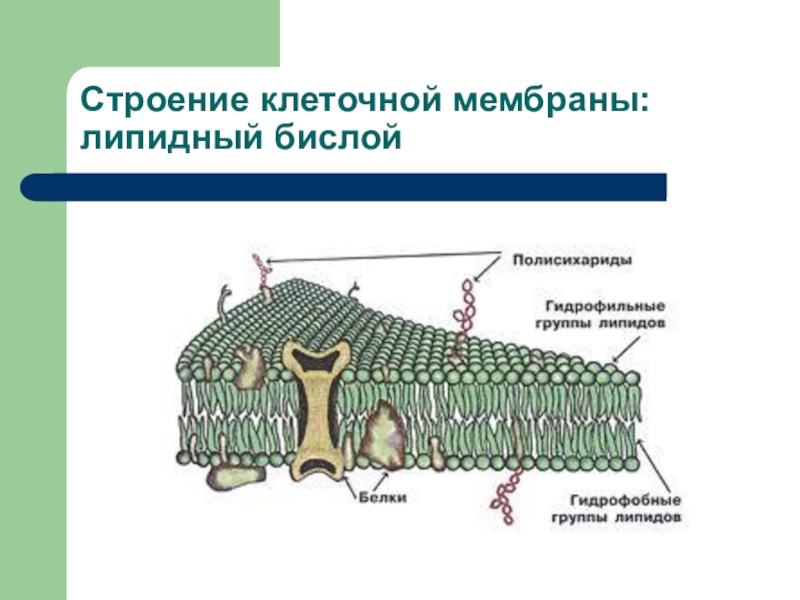
- 21. Строение клеточной мембраны: липидный бислой
- 22. Метод молекулярных орбиталей
- 23. Метод молекулярных орбиталейИмеются различные варианты ММО. Наиболее
- 24. Образование связывающей ММО Образование разрыхляющей ММО
- 25. Энергетическая диаграмма АО атомов и МО двухатомных
- 26. Возможно ли существование Не2 ?
- 27. Уровни энергии МО элементов 2-ого периода (начало периода) (заселение МО указано для В2)
- 28. σsσs*σx*σxπyπzπy*
- 29. Слайд 29
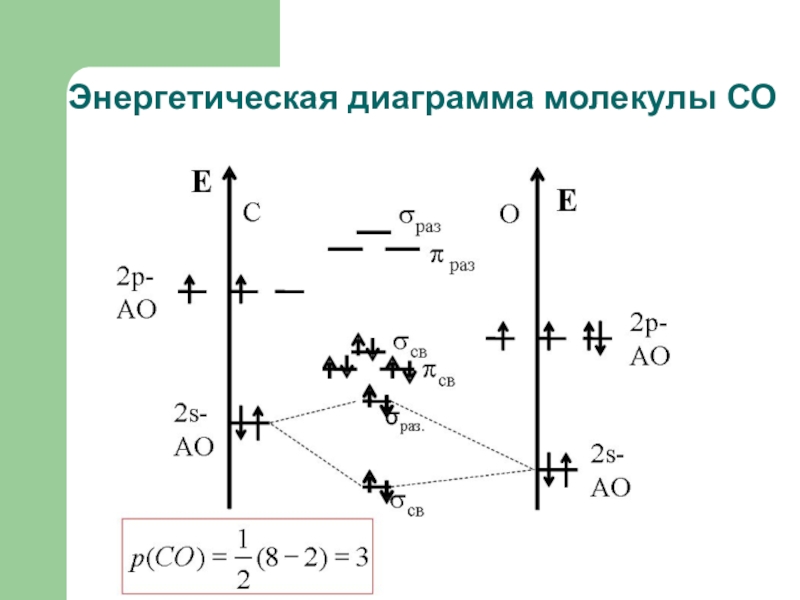
- 30. Энергетическая диаграмма молекулы СО
- 31. Диамагнетики и парамагнетикиНаличие спаренных или неспаренных электронов
- 32. Анализ схем МО позволяет сделать ряд выводовУдаление
- 33. Сравнительная характеристика методов: ВС и МОВС достоинства:
- 34. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2 Химическая связь - взаимодействие между атомами, приводящее к образованию устойчивой
системы - молекулы, иона, кристалла
атомами, возникающая за счёт образования общих электронных парСлайд 4Термодинамика процесса образования химической связи
Процесс самопроизвольный, т.е. ∆ G
S2 ∆S < 0
Т∆S < 0,
а это не способствует образованию ХСОсновной причиной образования химических связей между атомами с образованием молекулы является понижение полной энергии системы при переходе от свободных атомов к молекуле
∆ G < 0 только если ∆Н < 0
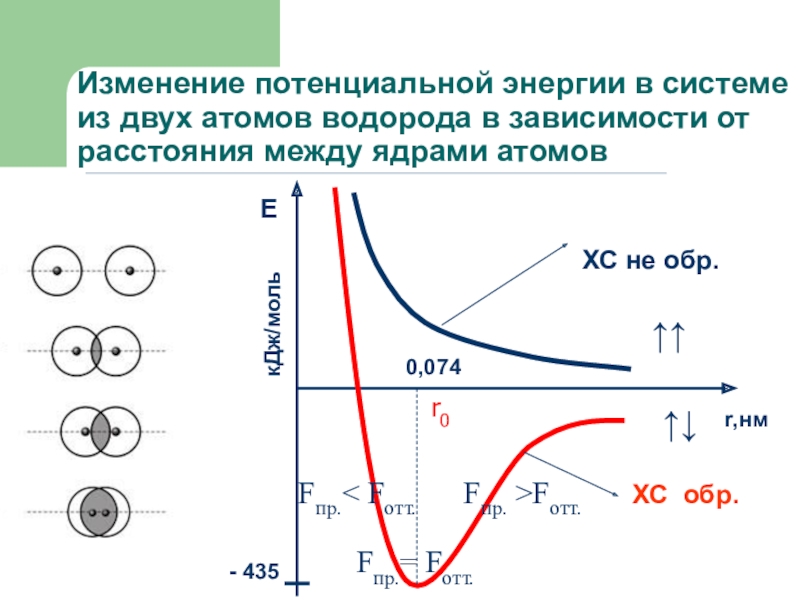
Слайд 6Изменение потенциальной энергии в системе из двух атомов водорода в
зависимости от расстояния между ядрами атомов
Слайд 7Характеристики ковалентной связи
1) Длина связи – расстояние между центрами связанных
атомов
2) Валентный угол – угол между двумя связями, имеющими общий
атом3) Ковалентный радиус – половина длины ковалентной связи между атомами
4) Энергия связи – энергия, выделяющаяся при образовании химической связи и характеризующая ее прочность
(200-1000 кДж/моль)
5) Энергия диссоциации – энергия, необходимая для гомолитического расщепления отдельной связи в молекуле (для двухатомных молекул равна энергии связи)
Гомолитическое расщепление:
Разъединение пары электронов, осуществляющих ковалентную связь
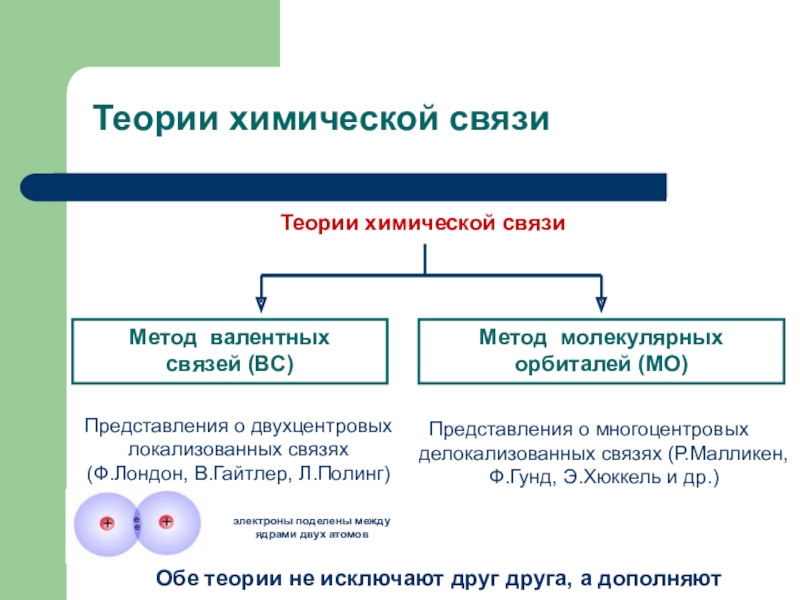
Слайд 9Теории химической связи
Метод валентных
связей (ВС)
Метод молекулярных
орбиталей (МО)
Представления о
двухцентровых локализованных связях
(Ф.Лондон, В.Гайтлер, Л.Полинг)
Представления о многоцентровых делокализованных связях
(Р.Малликен, Ф.Гунд, Э.Хюккель и др.)Обе теории не исключают друг друга, а дополняют
Теории химической связи
электроны поделены между ядрами двух атомов
Слайд 11Свойства ковалентной связи
1) Направленность: связь атомов осуществляется в том направлении,
в котором обеспечивается максимальное перекрывание орбиталей
2) Насыщаемость: способность атомов образовывать
ограниченное число ковалентных связей3) Полярность: результат неравномерного распределения электронной плотности
4) Дипольный момент связи (μ): векторная величина, характеризующая полярность связи
μ [D, Кл·м]
1D = 3,4·10-30 Кл·м
Слайд 12Насыщаемость ковалентной связи
Число химических связей, которые образует атом, определяет его
валентность в данном соединении
С≡О
Макс. валентность атома зависит от положения элемента
в ПС:II период – макс. валентность не более IV
Слайд 14Гибридизация атомных орбиталей
Атом, взаимодействуя с несколькими одинаковыми партнерами, образует равнопрочные
связи с участием электронов разных уровней.
Кроме того, углы между связями
в подобных многоатомных молекулах не те, которые следовало бы ожидать из пространственного расположения взаимодействующих АО. Пример: в H2O – 104,5º, в NH3 – 107,3º, в CH4 – 109,28º Для объяснения этих противоречий в теорию введено представление о гибридизации АО, т.е. о перемешивании орбиталей с различными квантовыми числами и получением гибридных АО.
Гибридизация атомных орбиталей – изменение формы и энергии орбиталей атома при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей
Слайд 15Основные положения теории гибридизации
Гибридизуются орбитали атома, реализующего связи с другими
атомами
Гибридизуются АО с близкой энергией
Число гибридных орбиталей равно суммарному числу
исходных орбиталейГибридизация сопровождается изменением формы электронных облаков, поэтому хим. связи с участием гибр. орбиталей обладают большей прочностью, чем связи с “чистыми” АО
Гибридизация атомных орбиталей возможна лишь для атомов, образующих химические связи, но не для свободных атомов!
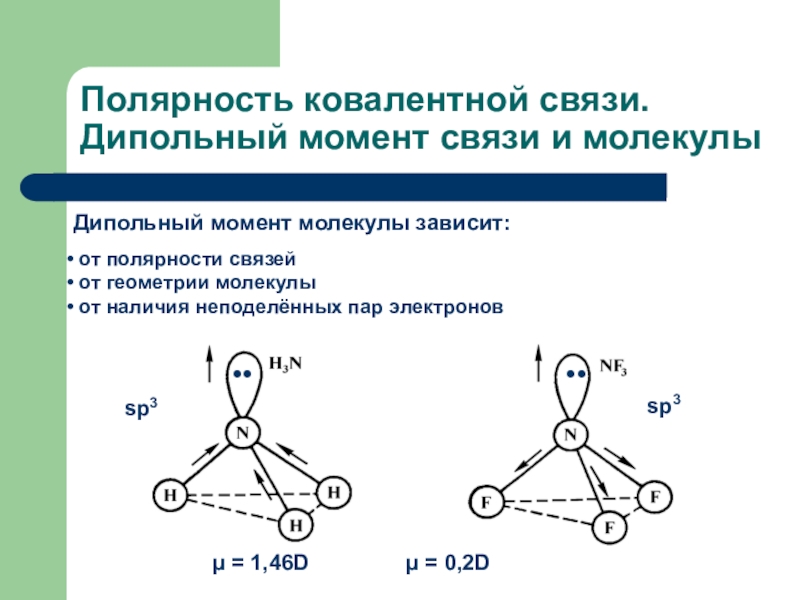
Слайд 20Полярность ковалентной связи. Дипольный момент связи и молекулы
Дипольный момент молекулы
зависит:
от полярности связей
от геометрии молекулы
от наличия
неподелённых пар электронов●●
●●
sp3
sp3
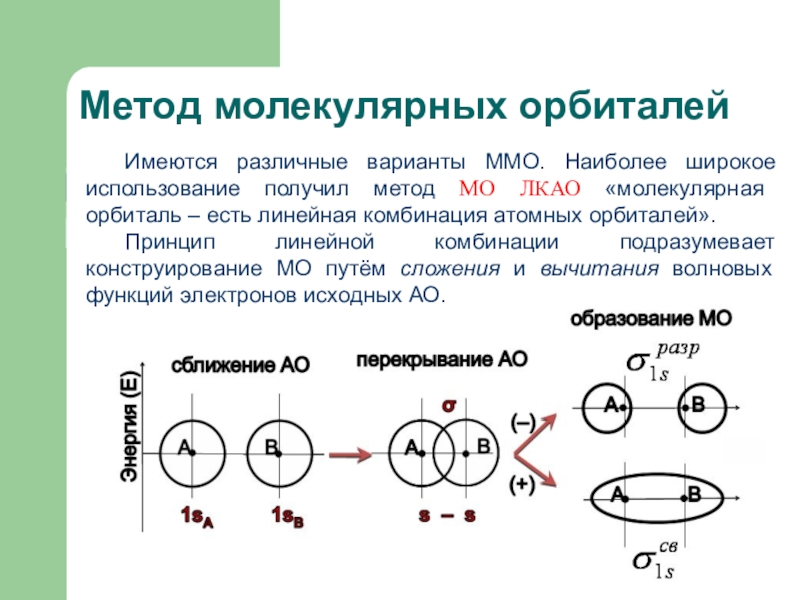
Слайд 23Метод молекулярных орбиталей
Имеются различные варианты ММО. Наиболее широкое использование получил
метод МО ЛКАО «молекулярная орбиталь – есть линейная комбинация атомных
орбиталей».Принцип линейной комбинации подразумевает конструирование МО путём сложения и вычитания волновых функций электронов исходных АО.
Слайд 25Энергетическая диаграмма АО атомов и МО двухатомных молекул элементов первого
периода
|ψ+|2 = | ψA + ψB |2 = ψA2 +
2ψAψB + ψB2 |ψ_|2 = | ψA - ψB |2 = ψA2 - 2ψAψB + ψB2
Линейная комбинация двух s-орбиталей (молекула Н2) даёт столько же молекулярных орбиталей МО в виде:
ψ+ = с1ψ1 + с2ψ2 и ψ– = с1ψ1 – с2ψ2,
ψ+ - связывающая МО – (волновая функция - при сложении исходных АО )
ψ– - разрыхляющая МО – (волновая функция- при вычитании исходных АО)
Порядок связи
Слайд 28σs
σs*
σx*
σx
πy
πz
πy* πz*
2р
2s
АОN
Энергетическая диаграмма АО
атомов и МО двухатомных молекул
элементов 2-ого периода (конец периода)
Слайд 31Диамагнетики и парамагнетики
Наличие спаренных или неспаренных электронов в атомах, молекулах
и кристаллах устанавливается экспериментально путем изучения магнитных свойств вещества. Если
вещество выталкивается из внешнего неоднородного магнитного поля, то атомы этого вещества называют диамагнитными. Если вещество втягивается во внешнее неоднородное магнитное поле, то атомы этого вещества называют парамагнитными. Диамагнитные свойства вызваны движением спаренных электронов, а парамагнитные – движением неспаренных электронов. Чем больше у атома неспаренных электронов, тем в большей степени проявляется парамагнетизм у вещества.Слайд 32Анализ схем МО позволяет сделать ряд выводов
Удаление электрона со связывающей
орбитали уменьшает энергию связи в молекулярном ионе (N2+ и N2),
а удаление электрона с разрыхляющей орбитали приводит к увеличению энергии связи в молекулярном ионе в сравнении с молекулой (О2+ и О2).Потенциал ионизации молекулы (IЭ2) больше потенциала ионизации атома (IЭ), если в молекуле верхний заполненный уровень – связывающий. И наоборот, IЭ2 меньше, чем IЭ, если верхний заполненный уровень – разрыхляющий. Например, IN2 = 15,58 эВ, а IN = 14,53 эВ, но I02 = 12,08 эВ, а I0 = 13,62 эВ.
Схема МО легко объясняет наличие неспаренных электронов, а, следовательно, парамагнетизм таких частиц, как молекулы В2 и О2 и молекулярных ионов Н2+ и Не2+ .
ММО позволяет объяснить окраску соединений. При возбуждении и переносе электронов с заполненной на свободную МО происходит поглощение энергии. Если эта энергия лежит в видимой части спектра, то вещество окрашено в дополнительный к поглощенному излучению цвет.
Слайд 33Сравнительная характеристика
методов: ВС и МО
ВС
достоинства:
нагляден; описывает геометрию молекул
недостатки:
не рассматривает вклад неспаренных электронов в образовании связи (природу
связи в частице Н2+); не может объяснить магнитные свойства вещества (например парамагнитные свойства О2)
МО
достоинства:
общий подход при описании всех молекул
недостатки:
ненагляден;
не объясняет геометрии молекул