Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химия
Содержание
- 1. Химия
- 2. Лекция 1.
- 3. Основные элементы его теории строения атомаВсе тела
- 4. Сторонником атомизма был Платон, который считал, что атомы
- 5. Сущность строения атома доказана фундаментальными открытиями, сделанными
- 6. Первое открытие основывалось на изучении лучей, испускаемых
- 7. В 1895 г. исследования Ж. Перрена (1870–1942)
- 8. В 1895 г. Конрад Вильгельм
- 9. В 1896 г. Антуан Анри Беккерель показал,
- 10. В последующие несколько лет исследования радиоактивности продолжили
- 11. Состав атомаЭлектроны: заряд 1,6·10-19 Кл (-1) условно.Масса
- 12. Изото́пы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов какого-либо химического элемента, которые имеют одинаковый
- 13. В химии часто используют термин нуклид, обозначающийатом
- 14. В Периодической таблице указаны средние атомные массы
- 15. Модели атома
- 16. в 1904 г Ханатаро Нагаока1902 году Ульям
- 17. В 1904 г. Томсон Д.Д. развил идею
- 18. Модель РезерфордаЭ. Резерфорд исследовал особенности прохождения альфа-частиц
- 19. Постулаты Боракаждый электрон в атоме может совершать
- 20. Бор предположил, что энергия электрона в атоме
- 21. В1925–1926гг. Началась эра волновой механики, составившей основу
- 22. В 1927 г. Вернер Карл Гейзенберг сформулировал
- 23. Итак, рождение квантово-механической модели обусловлено тремя особенностями микромира
- 24. Состояние электрона в атоме - это информация
- 25. Квантовые числаГлавное квантовое число (n) принимает значения
- 26. Орбитальное квантовое число (ℓ) определяет геометрическую форму
- 27. Спиновое квантовое число. Значения спинового квантового числа
- 28. 1) При составлении электронных формул следует производить
- 29. Правило ХундаАбсолютное значение суммарного спинового числа электронов
- 30. Е1 уровень1s2 уровень2s2р3s3р3d4sHHe3 уровень4 уровеньLiBeBCNOFNeNaMg AlSiPSCl ArKCaScTiVCrMnFeCoNiCuZn1s11s21s22s22p63s23p51s22s22p63s23p63d64s2
- 31. Слайд 31
- 32. Периодическая система и строение атома
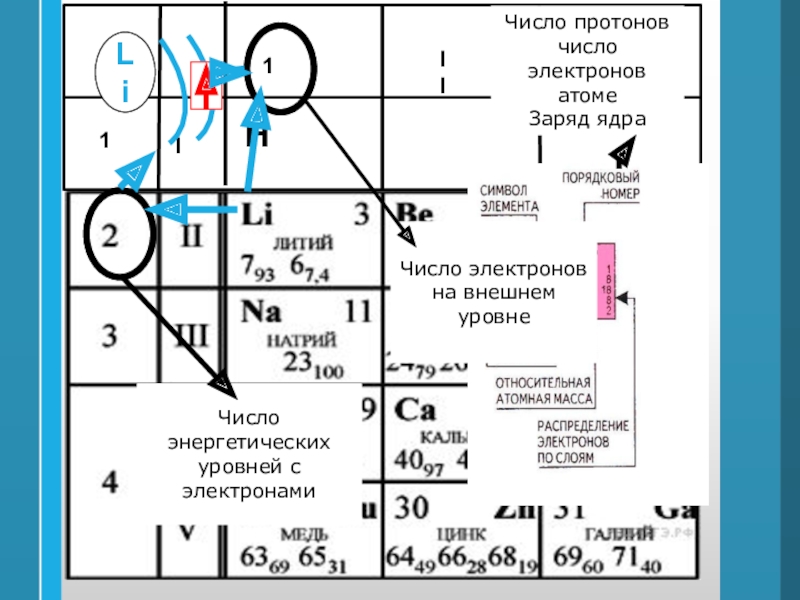
- 33. Число протоновчисло электронов атоме Заряд ядраЧисло энергетических уровней с электронамиLiЧисло электронов на внешнем уровне
- 34. 841421s22s22p63s23p2
- 35. Свойства элементов, а также свойства их соединений,
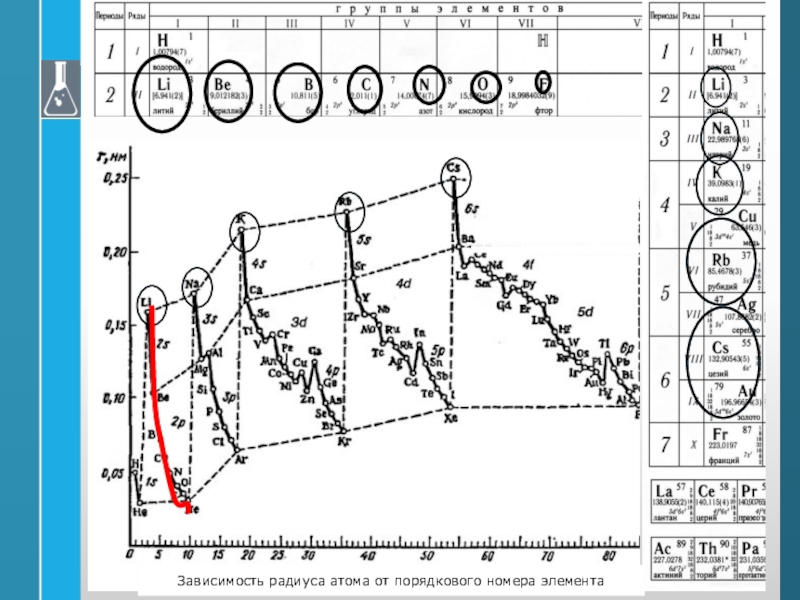
- 36. Свойства атомов1) Радиус атома2) Энергия ионизации (I)
- 37. Зависимость радиуса атома от порядкового номера элемента
- 38. Ве2s2pN2s2pNe
- 39. В свете современных представлений причина периодичности в
- 40. Радиус атомов уменьшаетсяРадиус атома увеличиваетсяЭнергия ионизации атомов увеличиваетсяЭнергия ионизации атома уменьшаетсяЭлектроотрицательность атомов увеличиваетсяэлектроотрицательность атома уменьшается
- 41. Металлические свойства атомов:Большой радиусНизкая энергия ионизации (легко
- 42. Периодически изменяются не только свойства элементов, но
- 43. Свойства оксидов и гидроксидовОсновные оксиды и гидроксидыКислотные оксиды и гидроксидыАмфотерные оксиды и гидроксиды
- 44. ВеMgCaSrВaВеОВе(ОН)2MgОMg(ОН)2CaОCa(ОН)2SrОSr(ОН)2ВaОВa(ОН)2амфотерныйСлабое основаниеСильное основаниеОсновный характер гидроксидов усиливается
- 45. NPAsN2О5HNO3N2О5H3PO4As2О5H3AsO4Очень СлабаякислотаслабаякислотасильнаякислотаКислотный характер гидроксидов ослабевает
- 46. MgAlSiPNaSClMgOAl2O3SiO2P2O5Na2OSO3Cl2O7Mg(OH)2Al(OH)3H2SiO3H3PO4NaOHH2SO4HClO4Сильное основаниеСлабоеоснованиеАмфотерный гидроксидОчень слабаякислотаСлабаякислотаСильнаякислотаОчень сильнаякислотаОсновный характер гидроксидов ослабеваетКислотный характер гидроксидов усиливается
- 47. Выводы о взаимосвязи строения атомов и свойств
- 48. Спасибо за внимание
- 49. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2 Лекция 1. Современная модель строения атома. Периодическая система и
Периодический закон Д.И. Менделеева
Слайд 3Основные элементы его теории строения атома
Все тела состоят из атомов,
которые неделимы и имеют неизменную форму
Число атомов бесконечно
Атомы обладают разными
выступами, углублениями, крючками, что позволяет им образовать устойчивые соединенияАтомы находятся в постоянном движении
Учение о первоначалах мира последовательно разрабатывается Демокритом, который считал, что бесконечное бытие состоит из невидимых тел по причине их малости эти тела неделимы и поэтому называются атомы
Слайд 4Сторонником атомизма был Платон, который считал, что атомы имеют форму идеальных Платоновских
тел (правильных многогранников).
Одним из наиболее известных натурфилософов-атомистов Древнего Рима был Тит Лукреций
Кар (ок.99 или 95—55 гг. до н.э.)Его философская поэма «О природе вещей» является важным источником сведений об атомистических воззрениях Демокрита
ПЛАТОН
между 429 и 427 до н. э., — 347 до н. э
Слайд 5Сущность строения атома доказана фундаментальными открытиями, сделанными в конце XIX
и начале XX в
Какие же экспериментальные факты свидетельствуют в пользу сложного строения
атома?Слайд 6Первое открытие основывалось на изучении лучей, испускаемых отрицательно заряженным электродом
– катодом, и потому получивших название катодных лучей
В 1858 г.
немецкий физик Юлиус Плюккер (1801—1868) открывает катодные лучи. Он же замечает, что катодные лучи вызывают зеленоватое свечение стеклянных стенок трубки.В 1859 г. немецкие физики Роберт Бунзен (1811—1899) и Густав Кирхгоф (1824—1887), изучая особенности электрического разряда в газах при пониженном давлении, открывают спектральный анализ.
В 1869 г. Иоганн Гитторф (1824—1914), помещает между катодом и анодом внутри трубки препятствие и обнаруживает тень от препятствия, создаваемую катодными лучами.
Юлиус Плюккер
Роберт Бунзен
Густав Кирхгоф
Иоганн Гитторф
Слайд 7В 1895 г. исследования Ж. Перрена (1870–1942) показали, что вызывающие
свечение «катодные лучи» представляют собой отрицательно заряженные частицы, которые движутся
прямолинейно, но могут отклоняться магнитным полем.Томсон Дж.Дж. доказал, что все частицы, образующие катодные лучи, тождественны друг другу и входят в состав вещества. Эти опыты привели к открытию электрона.
в 1887 г. Г. Герц открыл фотоэффект
Первые исследования фотоэффекта были выполнены русским ученым А. Г. Столетовым (1888 г.). и было доказано, что при фотоэффекте испускаются электроны
Генрих Рудольф Герц, 1857 - 1894
Александр Григорьевич
Столетов, 1839- 1896
Слайд 8 В 1895 г. Конрад Вильгельм Рентген открыл X-лучи, названные впоследствии рентгеновскими
лучами
Проводя опыты с катодными лучами, 8 ноября 1895 года К.
Рентген обнаружил слабое свечение экрана, несмотря на то, что вся аппаратура была плотно закрыта черной бумагой.С помощью X-лучей Рентген сфотографировал скелет кисти своей руки и кусочки металла, помещенные в деревянный ящик. Рентген установил такие свойства X-лучей, как высокая проникающая способность, ионизирующее воздействие.
Слайд 9В 1896 г. Антуан Анри Беккерель показал, что соль урана
самопроизвольно испускает невидимое глазу излучение, подобное рентгеновским лучам
"Лучи Беккереля" впоследствии
были подробно изучены супругами Кюри. Самопроизвольное
испускание излучения каким-либо атомом было
названо ими радиоактивностью.
М. Склодовская-Кюри предположила, что причиной
радиоактивности является распад атомов.
Ею были обнаружены два типа излучения, альфа(α)-
и бета(β)-излучением.
Пьер Кюри, 1859-1906
Мария Кюри, 1867-1934
В 1900 г. Пьер Кюри открыл излучение третьего типа,
получившее название гамма(γ)-излучения
Слайд 10В последующие несколько лет исследования радиоактивности продолжили Эрнест Резерфорд и
Фредерик Содди, установившие природу альфа-лучей, представляющих собой поток двузарядных ионов
гелия.Фредерик Содди, 1877-1956
Атомы обладают собственной структурой, имеют сложное строение.
Эрнест Резерфорд,
1871-1937
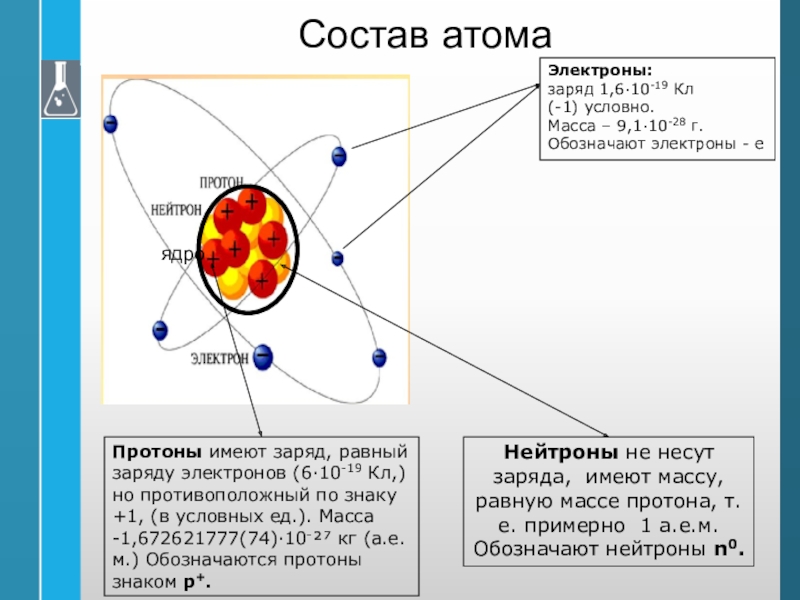
Слайд 11Состав атома
Электроны:
заряд 1,6·10-19 Кл
(-1) условно.
Масса – 9,1·10-28 г.
Обозначают электроны - е
Протоны имеют заряд, равный заряду электронов (6·10-19
Кл,) но противоположный по знаку +1, (в условных ед.). Масса -1,672621777(74)·10⁻²⁷ кг (а.е.м.) Обозначаются протоны знаком р+. Нейтроны не несут заряда, имеют массу, равную массе протона, т. е. примерно 1 а.е.м.
Обозначают нейтроны n0.
ядро
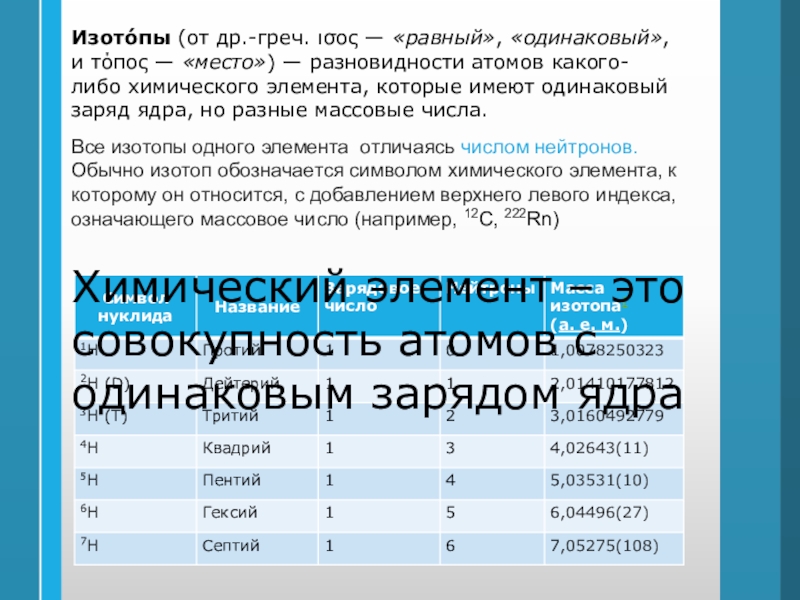
Слайд 12Изото́пы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов какого-либо химического элемента, которые имеют одинаковый заряд ядра, но
разные массовые числа.
Все изотопы одного элемента отличаясь числом нейтронов.
Обычно
изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12C, 222Rn)Химический элемент – это
совокупность атомов с
одинаковым зарядом ядра
Слайд 13В химии часто используют термин нуклид, обозначающий
атом с определенным массовым
числом А, равным сумме числа
протонов Z и нейтронов N.
Изотопы
– это нуклиды одного химического элемента. В отличие от относительной атомной массы, массовое число
– величина целочисленная
Зная заряд ядра атома (порядковый номер элемента) и массовое число, можно установить число нейтронов в ядре данного изотопа, например, хлор-37
Порядковый номер хлора – 17, значит число протонов – 17
По условию, массовое число 37, значит число нейтронов равно разности массового числа и числа протонов:
число нейтронов = 37 – 17 = 20
Определите число нейтронов в ядре атома уран-238:
238 – 92 = 146
Слайд 14В Периодической таблице указаны средние атомные массы химического элемента с
учетом его изотопного состава, например, атомная масса хлора примерно 35,5.
Как возникла эта величина?W 35Cl = 75% W 37Cl = 25%
Ar = Ar 35Cl • 0,75 + Ar 37Cl • 0,25 =
35 • 0,75 + 37 • 0,25 = 26,25 + 9,25 = 35,5
Ar = Ar(1) • W(1) + Ar(2) • W(2) + Ar(3) • W(3)+ + … Ar(i) • W(i)
Задание: определите массовую долю изотопов медь-63 и медь-65, относительную атомную массу принять равной 63,546
Ответ: W 63Cu = 72,7% W 65Cu = 27,3%
Слайд 16в 1904 г Ханатаро Нагаока
1902 году Ульям Томсон
В 1903 г.
Филипп фон Ленард
1901 г. Предложил планетарную
модель строения атома
Слайд 17В 1904 г. Томсон Д.Д. развил идею У. Томсона -
модель атома представляла собой равномерно заряженную положительным электричеством сферу,
внутри которой вращались отрицательно заряженные частицы, число и расположение которых зависело от природы атома.«Пудинг с изюмом»
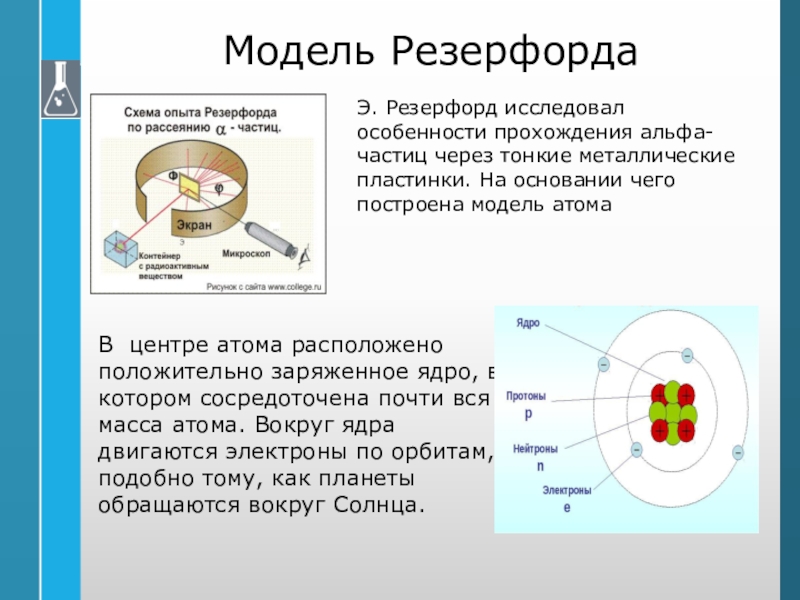
Слайд 18Модель Резерфорда
Э. Резерфорд исследовал особенности прохождения альфа-частиц через тонкие металлические
пластинки. На основании чего построена модель атома
В центре атома расположено
положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Вокруг ядра двигаются электроны по орбитам, подобно тому, как планеты обращаются вокруг Солнца. Слайд 19Постулаты Бора
каждый электрон в атоме может совершать устойчивое движение без
излучения энергии,
каждый электрон в атоме может переходить из одного состояния
в другое, выделяя или поглощая при этом определенную порцию энергииНильс Бор, (1885-1962)
Слайд 20Бор предположил, что энергия электрона в атоме принимает не любые,
а лишь строго фиксированные значения. Эти значения энергии Бор назвал
дискретными или квантовыми уровнями.Каждому такому значению энергии Бор приписал определенное число, которое он назвал квантовым числом.
Электрон может перескакивать с одного уровня на другой, испуская или поглощая при этом определенное, фиксированное количество энергии – квантов энергии.
Электрон на своем энергетическом уровне считается находящимся в основном состоянии.
Электроны переходя на более высокие энергетические уровни считаются находящимися в возбужденных состояниях.
Переход электрона на более высокий энергетический уровень называется возбуждением.
Слайд 21В1925–1926гг. Началась эра волновой механики, составившей основу квантово-механической теории атома.
В
1925 году, когда Луи-Виктор-Пьер-Раймон де Бройль предположил, что все виды материи обладают
как корпускулярными, так и волновыми свойствами, и любой движущийся объект может быть охарактеризован длиной волны и частотой, связанной с его движением Де Бройль предложил рассматривать электрон,
как стоячую волну, которая должна умещаться на
круговой атомной орбите.
В1927 году наличие волновых свойств электрона экспериментально подтвердили опыты Клинтона Джозефа Дэвиссона (совместно с Л. Джермером), а также Джорджа Паджета Томсона. Они обнаружили, что пучок электронов испытывает дифракцию, проходя через кристалл или через металлическую фольгу.
Де Бройль,
1892-1987
Клинтон Джозеф
Дэвиссон
Слайд 22В 1927 г. Вернер Карл Гейзенберг сформулировал принцип, ограничивающий эксперименты
по изучению отдельных событий микромира.
Согласно принципу неопределенности, положение и импульс электрона не
поддаются одновременному определению с абсолютной точностью.Другими словами, чем точнее мы определяем положение микрообъекта, тем большую неопределенность мы получаем в значении его импульса или скорости. Напротив, чем точнее значение скорости движения микрообъекта, тем неопределеннее его положение в пространстве (координаты).
Несмотря на невозможность точного определения положения электрона, можно указать вероятность нахождения электрона в определенном положении в любой момент времени.
Вероятность – это основа характеристики состояния и движения электрона в квантово-механической модели.
При этом из обсуждения принципиально исключаются такие понятия, как траектории движения электронов, подобные орбитам планет.
Слайд 23Итак, рождение квантово-механической модели обусловлено тремя особенностями микромира и происходящих в
нем процессов:
-квантование энергии (энергия микрообъекта
изменяется не непрерывно, а дискретно
- порциями, квантами);- корпускулярно-волновой дуализм микрообъектов (сочетание свойств частицы и волны);
-необходимость вероятностного подхода к
описанию процессов.
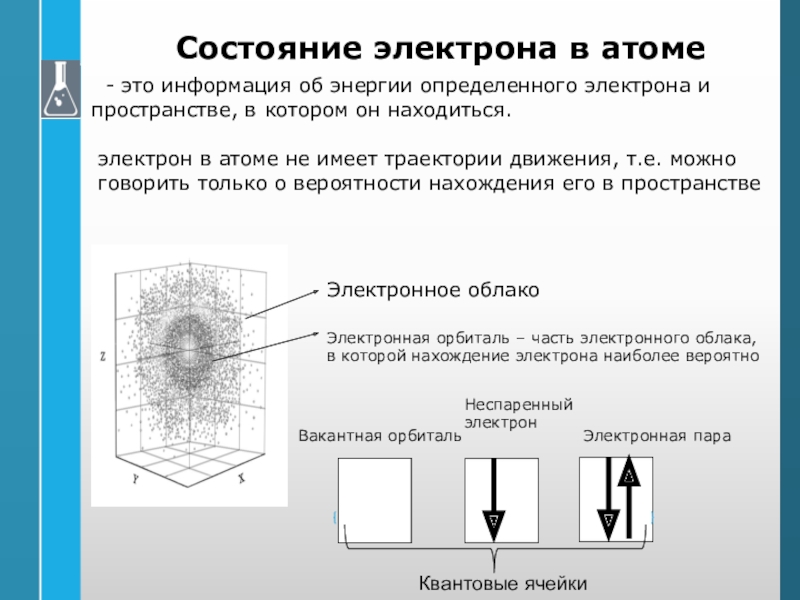
Слайд 24Состояние электрона в атоме
- это информация об энергии определенного
электрона и пространстве, в котором он находиться.
электрон в атоме не
имеет траектории движения, т.е. можно говорить только о вероятности нахождения его в пространстве
Электронное облако
Электронная орбиталь – часть электронного облака,
в которой нахождение электрона наиболее вероятно
Вакантная орбиталь
Неспаренный
электрон
Электронная пара
Квантовые ячейки
Слайд 25Квантовые числа
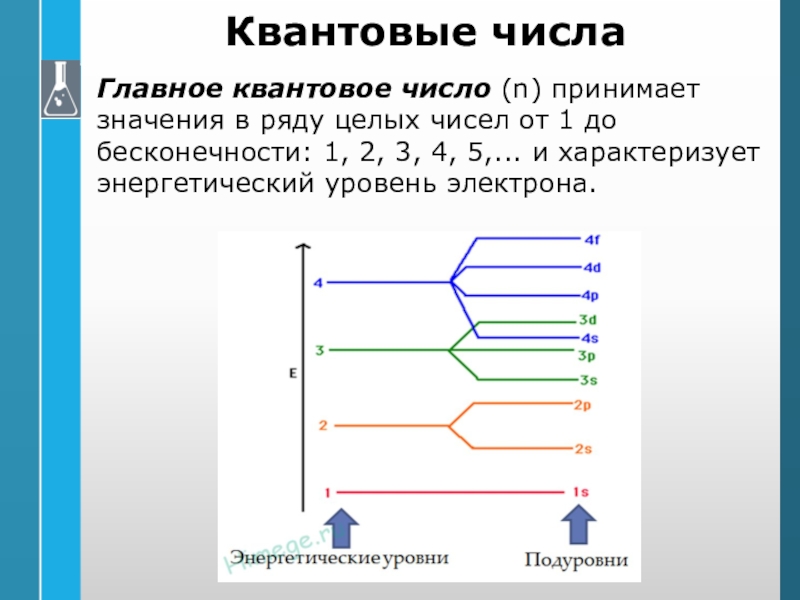
Главное квантовое число (n) принимает значения в ряду целых
чисел от 1 до бесконечности: 1, 2, 3, 4, 5,...
и характеризует энергетический уровень электрона.Слайд 26Орбитальное
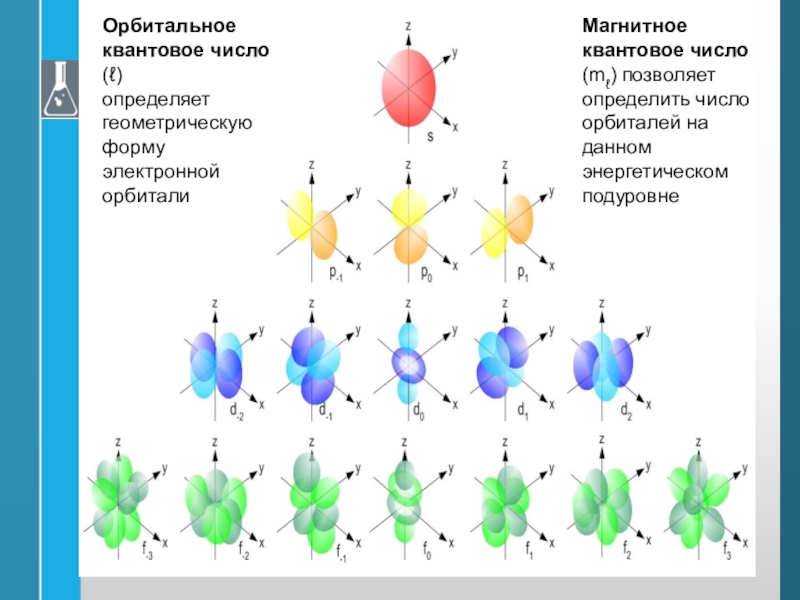
квантовое число (ℓ)
определяет
геометрическую форму
электронной орбитали
Магнитное
квантовое число (mℓ) позволяет определить число орбиталей на данном энергетическом
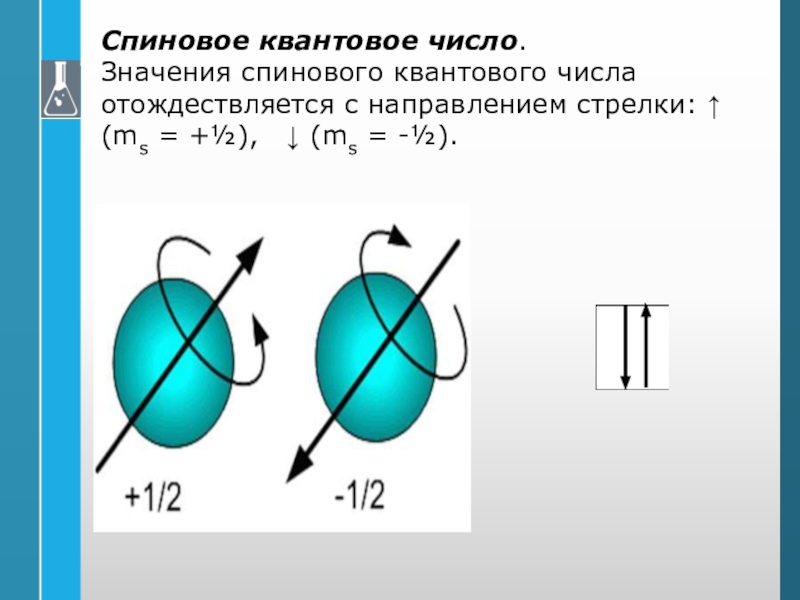
подуровнеСлайд 27Спиновое квантовое число.
Значения спинового квантового числа отождествляется с направлением
стрелки: ↑ (ms = +½), ↓ (ms = -½).
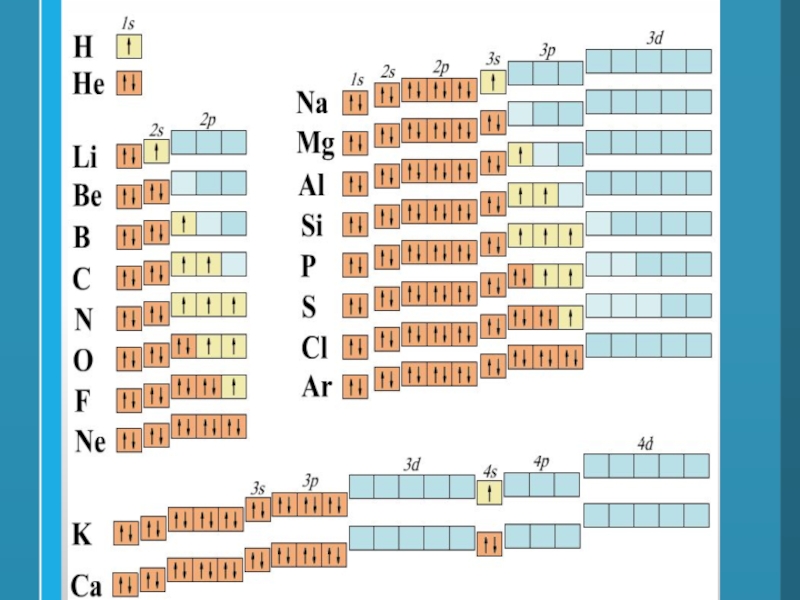
Слайд 281) При составлении электронных формул следует производить заполнение энергетических подуровней
в порядке роста их энергии, низшие по энергии подуровни всегда
заполняются первыми (Принцип наименьшей энергии)2) На одной орбитали может находиться не более двух электронов
3) Если электроны располагаются на одной орбитали, то они имеют разный спин
Принципы заполнения электронами электронных орбиталей
Или
Слайд 29Правило Хунда
Абсолютное значение суммарного спинового числа электронов данного энергетического подуровня
должно быть максимальным.
Фридрих Хунд,
(1896- 1997)
3s
3p
3s
3p
Ʃs = + ½ +
½ + ½ = 1,5 Ʃs = + ½ -½ + ½ = 0,5
Слайд 30Е
1 уровень
1s
2 уровень
2s
2р
3s
3р
3d
4s
H
He
3 уровень
4 уровень
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
1s1
1s2
1s22s22p63s23p5
1s22s22p63s23p63d64s2
Слайд 33Число протонов
число электронов атоме
Заряд ядра
Число энергетических уровней с электронами
Li
Число
электронов на внешнем уровне
Слайд 35Свойства элементов, а также свойства их соединений, находятся в периодической
зависимости от зарядов атомных ядер
Периодический закон
Слайд 36Свойства атомов
1) Радиус атома
2) Энергия ионизации (I) – это энергия,
необходимая для отрыва электрона от атома.
3) Энергия сродства к
электрону (E) – энергия, которая выделяется при присоединении к атому одного электрона4) Электроотрицательность - способность атома в молекуле притягивать к себе электроны связи.
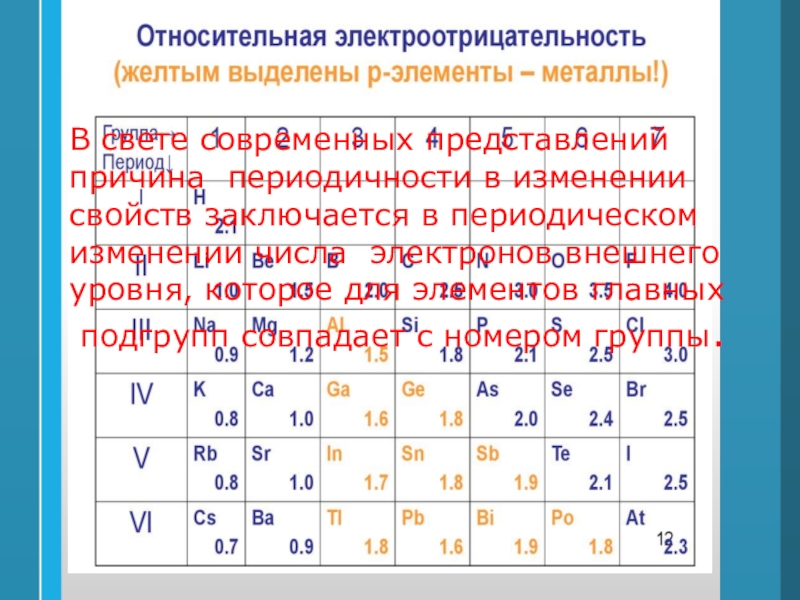
Слайд 39В свете современных представлений
причина периодичности в изменении
свойств заключается
в периодическом
изменении числа электронов внешнего
уровня, которое для элементов
главныхподгрупп совпадает с номером группы.
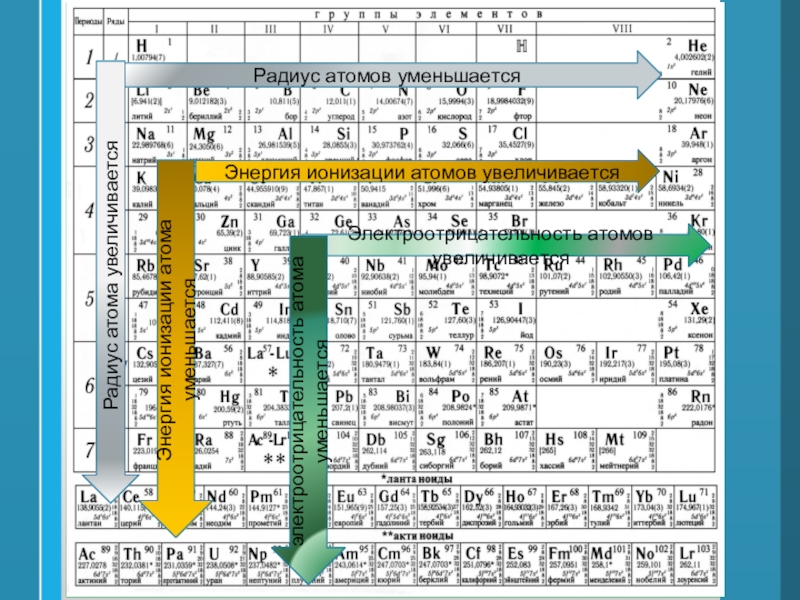
Слайд 40Радиус атомов уменьшается
Радиус атома увеличивается
Энергия ионизации атомов увеличивается
Энергия ионизации атома
уменьшается
Электроотрицательность атомов увеличивается
электроотрицательность атома уменьшается
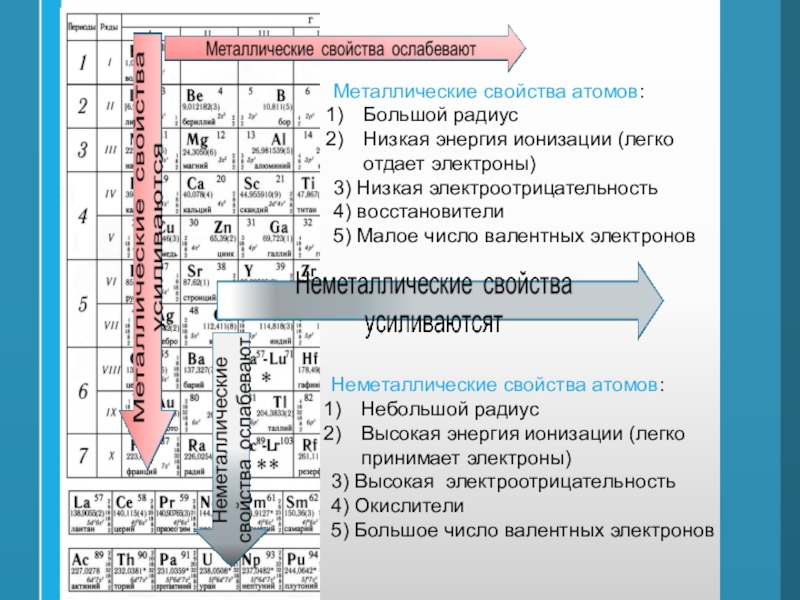
Слайд 41Металлические свойства атомов:
Большой радиус
Низкая энергия ионизации (легко отдает электроны)
3) Низкая
электроотрицательность
4) восстановители
5) Малое число валентных электронов
Неметаллические свойства атомов:
Небольшой радиус
Высокая энергия
ионизации (легко принимает электроны)3) Высокая электроотрицательность
4) Окислители
5) Большое число валентных электронов
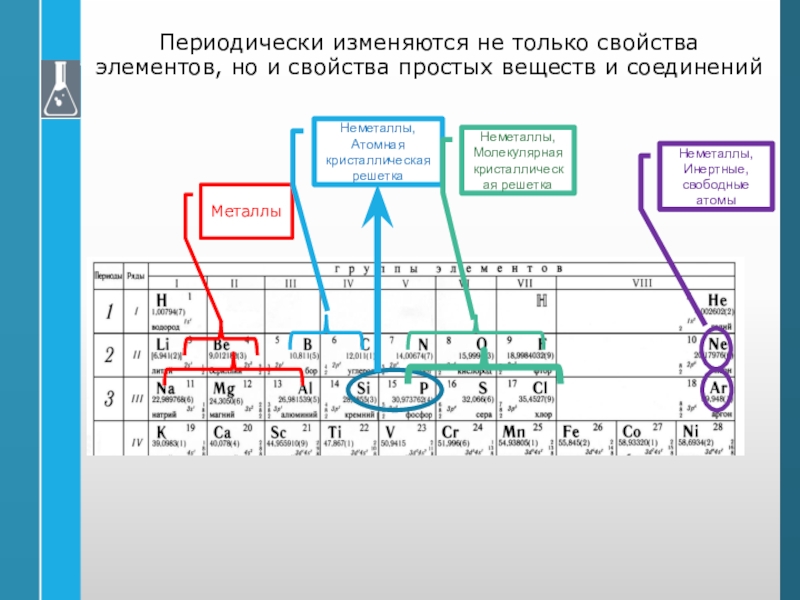
Слайд 42Периодически изменяются не только свойства элементов, но и свойства простых
веществ и соединений
Металлы
Неметаллы,
Атомная кристаллическая решетка
Неметаллы,
Молекулярная кристаллическая решетка
Неметаллы,
Инертные, свободные атомы
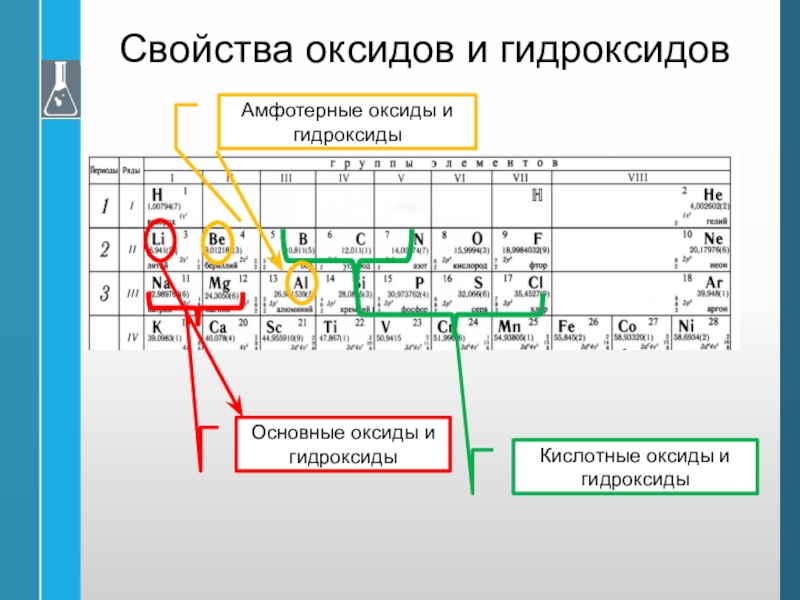
Слайд 43Свойства оксидов и гидроксидов
Основные оксиды и гидроксиды
Кислотные оксиды и гидроксиды
Амфотерные
оксиды и гидроксиды
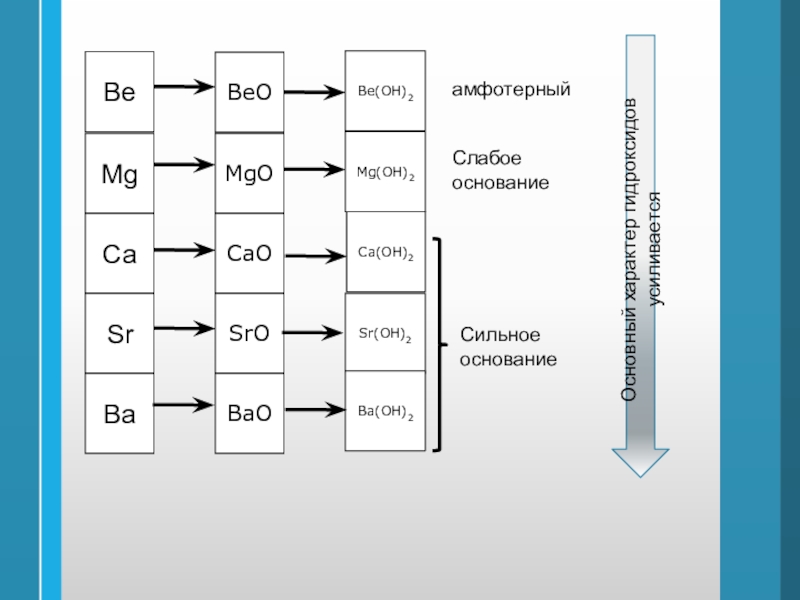
Слайд 44Ве
Mg
Ca
Sr
Вa
ВеО
Ве(ОН)2
MgО
Mg(ОН)2
CaО
Ca(ОН)2
SrО
Sr(ОН)2
ВaО
Вa(ОН)2
амфотерный
Слабое
основание
Сильное
основание
Основный характер гидроксидов усиливается
Слайд 45N
P
As
N2О5
HNO3
N2О5
H3PO4
As2О5
H3AsO4
Очень
Слабая
кислота
слабая
кислота
сильная
кислота
Кислотный характер гидроксидов ослабевает
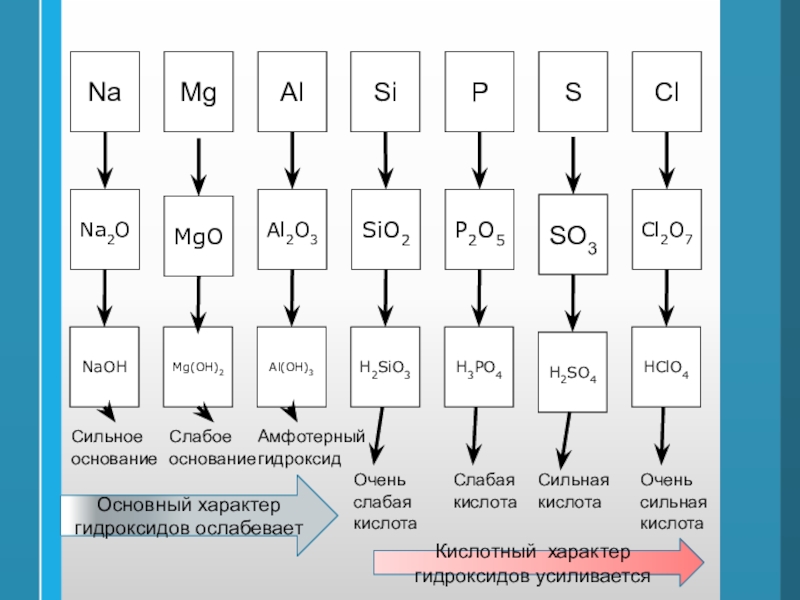
Слайд 46Mg
Al
Si
P
Na
S
Cl
MgO
Al2O3
SiO2
P2O5
Na2O
SO3
Cl2O7
Mg(OH)2
Al(OH)3
H2SiO3
H3PO4
NaOH
H2SO4
HClO4
Сильное
основание
Слабое
основание
Амфотерный
гидроксид
Очень
слабая
кислота
Слабая
кислота
Сильная
кислота
Очень
сильная
кислота
Основный характер гидроксидов ослабевает
Кислотный характер гидроксидов
усиливается
Слайд 47Выводы о взаимосвязи строения атомов и свойств химических элементов, а
также причины периодического изменения их свойств, сходства и различия между
ними1) свойства химических элементов, расположенных в порядке возрастания заряда ядра, изменяются периодически потому, что периодически повторяется сходное строение внешнего электронного слоя атомов элементов
2) плавное изменение свойств элементов в пределах одного периода можно объяснить постепенным увеличением числа электронов на внешнем уровне атома
3) завершение внешнего электронного уровня атома приводит к резкому скачку в свойствах, при переходе от галогена к инертному элементу и от инертного элемента к щелочному металлу;
4) свойства химических элементов, принадлежащих к одному семейству, сходны потому, что на внешнем электронном слое их атомов одинаковое число электронов.