Слайд 2Соединения Pb4+
Pb(OAc)2 + CaOCl2 + H2O = PbO2↓+ CaCl2 +
2HOAc
PbO2 + H2SO4 конц. = Pb(SO4)2 + 2H2O (Гидролиз!)
Сильный окислитель:
PbO2
+ 4HCl = PbCl2 + Cl2 + 2H2O
Плюмбаты:
PbO2 тв + CaO тв = CaPbO3 (мета) – нагрев
Ca2PbO4 (орто)
В растворах [Pb(OH)6]2–
Слайд 3Соединения Э2+ (Э = Ge, Sn, Pb)
Ox-Red свойства
Уменьшение
восстановительных свойств в ряду Ge–Sn–Pb (для Э2+)
Соединения Sn2+ – удобные
мягкие восстановители
Кислотно-основные свойства
ЭО и Э(ОН)2 – амфотерные, но с преобладанием основных свойств
Для ЭО и Э(ОН)2 основные св-ва в ряду Ge–Sn–Pb увеличиваются
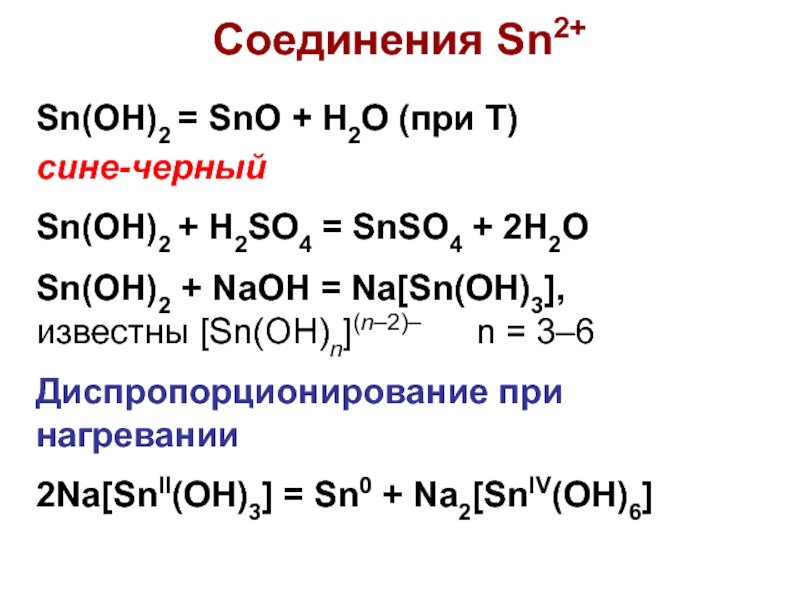
Слайд 4Соединения Sn2+
Sn(OH)2 = SnO + H2O (при Т)
сине-черный
Sn(OH)2 +
H2SO4 = SnSO4 + 2H2O
Sn(OH)2 + NaOH = Na[Sn(OH)3],
известны
[Sn(OH)n](n–2)– n = 3–6
Диспропорционирование при нагревании
2Na[SnII(OH)3] = Sn0 + Na2[SnIV(OH)6]
Слайд 5Растворимые соли SnX2:
X = Cl, Br, I, NO3, ½SO4
Гидролиз:
Sn2+ + H2O = Sn(OH)+ + H+
Комплексообразование:
SnCl2 + Cl–
конц. = [SnCl3]–
(пирамидальное строение, донор эл. пары:
[PtCl3(SnCl3)]2–, [PtCl2(SnCl3)2]2– и др.)
Соединения Sn2+
Слайд 6Соединения Pb2+
PbO – красный (α, < 490 ºС) или желтый
(β, > 490 ºС)
2Pb + O2 = 2PbO (в расплаве
свинца)
PbO2 = PbO + ½O2 (при Т)
PbO2 (290-320 ºС) Pb2O3 (390-420 ºС) Pb3O4 (530-550 ºС) РbO
PbO + 2AcOH = Pb(OAc)2 + H2O
Pb(OH)2 + 2HCl = PbCl2 + 2H2O
Pb(OH)2 + 2NaOH = Na2[Pb(OH)4]
Растворимые в воде соли:
Pb(NO3)2, Pb(OAc)2 – свинцовый сахар.
Нерастворимые в воде соли:
PbX2 (X = F, Cl, Br, I, ½SO4, ½S, ½СО3…)
Слайд 7Примеры Ox-Red
Sn2+ – удобный мягкий восстановитель
2MnO4– + 5Sn2+ +
16H+ = 2Mn2+ +5Sn4+ + 8H2O
2MnO4– + [Sn(OH)3]– + 3OH–
= 2MnO42– + [Sn(OH)6]2–
PbO2 сильный окислитель, особенно в кислой среде
5PbO2 + 2Mn2+ + 4H+ = 5Pb2+ + 2MnO4– + 2H2O
4PbO2 тв. + H2Sгаз = PbSO4 + 3PbO + H2O (воспламенение)
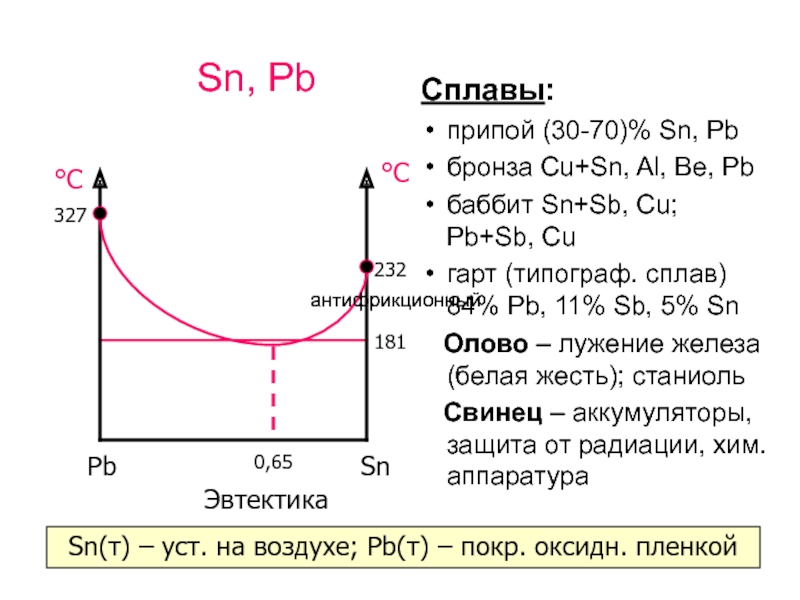
Слайд 8Sn, Pb
Сплавы:
припой (30-70)% Sn, Pb
бронза Cu+Sn, Al, Be, Pb
баббит
Sn+Sb, Cu; Pb+Sb, Cu
гарт (типограф. сплав)
84% Pb, 11% Sb, 5% Sn
Олово – лужение железа (белая жесть); станиоль
Свинец – аккумуляторы, защита от радиации, хим. аппаратура
181
232
327
Эвтектика
0,65
Sn(т) – уст. на воздухе; Pb(т) – покр. оксидн. пленкой
антифрикционный
антифрикционный
Слайд 11Распространенность в земной коре и минералы
В – 28 место, 9·10–4
мас.%
H3BO3 – сассолит, Na2B4O7.10H2O – бура,
Na2B4O7.4H2O – кернит, боросиликаты.
Al
– 3 место (з. кора, 7,5 мас.%) или 8 место (з. шар, 1,5 мас.%)
xAl(OH)3.yAlO(OH) – бокситы – основной источник Al,
Al2O3.2SiO2.2H2O – каолинит,
Na3K[AlSiO4] – алюмосиликаты,
Al2O3 – корунд (рубин и сапфир),
Na3[AlF6] – криолит
Слайд 12Ga – редкий и рассеянный, 4,6·10–4 мас.%, примерно 60-70 место,
CuGaS2 – галлит,
сопутствует Al в бокситах
In – редкий и рассеянный,
2·10–6 мас.%, примерно 70-75 место, примесь к сульфидным рудам
Tl – редкий и рассеянный, 8·10–7 мас.%, примерно 75-80 место, примесь к сульфидным рудам, сопутствует K в алюмосиликатах
Распространенность в земной коре и минералы
Слайд 13Открытие элементов
B – 1808 г., фр. Гей-Люссак и Тенар.
B2O3
+ 6K = 2B + 3K2O , от лат. Borax
– бура.
Al – 1825 г., дат. Эрстед,
AlCl3 + 3K(Hg) = Al + 3KCl + Hg
от лат. Alumen или Alumin – квасцы
Ga – предсказан Менделеевым в 1871 г., открыт фр. Лекок де Буабодран в 1875 г.,
в честь Франции, лат. Gallia.
In – 1863 г., нем. Рейх и Рихтез, от синей краски индиго (две синие линии в спектре руд)
Tl – 1861 г., анг. Крукс, от гр. «таллос» – молодая зеленая ветвь (зеленая линия в спектре отходов производства серной кислоты)
Слайд 14Элементы IIIА-группы
Общая электронная формула:
[…] ns 2 (n –1)d 10
np 1
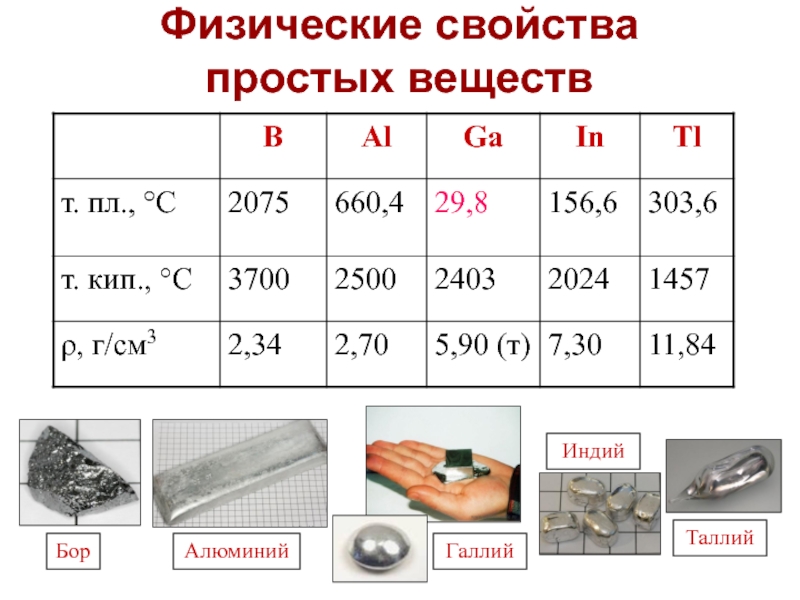
Слайд 15Физические свойства
простых веществ
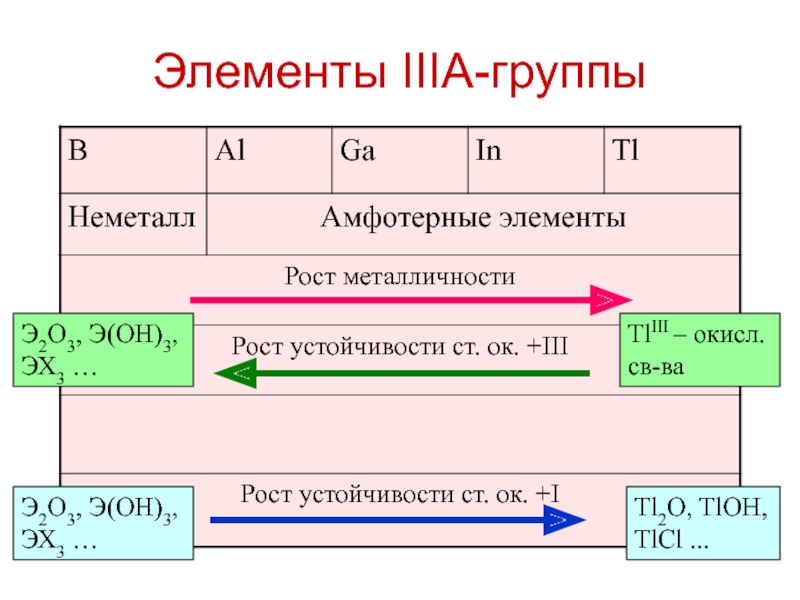
Слайд 16Элементы IIIA-группы
Tl2O, TlOH, TlCl ...
TlIII – окисл. св-ва
Э2O3, Э(OH)3,
ЭХ3 …
Э2O3, Э(OH)3, ЭХ3 …
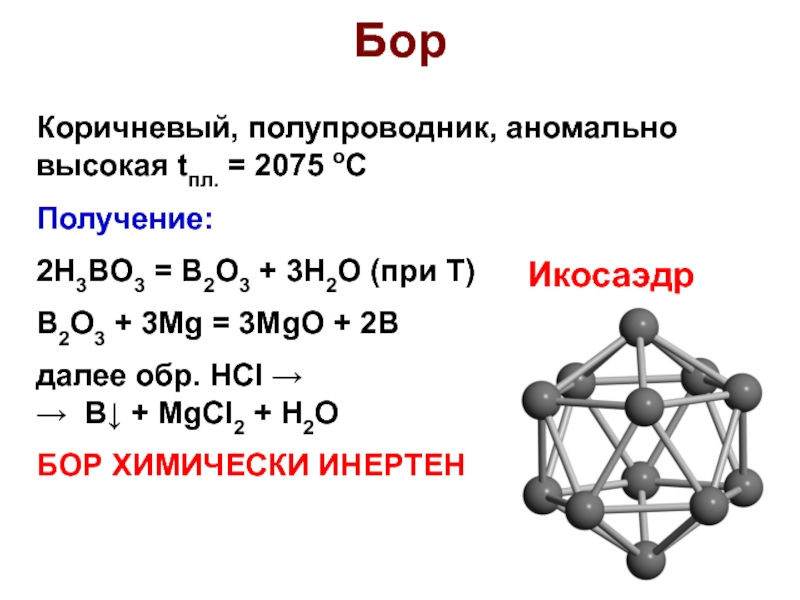
Слайд 17Бор
Коричневый, полупроводник, аномально высокая tпл. = 2075 оС
Получение:
2H3BO3 = B2O3
+ 3H2O (при Т)
B2O3 + 3Mg = 3MgO + 2B
далее
обр. НСl →
→ B↓ + MgCl2 + H2O
БОР ХИМИЧЕСКИ ИНЕРТЕН
Икосаэдр
Слайд 18Бор
[H+]: H3BO3 + 3H+ + 3e = B + 3H2O
E0 = –0,87 B
[OH–]: [B(OH)4]– + 3e = B
+ 4OH– E0 = –1,79 B
Кинетические затруднения, нет реакции с водой ниже 100 oC
2B + 3H2O = B2O3 + 3H2 (800oC)
2B + 3X2 = 2BX3 (X = F, Cl, Br, I)
4B + 3O2 = 2B2O3 (горение)
2B + N2 = BN (1200оС)
B + 3HNO3 (к.) = H3BO3 + 3NO2 (нагрев)
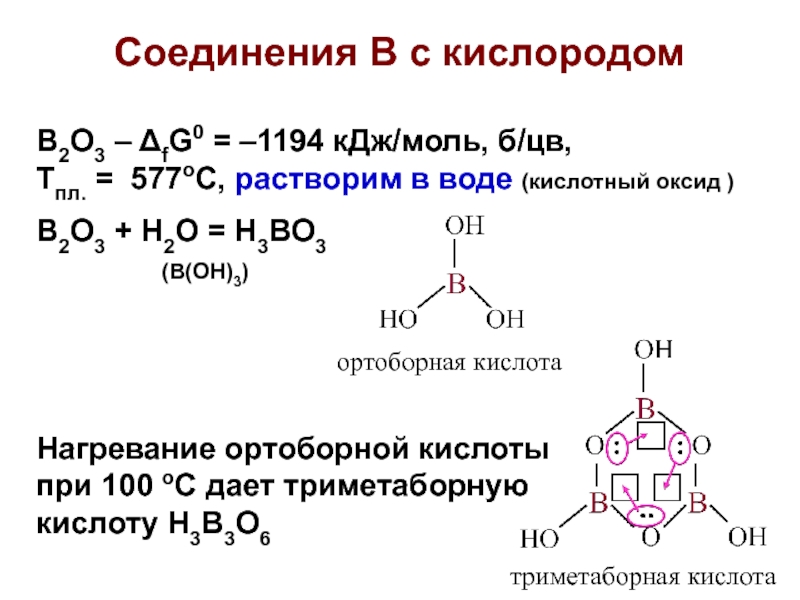
Слайд 19Соединения В с кислородом
B2O3 – fG0 = –1194 кДж/моль, б/цв,
Тпл. = 577оС, растворим в воде (кислотный оксид )
B2O3 +
H2O = H3BO3
(B(OH)3)
Нагревание ортоборной кислоты
при 100 oC дает триметаборную
кислоту H3B3O6
триметаборная кислота
ортоборная кислота
Слайд 20Борная кислота – H3BO3
ОДНООСНОВНАЯ И СЛАБАЯ, pKa = 9,2
B(OH)3 +
2H2O = H3O+ + [B(OH)4]– – солей с таким анионом
мало, есть тетрабораты (M2B4O7 ) и метабораты (MBO2).
4H3BO3 + 2NaOH = Na2B4O7 + 7H2O
Na2B4O7 + H2SO4(р-р) + 5H2O = 4H3BO3 + Na2SO4
OH–
4H3BO3 + 2OH– B4O72– + 7H2O
H+
Слайд 21Тетраборат натрия Na2B4O7·10H2O (бура)
Na2B4O7 + 2H2O = 2Na+ + [B4O72–
· 2H2O] (диссоциация и гидратация)
Слайд 22Получение H3BO3
BCl3 + 3H2O = B(OH)3 + 3HCl
(лаб.)
Na2B4O7 + H2SO4 + 5H2O =
= 4B(OH)3 +
Na2SO4 (лаб., пром.)
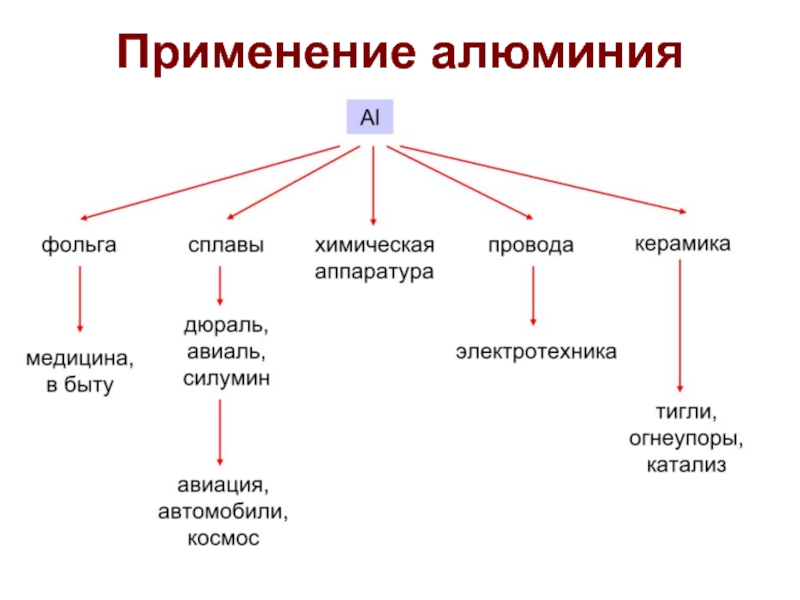
Слайд 23Al – получение алюминия
Промышленное получение алюминия:
Электролиз раствора Al2O3 (10%)
в расплаве (962 oC) криолита Na3[AlF6]:
на катоде – Al (жидкий,
Тпл. = 660 оС)
на аноде – O2 (CO и CO2 за счет окисления угольных электродов)
Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в 20 веке.
Для производства 1 т алюминия требуется 1,9 т глинозёма и 18 тыс. кВт·ч электроэнергии!!!
Такое количество электричества потребляет большой 150-квартирный дом в течение целого месяца.
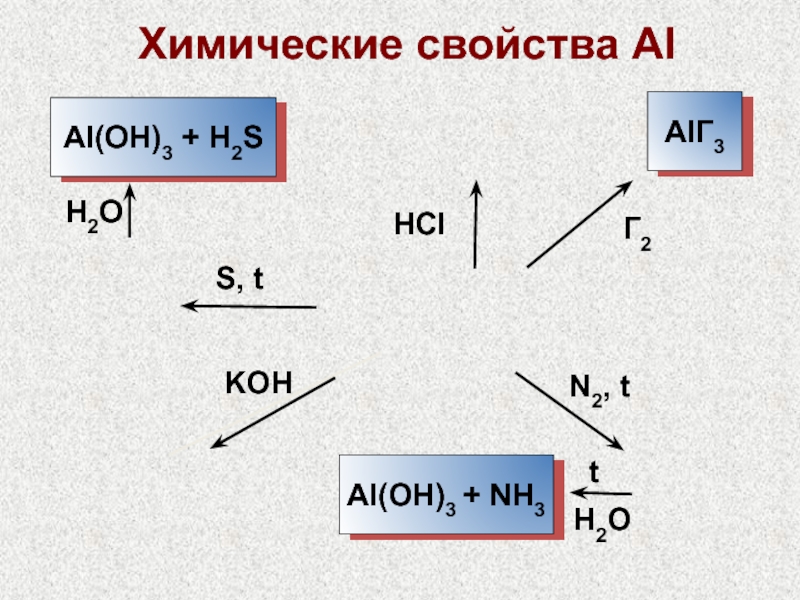
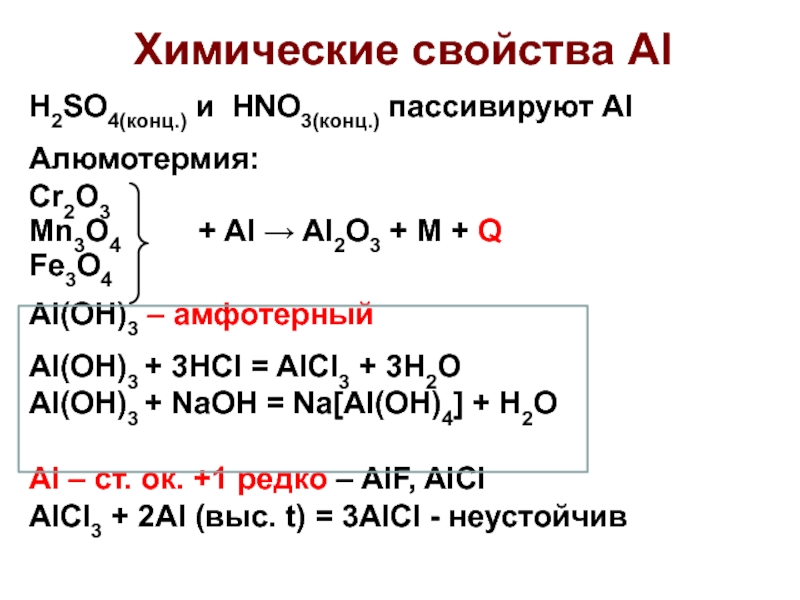
Слайд 26Химические свойства Al
H2SO4(конц.) и HNO3(конц.) пассивируют Al
Алюмотермия:
Cr2O3
Mn3O4
+ Al → Al2O3 + M + Q
Fe3O4
Al(OH)3 –
амфотерный
Al(OH)3 + 3НСl = AlCl3 + 3H2O
Al(OH)3 + NaOH = Na[Al(OH)4] + H2O
Al – ст. ок. +1 редко – AlF, AlCl
AlCl3 + 2Al (выс. t) = 3AlCl - неустойчив
Слайд 27 ОКСИД АЛЮМИНИЯ
Al2O3 – корунд, сапфир, рубин…
Минералы различаются лишь наличием
различных примесей, благодаря которым камни обретают тот или иной цвет.
Чистый корунд бесцветен, окись хрома дарует камню все оттенки красного цвета, титан способен окрасить минерал в синий цвет, а окись железа придает кристаллам желтый оттенок.
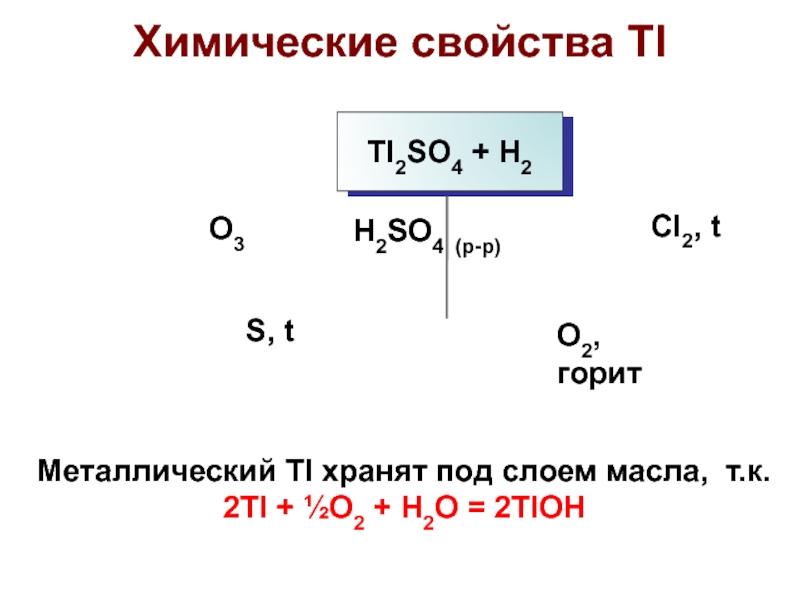
Слайд 30Химические свойства Tl
4Tl + O2 = 2Tl2O
2Tl + O3 =
Tl2O3
2Tl + Cl2 = 2TlCl
2Tl + H2SO4 = Tl2SO4 +
H2
2Tl + S = Tl2S
Активный металл,
Tl1+ – наиболее устойчивая степень окисления
Слайд 31Металлический Tl хранят под слоем масла, т.к.
2Tl + ½O2 +
H2O = 2TlOH
Химические свойства Tl
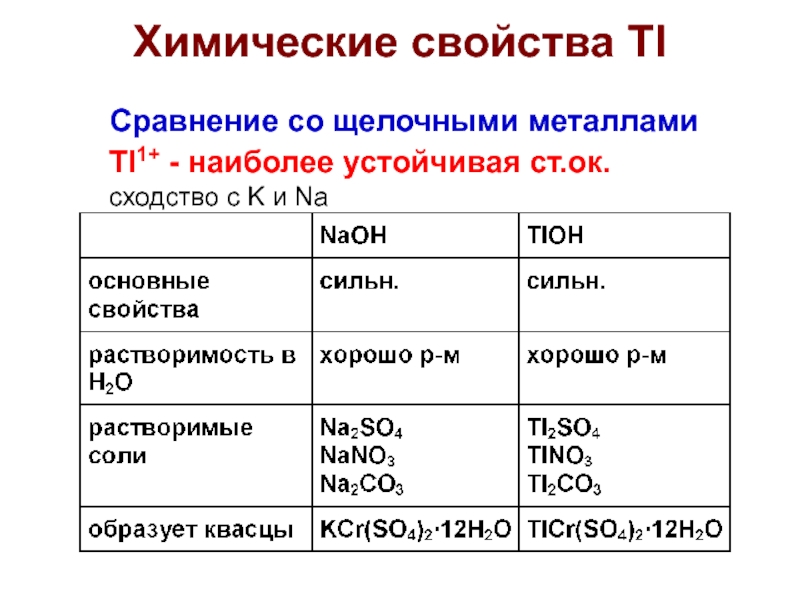
Слайд 32Сравнение со щелочными металлами
Tl1+ - наиболее устойчивая ст.ок.
сходство с K
и Na
Химические свойства Tl
Слайд 33Сходство с побочной п/гр. I гр.
Нерастворимые в воде галогениды и
сульфиды
AgГ, Ag2S TlГ, Tl2S
Галогениды таллия светочуствительны:
подобно галогенидам серебра
разлагаются
Все соединения талия – сильные яды!!!
Tl3+ – сильный окислитель
TlIIICl3 → TlICl + Cl2 ( выше 40 ºC)
Существует TlI3 (аналог NaI3), т.е. Tl1+I–·I2
Химические свойства Tl
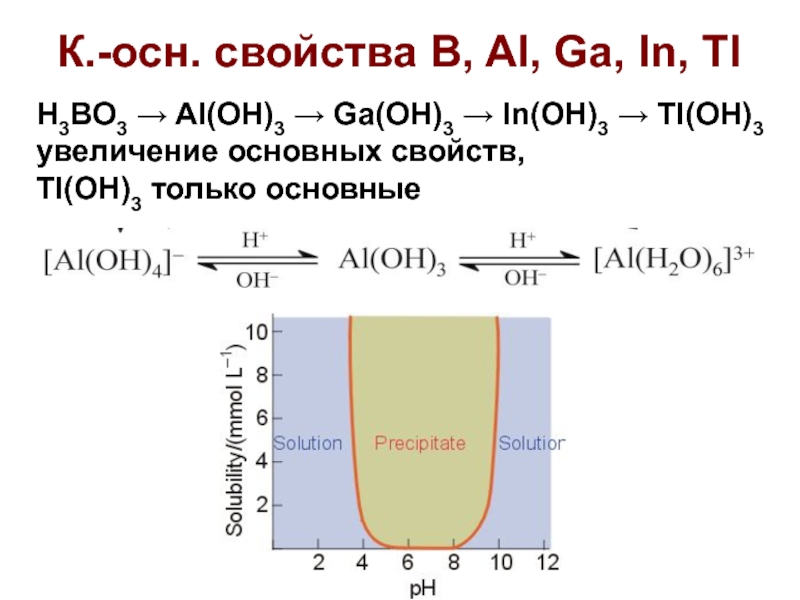
Слайд 34К.-осн. свойства B, Al, Ga, In, Tl
H3BO3 → Al(OH)3 →
Ga(OH)3 → In(OH)3 → Tl(OH)3 увеличение основных свойств,
Tl(OH)3 только
основные
Слайд 37
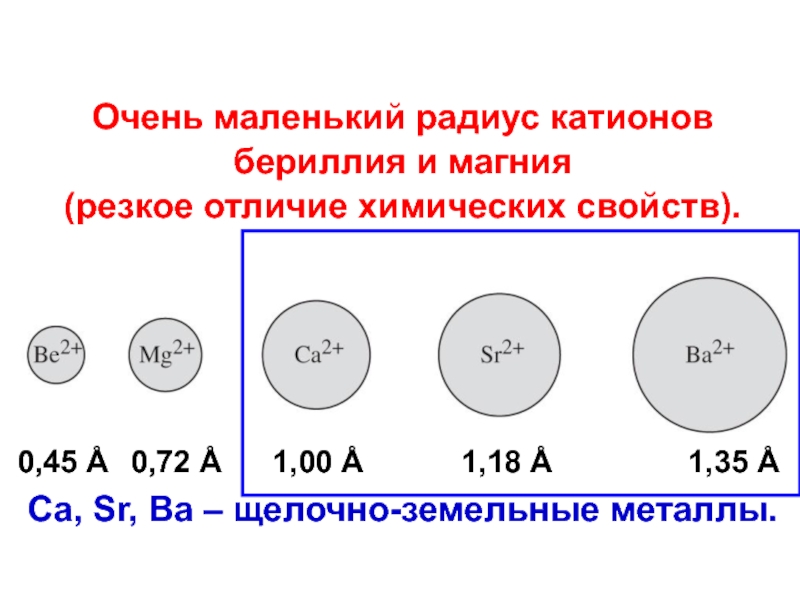
Очень маленький радиус катионов
бериллия и магния
(резкое отличие химических
свойств).
Ca, Sr, Ba – щелочно-земельные металлы.
0,45 Å
0,72 Å
1,00
Å
1,18 Å
1,35 Å
Слайд 38Распространенность и минералы
Be – 48 место; 3BeO.Al2O3.6SiO2 (берилл: изумруд, аквамарин
и др.)
Mg – 7 место; 2KCl.MgCl2.6H2O (карналлит), MgCO3.CaCO3 (доломит)
Ca –
5 место; CaCO3 (кальцит),
CaF2 (флюорит), CaSO4.2H2O (гипс)
берилл
кальцит
Слайд 39Sr – 19 место; SrCO3 (стронцианит)
Ba – 17 место; BaSO4(барит),
BaCO3(витерит)
Ra
– радиоактивен; в урановых рудах
Распространенность и минералы
Слайд 40Открытие элементов
Be – 1798 г., фр. Воклен, от минерала берилл
(впервые выделен в 1828 г. фр. Бюсси)
Mg – 1808 г.,
анг. Дэви, от названия города Магнезия, в окрестностях которого имеются залежи минерала магнезита MgCO3
Ca – 1808 г., анг. Дэви, лат. calx – известь
Sr – 1808 г., анг. Дэви, от стронцианит
Ba – 1808 г., анг. Дэви, гр. «барис» тяжелый
Ra – 1898 г., супруги Кюри,
лат. «радиус» – луч
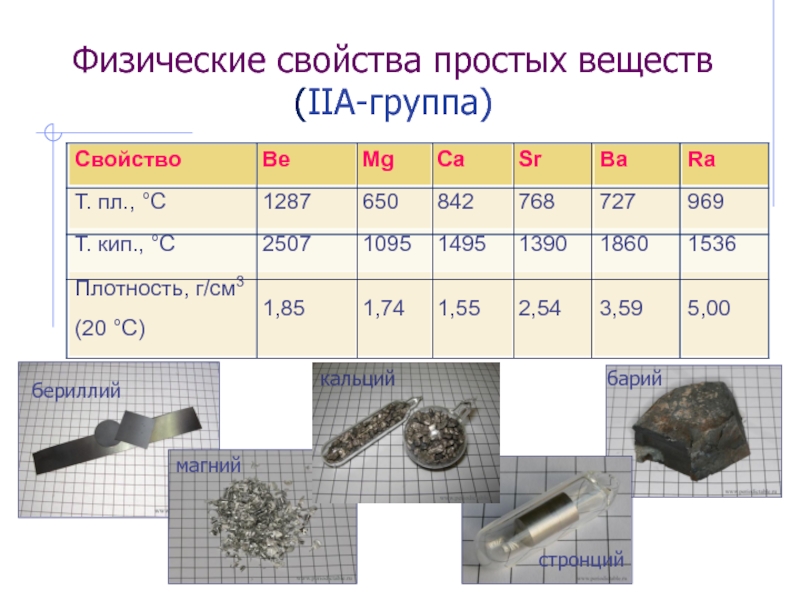
Слайд 41Физические свойства простых веществ (IIА-группа)
Слайд 42Получение
Be – электролиз расплава Ba[BeF4]
или восстановление:
BeF2 + Mg = MgF2
+ Be
Mg – электролиз расплава MgCl2
Sr, Ba – электролиз
расплава MCl2 или BaO
Слайд 43Основные свойства
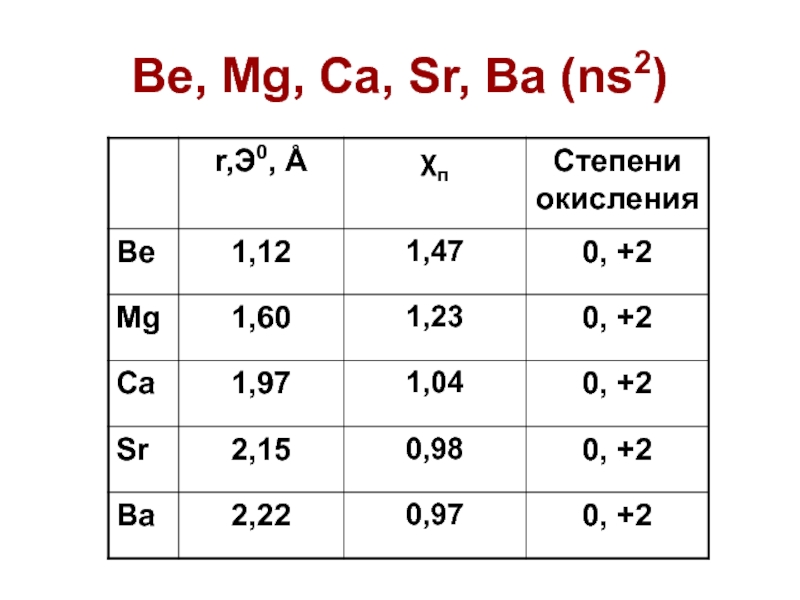
степень окисления ТОЛЬКО +2;
очень маленький радиус катиона
бериллия
и магния;
Ca, Sr, Ba – щелочно-земельные металлы;
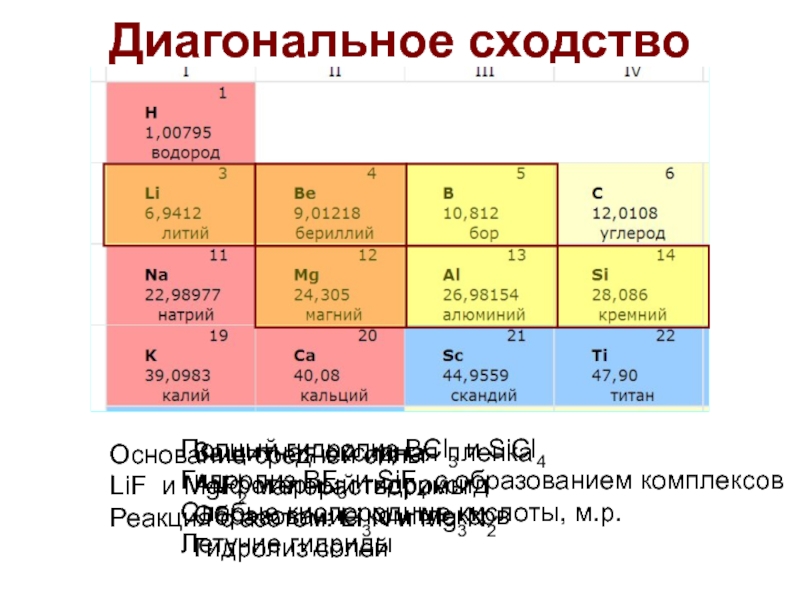
диагональное
сходство: Be и Al;
Be – ковалентные соединения;
увеличение основных свойств M(OH)2:
Be(OH)2 – амфотерное, Ca(OH)2 – средней силы
Слайд 44Свойства простых веществ
M + 2H2O = M(OH)2 + H2
(Be
– нет; Mg – при нагревании; Ca, Sr, Ba –
очень бурно)
Все металлы: M + 2HCl = MCl2 + H2
M + X2 = MX2 (Х – галогены)
M + S = MS
2M + O2 = 2MO
BaO + ½O2 = BaO2 при 500 оС (пероксид бария)
Слайд 45Свойства простых веществ
Ве – амфотерные свойства:
Be + 2HCl = BeCl2
+ H2;
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2;
Be
+ 4NH4F = (NH4)2[BeF4] + 2NH3 + H2 (в р-ре);
Mg + 2NH4Cl = MgCl2 + 2NH3 + H2 (при Т в р-ре)
Слайд 46M(OH)2
Be(OH)2 – амфотерный.
Mg(OH)2 – основание средней силы, Kb2 = 3.10–3.
Ca(OH)2,
Sr(OH)2, Ba(OH)2 – сильные основания (щелочи) – мало растворимы в
воде.
Соединения с N
M = Mg, Ca, Sr, Ba образуют M3N2 ионные нитриды
3M + N2 = M3N2 (при Т)
M3N2 + 6H2O = 3M(OH)2 + 2NH3
Be3N2 – ковалентное соединение, не гидролизуется при обычных условиях
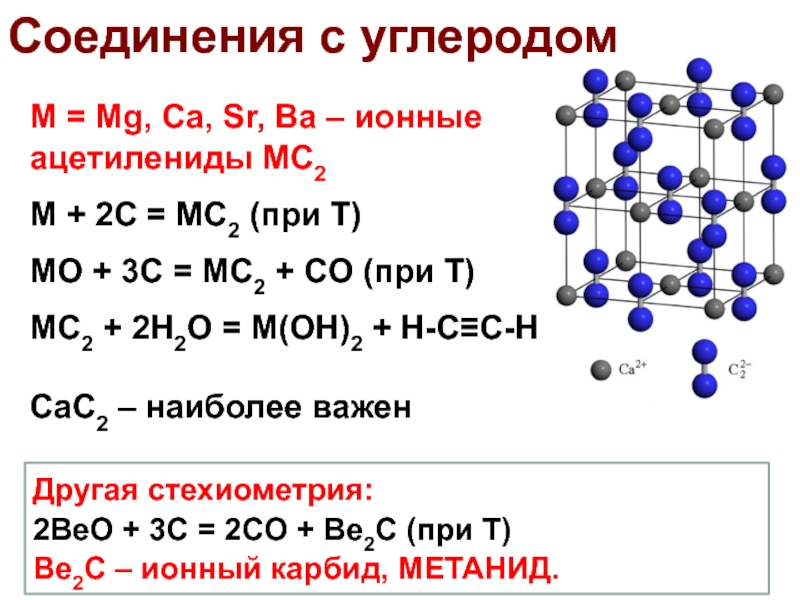
Слайд 47Соединения с углеродом
M = Mg, Ca, Sr, Ba – ионные
ацетилениды MC2
M + 2C = MC2 (при Т)
MO + 3C
= MC2 + CO (при Т)
MC2 + 2H2O = M(OH)2 + H-C≡C-H
CaC2 – наиболее важен
Другая стехиометрия:
2BeO + 3C = 2CO + Be2C (при Т)
Be2C – ионный карбид, МЕТАНИД.
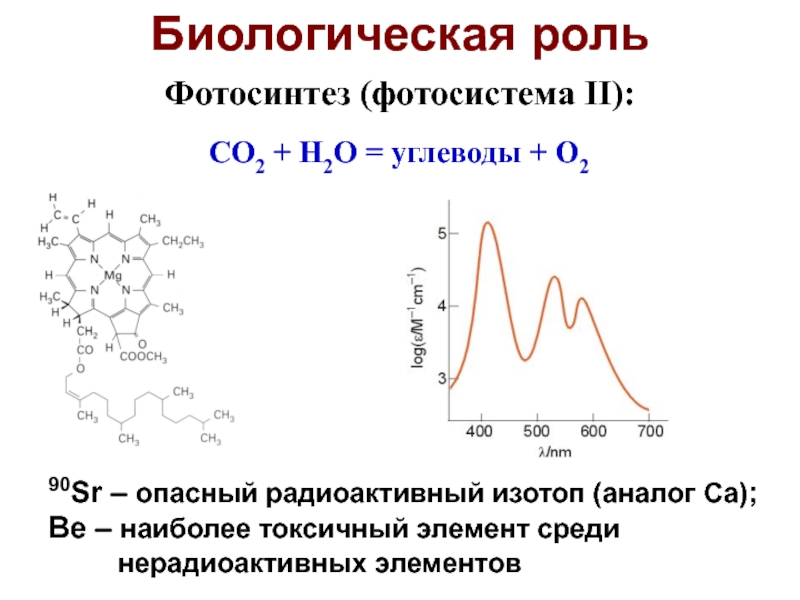
Слайд 48Биологическая роль
90Sr – опасный радиоактивный изотоп (аналог Ca);
Be – наиболее
токсичный элемент среди
нерадиоактивных
элементов
Фотосинтез (фотосистема II):
CO2 + H2O = углеводы + O2
Слайд 51Распространенность и минералы
Li – 29 место; Li2[Al2Si4O12] (сподумен)
Na – 6
место; NaCl (галит, кам. соль),
K – 8 место; KCl.MgCl2.6H2O
(карналлит), KCl (сильвин)
Rb – 26 место; KLi2Al(Al,Si)3O10(F,OH)2)
(лепидолит)
Cs – 38 место; (Cs,Na)[AlSi2O6]·nH2O
(поллуцит)
Fr – радиоактивен
Слайд 52Открытие элементов
Li – 1817 г., Берцелиус; греч. «литос» – камень
Na
– 1807 г., анг. Дэви, араб. «натрон» – сода
K
– 1807 г., анг. Дэви, араб. «алкали» – щелочное вещество
Rb – 1861 г., нем. Бунзен и Кирхгоф;
лат. «рубидос» – красный
Cs – 1861 г., нем. Бунзен и Кирхгоф;
лат. «цесиус» – небесно-голубой
Fr – 1939 г., фр. Перей, в честь Франции
22789Ac = 22387Fr + 42He
(t1/2 = 22 мин) (t1/2 = 11,4 сут.)
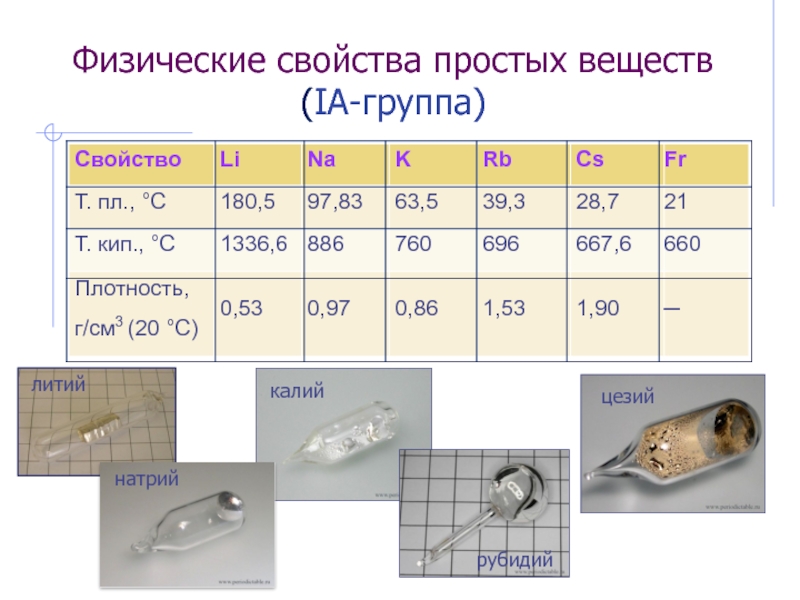
Слайд 53Физические свойства простых веществ (IА-группа)
Слайд 54Получение
Электролиз расплавов MCl или MOH
(M = Li, Na, K)
Катод:
M+ + e = M
Анод: 2OH– – 2e = H2O
+ ½O2 (или Cl2)
Восстановление
2MCl + Ca = 2M + CaCl2 (M = Rb, Cs) 700 oC, вакуум.
tкип. (Ca) = 1484 C,
tкип. (Cs) = 668 C; tкип. (Rb) = 696 C
Слайд 55Методы работы в инертной атмосфере
Слайд 56Особенности Li
Li резко отличается от остальных М, похож на Mg
(диагональное сходство). Ковалентный характер связей.
6Li + N2 = 2Li3N –
нитрид (при нагревании)
Остальные М реагируют с N2 только в эл. разряде и выход M3N низкий
Н/р в воде: LiF, Li2CO3, Li3PO4 (как и соли Mg2+)
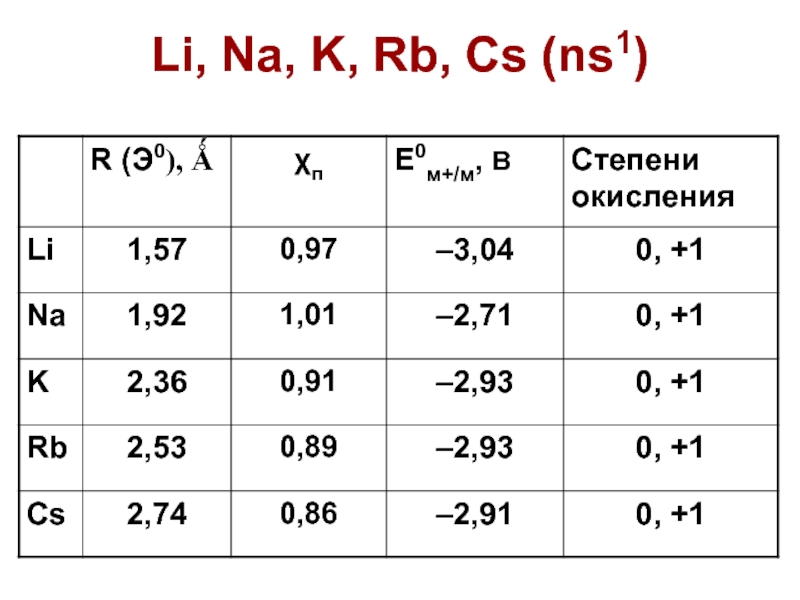
Слайд 58Основные свойства
Степень окисления ТОЛЬКО +1
Щелочные металлы. Очень реакционноспособные
MOH – растворимы в воде, ЩЕЛОЧИ
Слайд 59Св-ва простых веществ
Реакции с водой (K, Rb, Cs – взрываются)
Nа + H2O = NaOH + ½H2
2M + H2 =
2MH при нагревании
(солеобразные гидриды) реагируют с водой
NaH + H2O = NaOH + ½H2
2M + X2 = 2MX (X = F2, Cl2, Br2, I2 )
2M + S = M2S
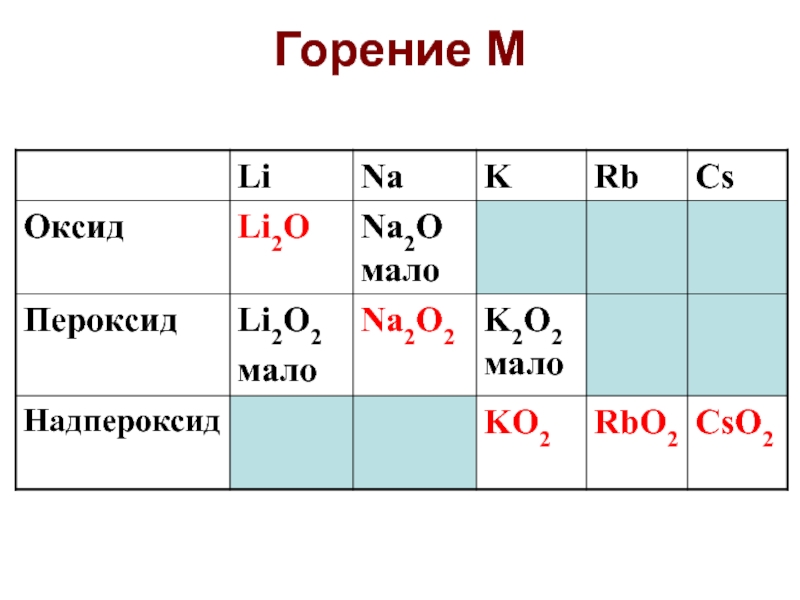
Слайд 61Кислородные соединения
Na2O2 + O2 = 2NaO2 (500 оС, 300 атм)
KO2
+ O3 = KO3 + O2 (озонид) (Rb, Cs)
Реакции с
водой:
M2O + H2O = 2MOH
M2O2 + 2H2O = 2MOH + H2O2
2MO2 + 2H2O = 2MOH + H2O2 + O2
2MO3 + 2H2O = 2MOH + H2O2 + 2O2
Слайд 62Кислородные соединения
«Проветривание» закрытых помещений:
4KO2 + 2CO2 = 2K2CO3 + 3O2
2Na2O2
+ 2CO2 = 2Na2CO3 + O2
Косвенные методы получения оксидов:
MOH
+ M = M2O + H2
М2CO3 = M2O + CO2
(прокаливание карбонатов)










![Химия элементов IV A группы Элементы IIIА-группы Общая электронная формула:[…] ns 2 (n –1)d 10 np 1 Элементы IIIА-группы Общая электронная формула:[…] ns 2 (n –1)d 10 np 1](/img/thumbs/4c20eaded2af1a847ac755e30464f1b2-800x.jpg)
![Химия элементов IV A группы Бор[H+]: H3BO3 + 3H+ + 3e = B + 3H2O E0 Бор[H+]: H3BO3 + 3H+ + 3e = B + 3H2O E0 = –0,87 B[OH–]: [B(OH)4]– +](/img/thumbs/d3cc5b49fd3231370451eb66f44de25c-800x.jpg)
![Химия элементов IV A группы Борная кислота – H3BO3ОДНООСНОВНАЯ И СЛАБАЯ, pKa = 9,2B(OH)3 + 2H2O Борная кислота – H3BO3ОДНООСНОВНАЯ И СЛАБАЯ, pKa = 9,2B(OH)3 + 2H2O = H3O+ + [B(OH)4]– – солей](/img/thumbs/bcd68c312bb5e8751905046d1ade1a9c-800x.jpg)
![Химия элементов IV A группы Тетраборат натрия Na2B4O7·10H2O (бура)Na2B4O7 + 2H2O = 2Na+ + [B4O72– · 2H2O] (диссоциация и гидратация) Тетраборат натрия Na2B4O7·10H2O (бура)Na2B4O7 + 2H2O = 2Na+ + [B4O72– · 2H2O] (диссоциация и гидратация)](/img/thumbs/92fd3691aea4983ce343826f3b963658-800x.jpg)

![Химия элементов IV A группы Al – получение алюминияПромышленное получение алюминия: Электролиз раствора Al2O3 (10%) в Al – получение алюминияПромышленное получение алюминия: Электролиз раствора Al2O3 (10%) в расплаве (962 oC) криолита Na3[AlF6]: на](/img/thumbs/b824b920bb8b16caeaf2850a64c2b619-800x.jpg)








![Химия элементов IV A группы ПолучениеBe – электролиз расплава Ba[BeF4]или восстановление:BeF2 + Mg = MgF2 + ПолучениеBe – электролиз расплава Ba[BeF4]или восстановление:BeF2 + Mg = MgF2 + Be Mg – электролиз расплава MgCl2Sr,](/img/thumbs/93f01164e2b08a485abeb5e1f27d80d7-800x.jpg)




![Химия элементов IV A группы Распространенность и минералыLi – 29 место; Li2[Al2Si4O12] (сподумен)Na – 6 место; Распространенность и минералыLi – 29 место; Li2[Al2Si4O12] (сподумен)Na – 6 место; NaCl (галит, кам. соль), K –](/img/thumbs/14ae37e9f3a4ca9abd212c1c93d566db-800x.jpg)