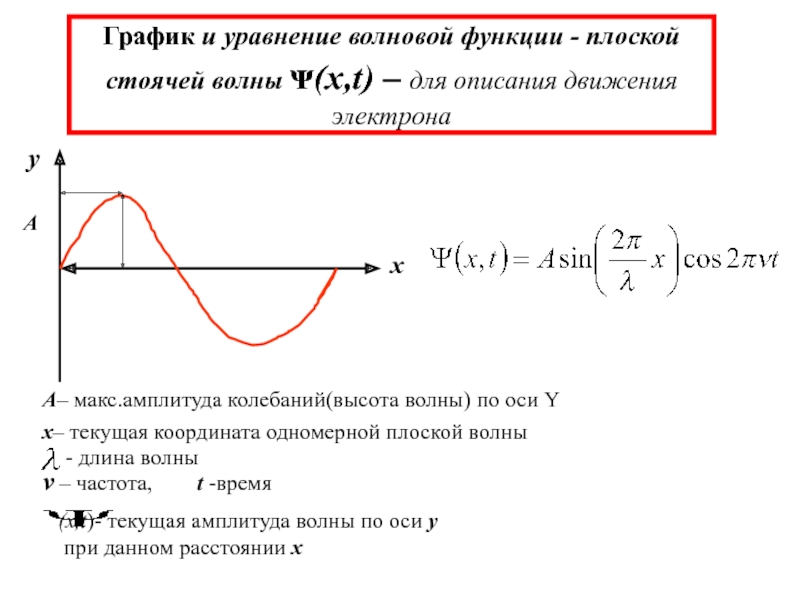
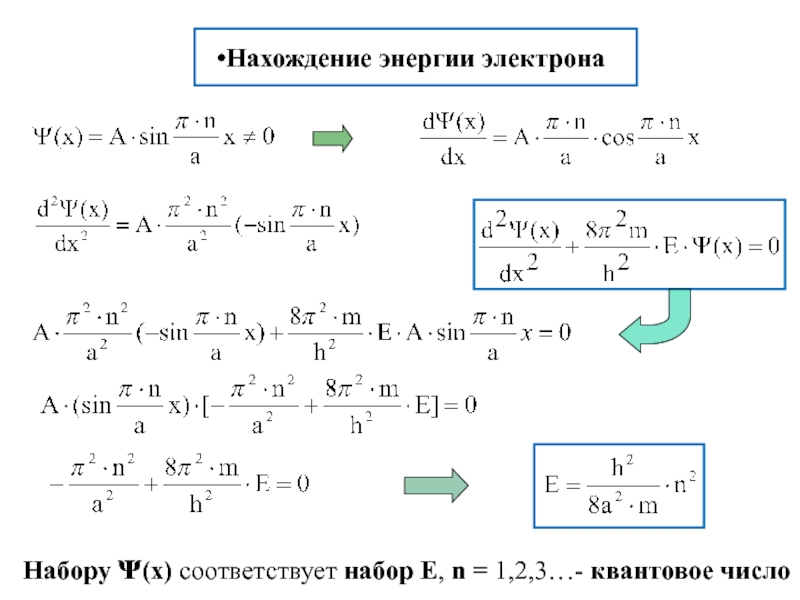
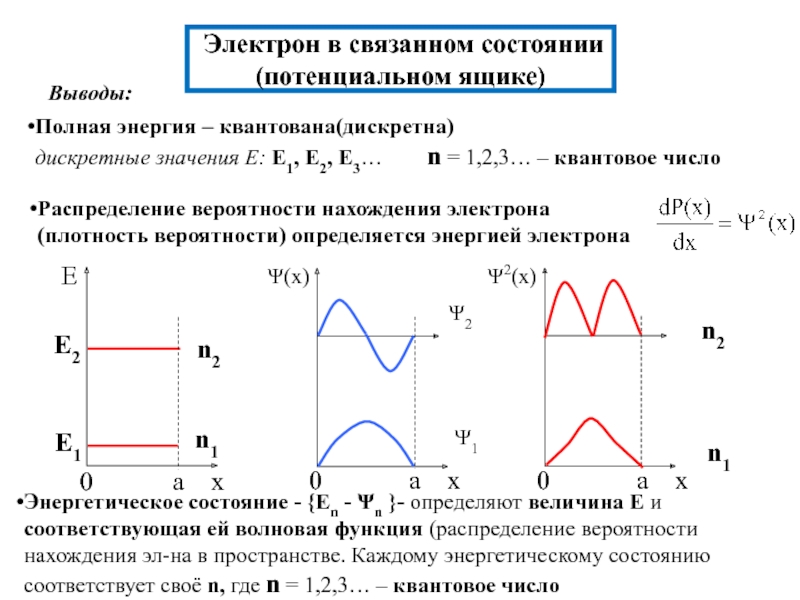
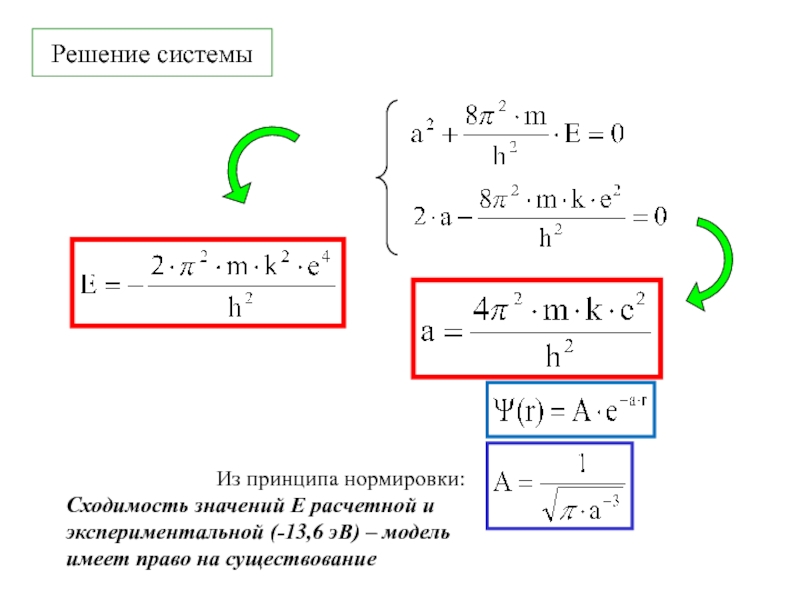
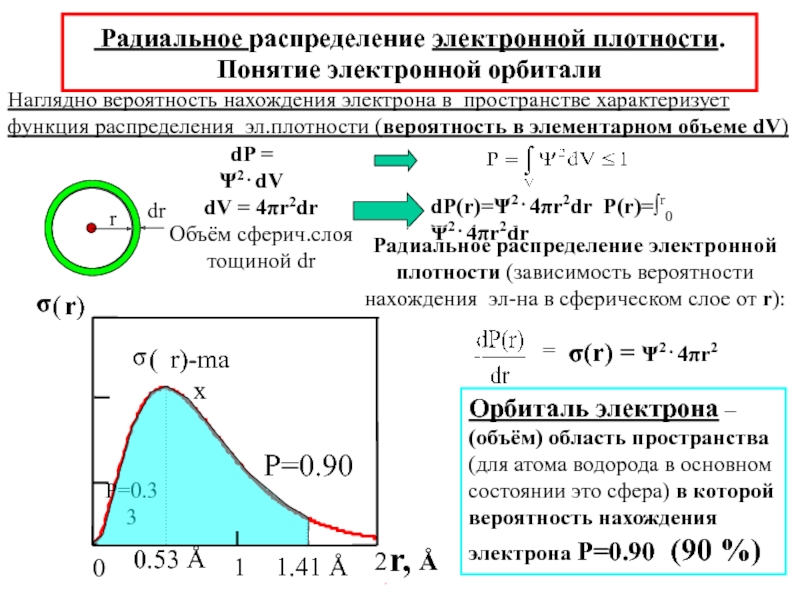
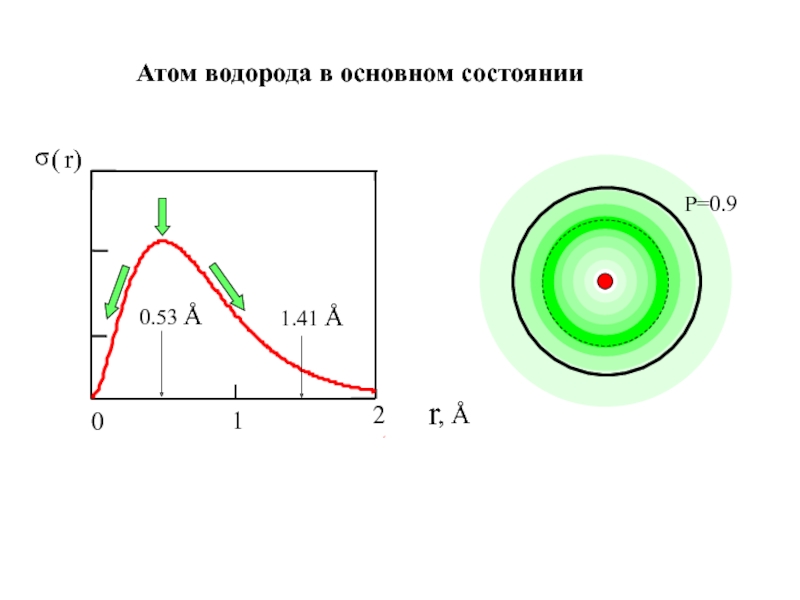
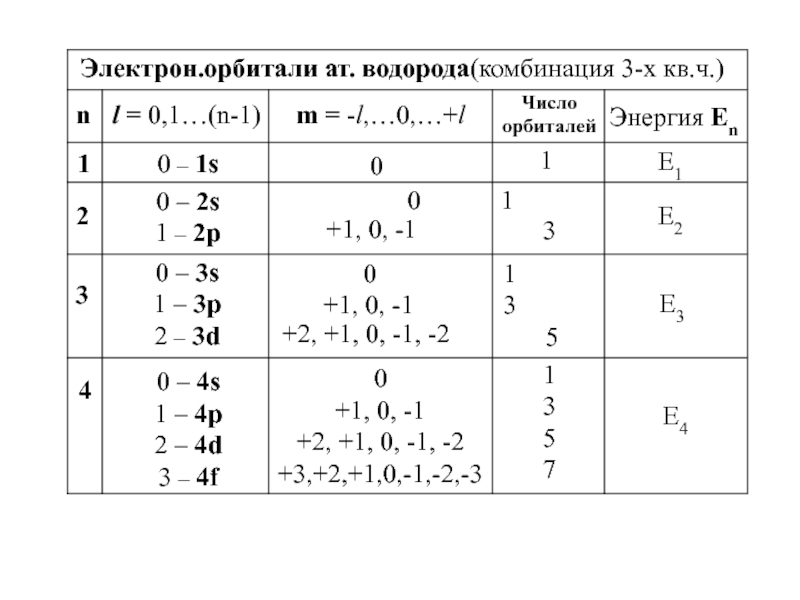
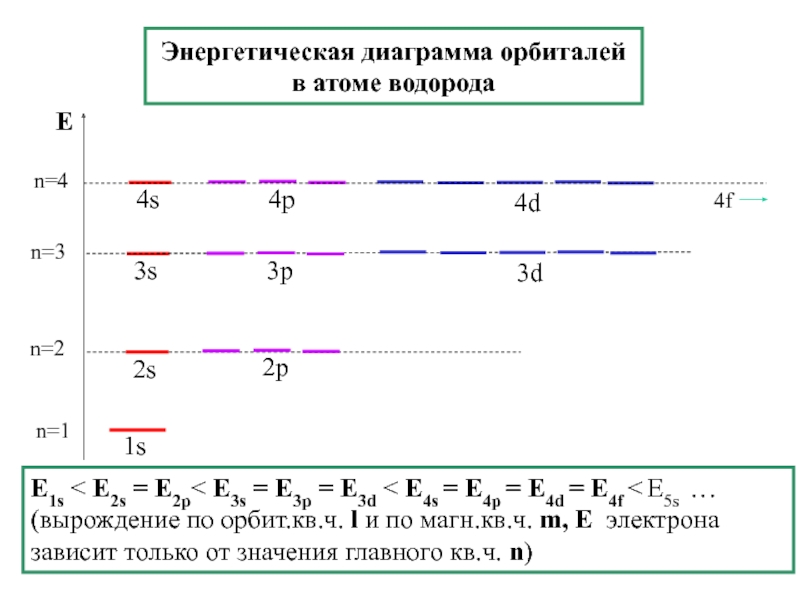
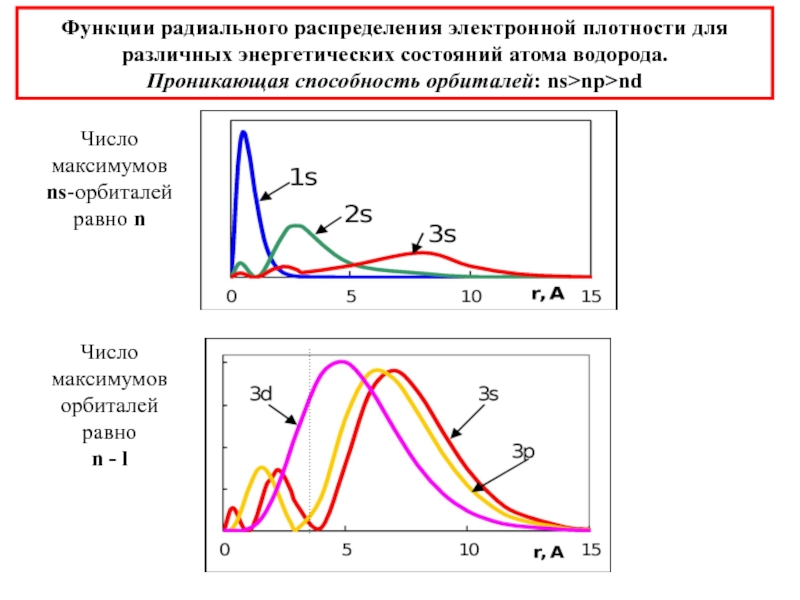
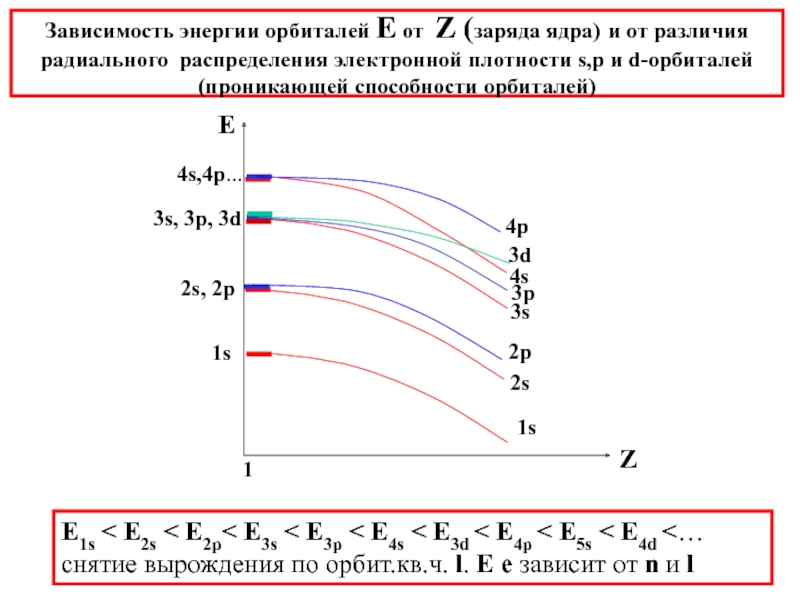
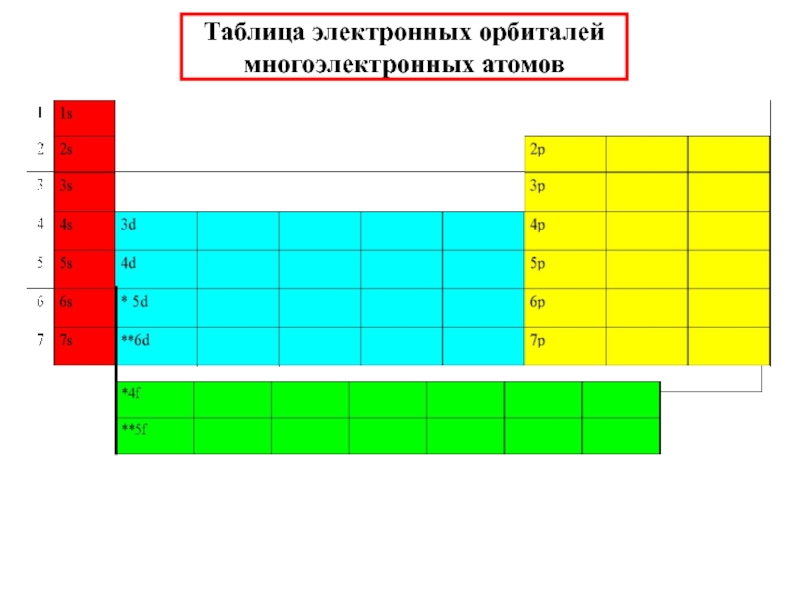
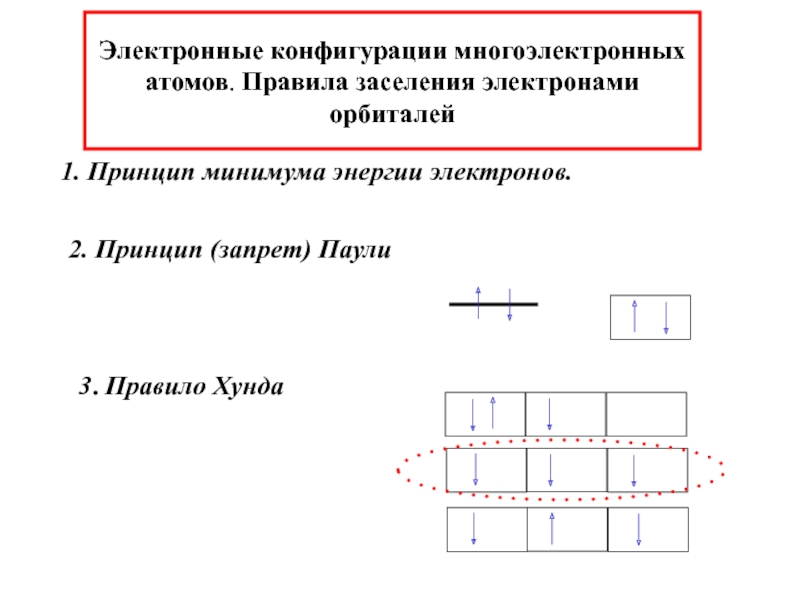
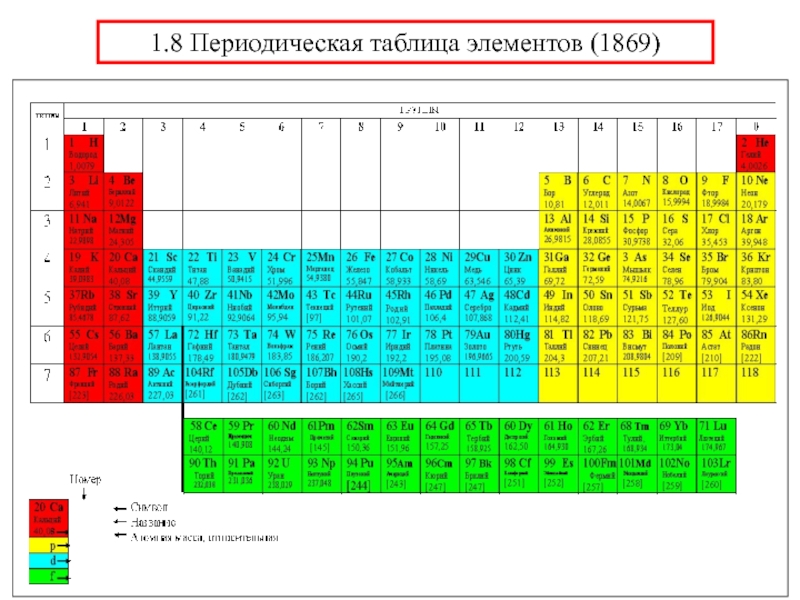
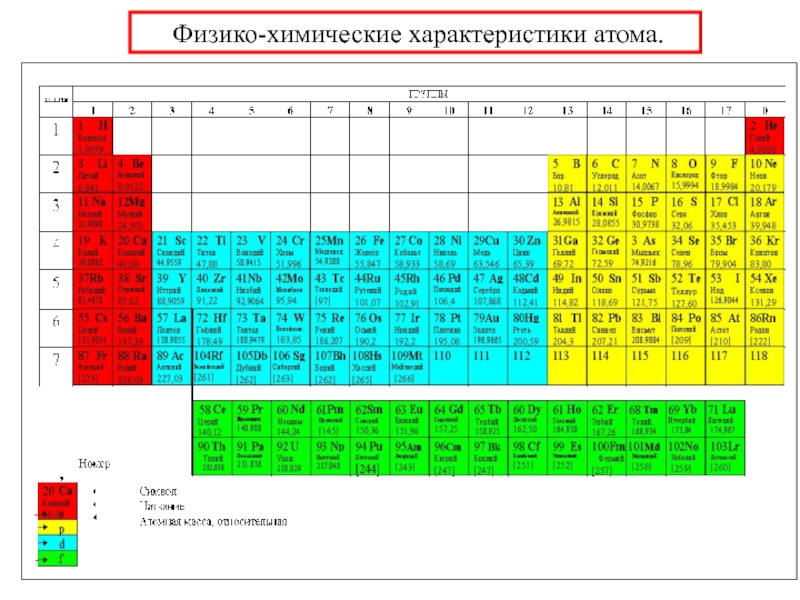
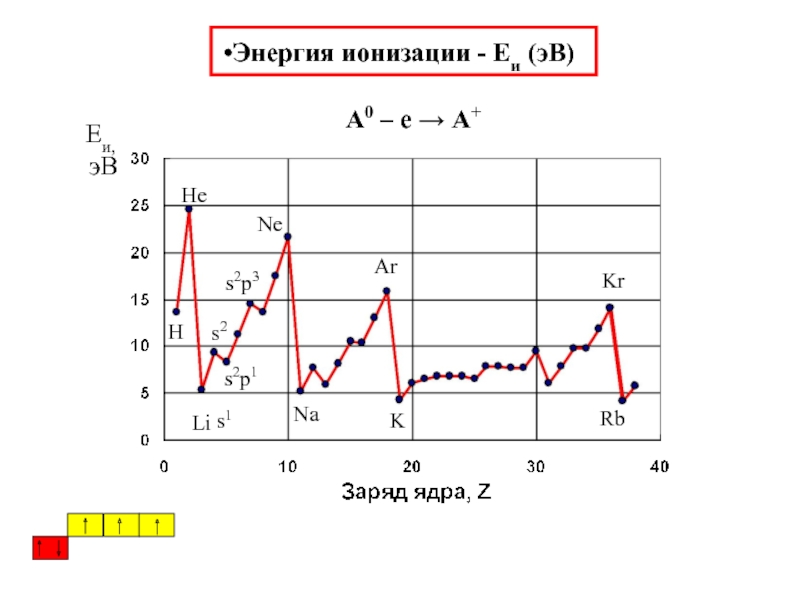
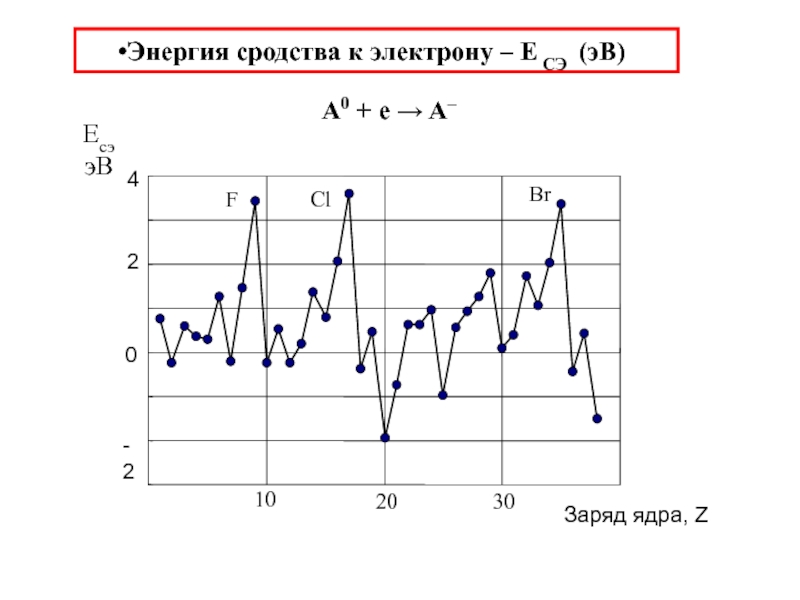
химии 5.
А.В. Суворов, А.Б.Никольский 6. В.В.Фролов,7. Н.В.Коровин - учебники для вузов
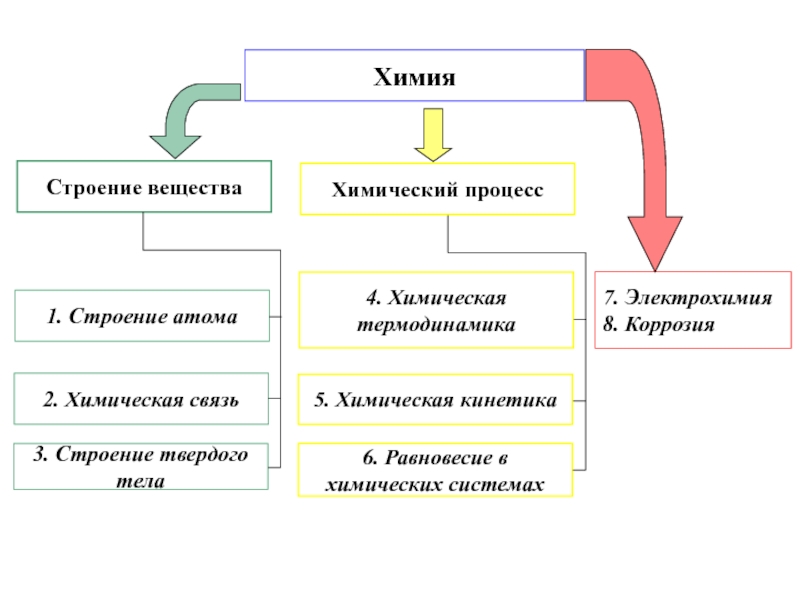
2 – Уч.пос. Часть 1 Строение вещества 2002 г.(552)
Часть 2 Термодин.и кинетика химического процесса 2003(599) г.(599)
- теоретические основы
Часть 3 Электрохим. и коррозионные процессы 2007(837)



![Химия
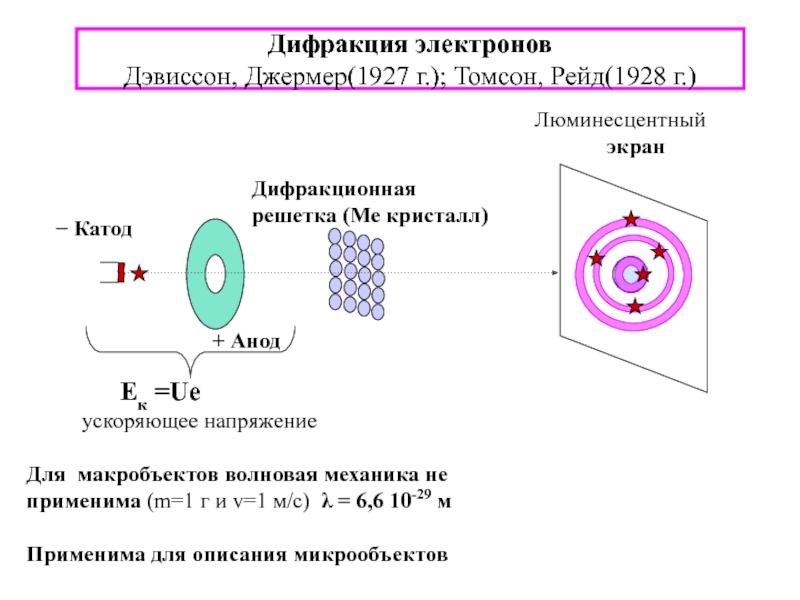
4. А.И. Горбунов, А.А. Гуров и др.Теоретические основы общей химии 5 Корпускулярно-волновой дуализм свойств материи [проблема природы лучистой энергии - эл.магн.излучения(ЭМИ)] Корпускулярно-волновой дуализм свойств материи [проблема природы лучистой энергии - эл.магн.излучения(ЭМИ)] Электромагнитное излучениеВолна: l - длина волны](/img/tmb/3/296543/950c21d335fa466c1c4dca698fa5288b-800x.jpg)

![Химия
4. А.И. Горбунов, А.А. Гуров и др.Теоретические основы общей химии 5 Принцип неопределенности [для микрочастиц(электрона)]Вернер Гейзенберг постулировал этот принцип в 1927 г.∆х, Принцип неопределенности [для микрочастиц(электрона)]Вернер Гейзенберг постулировал этот принцип в 1927 г.∆х, ∆р х – неопределенность координаты частицы](/img/thumbs/e75394076da06a6ca65e3580acef677b-800x.jpg)