на растворимость электролита введения одноименных ионов
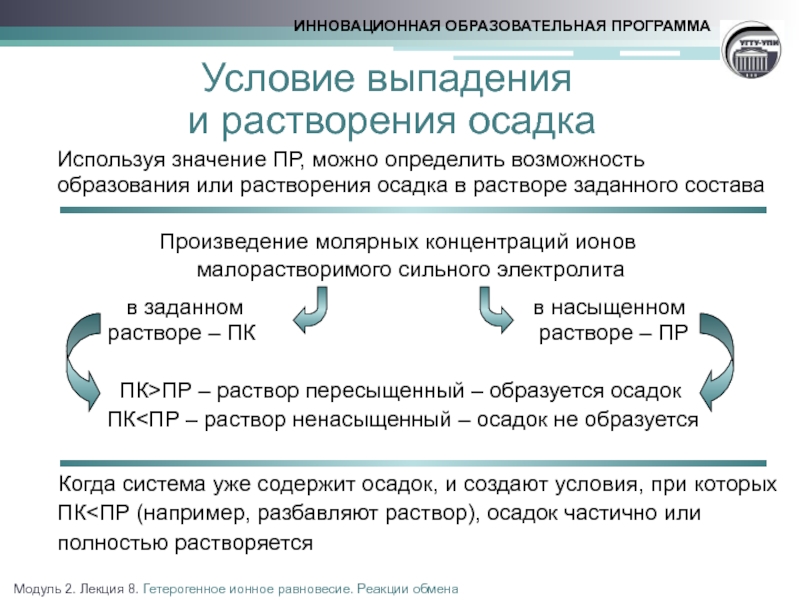
Условие образования и растворения осадка
Реакции
обмена в растворах электролитовМодуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена