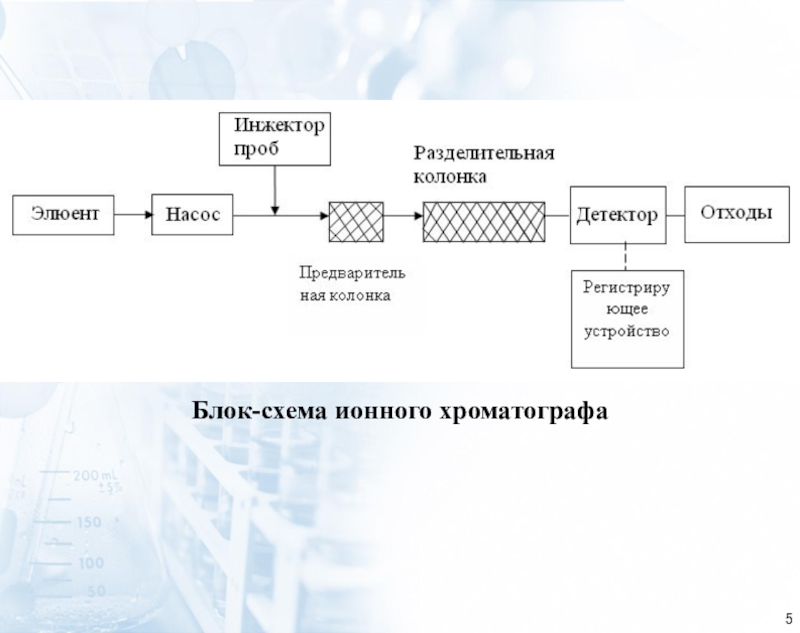
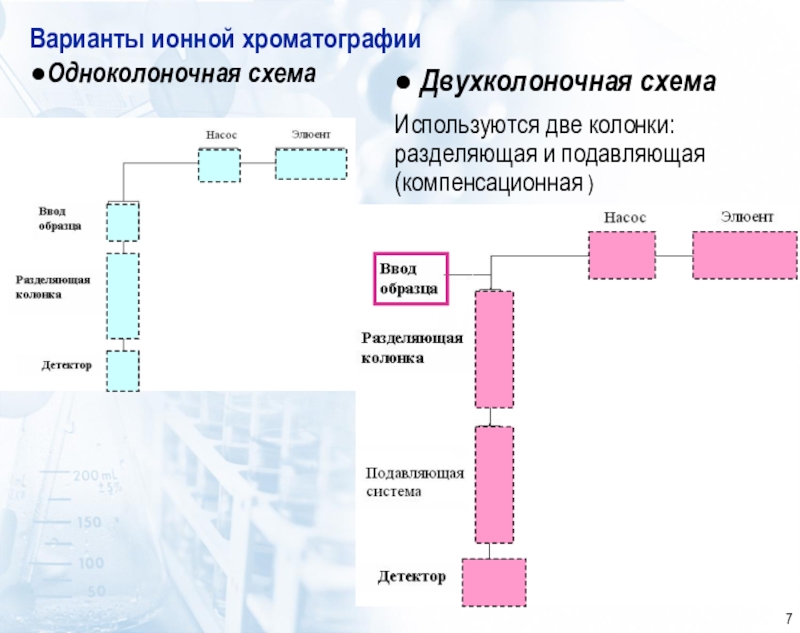
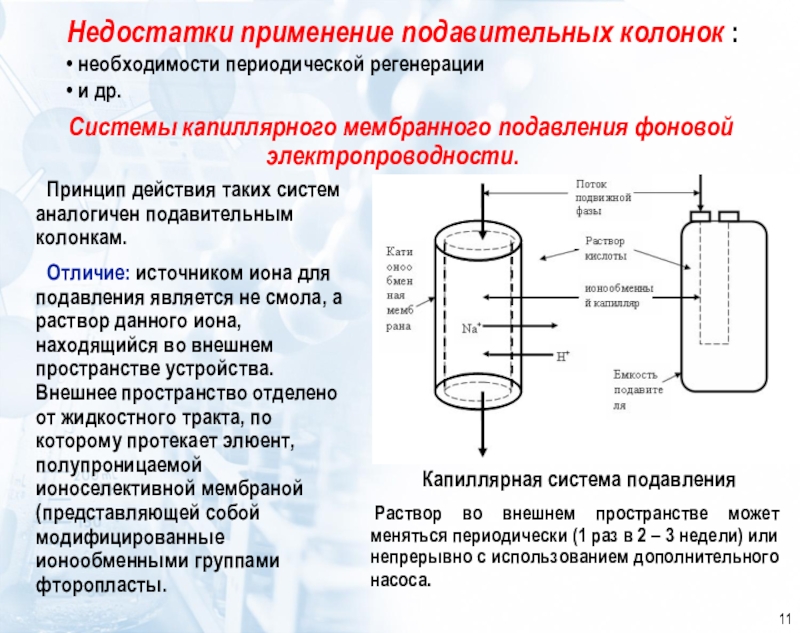
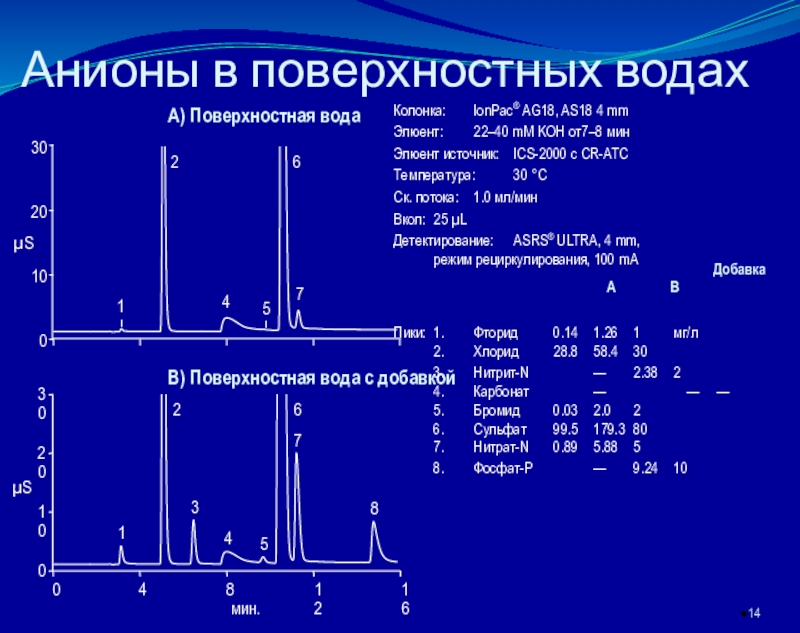
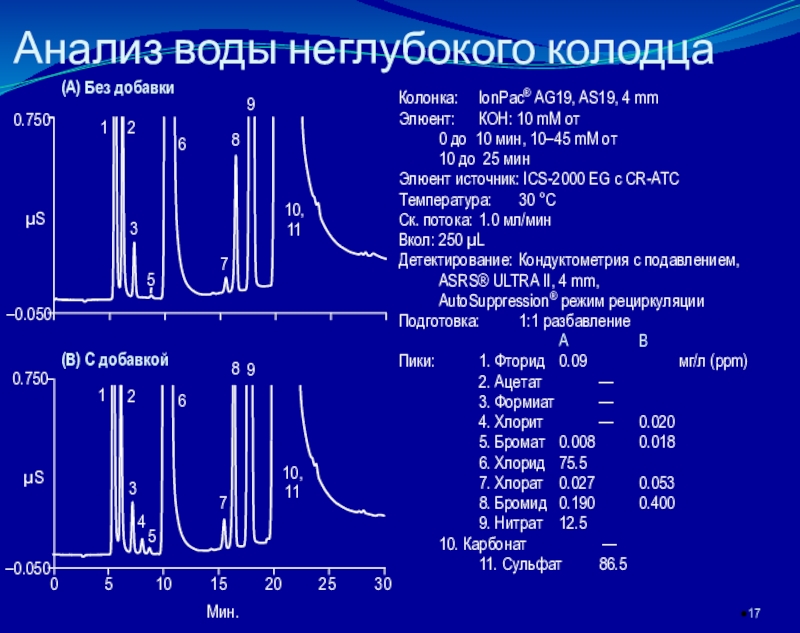
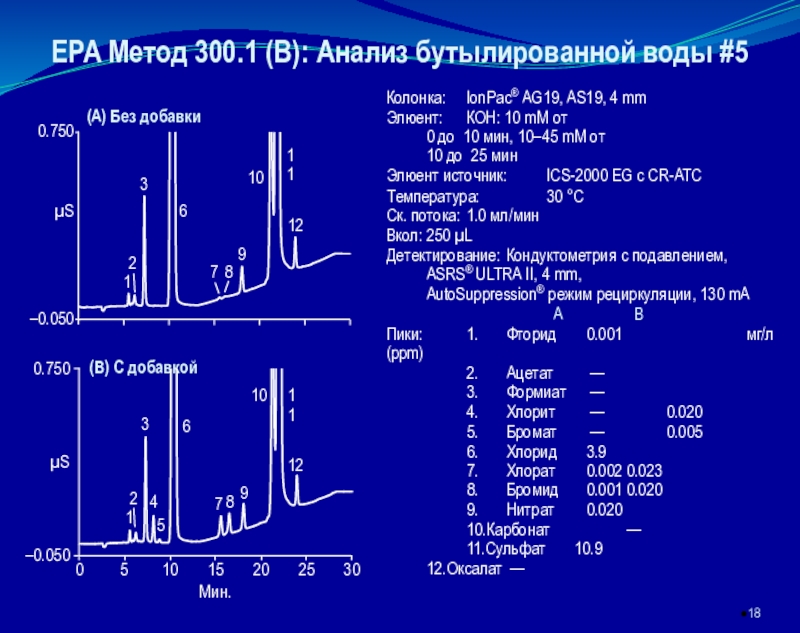
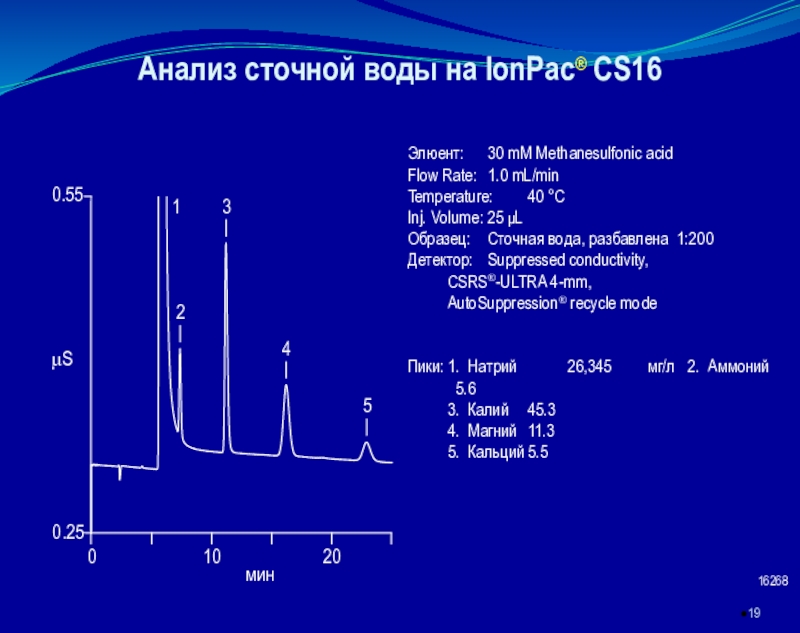
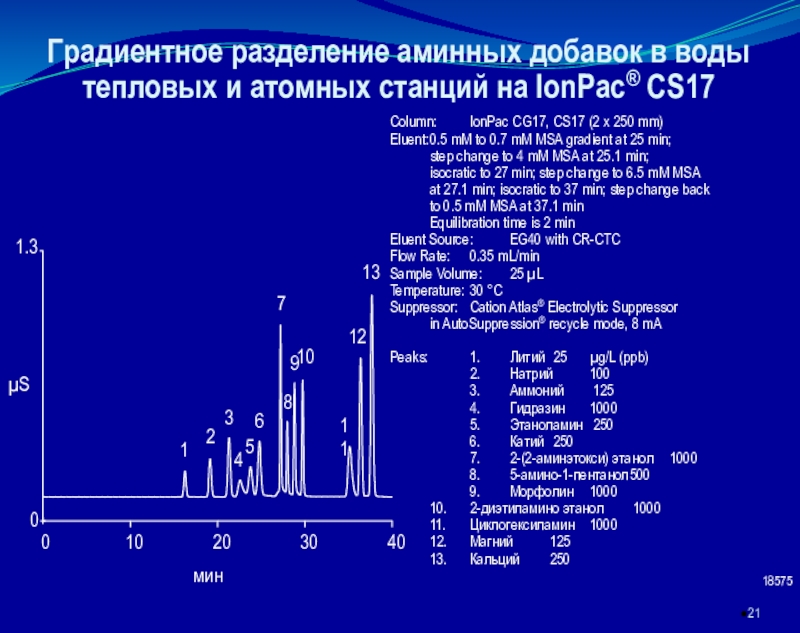
которой разделяемые ионы определяются в проточном, как правило, кондуктометрическом детекторе.
Метод
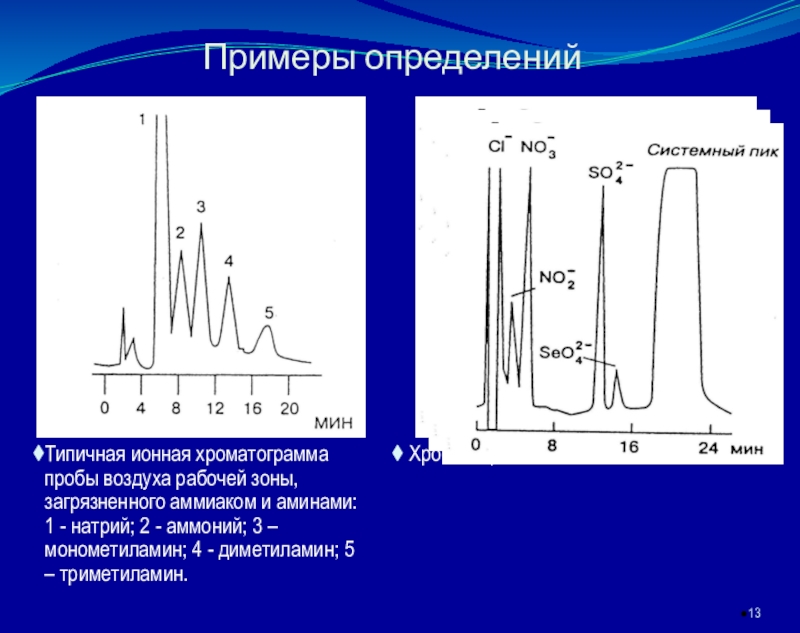
основан на элюентном ионообменном разделении катионов или анионов в разделяющей колонке, подавлении фонового сигнала элюента в подавляющей колонке и детектировании ионов после разделенияКачественный анализ в ИХ осуществляется по времени удерживания ионов, количественный – по площади или высоте хроматографических пиков.
Специфическое строение ионита и высокое (до 10 МПа) давление в системе обеспечивают высокую эффективность разделения ионов.