Слайд 1Изучает процессы превращения энергии в твердых, жидких и газообразных телах,
излучение тел, магнитные и электрические явления. Устанавливает математические зависимости между
термодинамическими величинами
Изучает закономерности превращения энергии в тепловых двигателях, холодильных машинах. Рассматривает круг вопросов, связанных с термомеханической системой (сжатие и расширение газов, паров, возможности фазового перехода, термодинамику потока).
Изучает закономерности превращения энергии при изменении химического состава объектов
Теплотехника изучает методы получения, преобразования, передачи и использования теплоты и связанных с этим аппаратов и устройств
Слайд 2Термодинамическая система
Совокупность макроскопических тел, обменивающихся энергией и/или веществом как друг
с другом, так и с окружающей средой
Открытая и закрытая системы
Изолированная
(замкнутая) система
Адиабатная система
Гомогенная и гетерогенная
Однородная – во всех частях которой свойства одинаковые; неоднородная
Слайд 3Термодинамические параметры
- величины, характеризующие состояние термодинамической системы
p, T, V,
U, I, S и др.
Параметры:
интенсивные – не зависят от
массы системы
экстенсивные - зависят
Слайд 4К основным параметрам относятся
Абсолютное давление (p, Па)– средний результат
ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенки
сосуда, в котором заключен газ
[p]=Па в системе СИ; 1 бар=105 Па; 1 мм рт.ст.=133,3 Па; 1 мм вод.ст.= 9,8067 Па; 1 атм=1,033 кг/см2=1,013*105 Па
Рабс = Рбар+Ризб; Рабс=Рбар-Рвак;
Абсолютная температура (T, К) – физическая величина, характеризующая интенсивность теплового движения молекул в состоянии термодинамического равновесия системы (мера степени нагретости тела) T=t°C+273,15 ;
Удельный объем (υ, м3/кг) – объем, занимаемый единицей массы вещества; плотность (ρ, кг/м3)
Слайд 5Термодинамический процесс
- изменение состояния системы, характеризующееся изменением ее термодинамических параметров
F(p,
υ, T)=0 – уравнение состояния
Равновесные и неравновесные процессы
Круговые процессы –
циклы
Равновесный процесс – проходящий через ряд равновесных состояний
Равновесное состояние – при котором во всех точках его объема давление, температура, плотность и все другие физические свойства одинаковы
Слайд 6Теплота и работа
Мерой движения материи является энергия
При протекании термодинамического процесса
тела обмениваются между собой энергией.
Слайд 7Передача энергии может происходить 2-ми способами:
I способ –
при непосредственном
контакте тел, имеющих различную температуру путем обмена кинетической энергией между
молекулами соприкасающихся тел
либо лучистым переносом внутренней энергии излучаемых тел путем электромагнитных волн
Энергия передается от более нагретых тел к менее нагретым
Количество энергии называют количество теплоты
Способ передачи энергии в форме теплоты
Q = [Дж]; q = [Дж/кг]
Отведенная (отнятая) и подведенная (сообщаемая)
Слайд 8II способ – связан с наличием силовых полей или внешнего
давления. Для передачи энергии тело должно
либо передвигаться в силовом поле
либо
изменять свой объем под действием внешнего давления
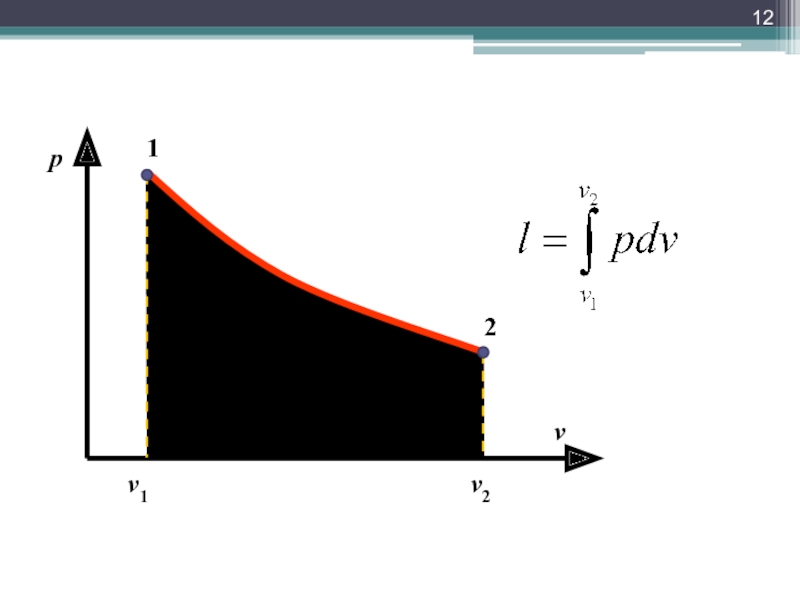
Количество переданной энергии называют работой
Способ передачи энергии в форме работы
L = [Дж]; l = [Дж/кг]
Затраченная (совершенная телом работа, отданная) и совершенная над телом (полученная телом)
Слайд 9В общем случае передача энергии
в форме теплоты и
в форме работы
может
происходить одновременно
Теплота и работа характеризуют качественно и количественно 2-е различные
формы передачи энергии
Работа – макрофизическая форма передачи энергии
Теплота – совокупность микрофизических процессов
Обе зависят от условий перехода тела из начального в конечное состояние, т.е. от характера процесса
Понятия теплота и работа возникают только в связи с протеканием процесса
Нет процесса - нет теплоты и работы
Нет запаса теплоты и работы
Слайд 10Внутренняя энергия U (Дж)– часть энергии термодинамической системы, которая не
связана с положением системы в поле внешних сил и ее
движением относительно тел окружающей среды.
Внутренняя энергия выделенного объема складывается из энергии поступательного и вращательного движения молекул, составляющих минералы, энергии внутримолекулярных колебаний, потенциальной энергии сил взаимодействия между молекулами.
Внутренняя энергия зависит термодинамической системы зависит только от параметров состояния и не зависит от того, каким путем были достигнуты эти параметры
Слайд 13I закон термодинамики
Характеризует количественную сторону процессов передачи энергии и является
законом сохранения энергии, записанным в термодинамических терминах.
В общем случае
при подводе теплоты к телу повышается температура тела и увеличивается его объем.
Подведенная к телу теплота расходуется на увеличение внутренней энергии тела (повышение температуры) и совершение работы (увеличение объема)
Слайд 15Формулировки первого закона термодинамики
Невозможно возникновение или уничтожение энергии
Любая форма движения
способна и должна превращаться в любую другую форму движения
Вечный двигатель
первого рода невозможен (нельзя получить работу не затратив энергию)
Слайд 16Формулировки первого закона термодинамики
Энергия является однозначной функцией состояния
Теплота и работа
являются двумя единственно возможными формами превращения энергии
Сумма всех видов энергии
в любой изолированной системе является величиной постоянной
Слайд 17Энтальпия
Физик Гибсс ввел в практику тепловых расчетов новую функцию, которая
в последствии была названа энтальпией
I = U +pV, Дж
Энтальпия
(теплосодержание) – функция состояния термодинамической системы, равная сумме внутренней энергии и произведения давления в системе на ее объем
i = u +pv, Дж/кг
1 закон термодинамики dq = du + pdv
dq = du + pdv +vdp – vdp
dq = du + d(pv) – vdp
dq = d(u + pv) – vdp
dq = di – vdp
dq = di + lʹ
Слайд 18Теплоемкость термодинамической системы
- это отношение количества теплоты, подводимого к веществу
или отводимого от вещества, к изменению температуры вещества
Зависит от характера
(пути) процесса
Слайд 19Наиболее часто используется теплоемкость не всей системы, а единицы количества
вещества – удельная теплоемкость:
-массовая
- молярная
- объемная
Слайд 20Наибольший интерес представляет теплоемкость в изобарном и изохорном процессах:
-изобарная теплоемкость
- изохорная теплоемкость
Слайд 21Истинная теплоемкость
- отношение элементарного количества теплоты к бесконечно малой разности
температур
Средняя теплоемкость
- отношение количества теплоты к конечной разности температур
Слайд 22В диапазоне от 0 до 500°С (если в породе не
происходят фазовые переходы) теплоемкость горных пород изменяется практически по линейному
закону по эмпирической зависимости
С20 - теплоемкость пород при t=20°С
n – постоянная, зависит от типа пород
При температурах T>>Θд не изменяется в зависимости от температуры с=3R
R- газовая постоянная, Θд - температура Дебая
Слайд 23Уравнение Майера
Энтальпия
Продифференцируем
Разделим на
Для 1 кмоля
Слайд 24Дж/К
Энтропия – функция состояния термодинамической системы, определяемая тем, что ее
дифференциал dS при элементарном равновесном (обратимом) процессе, происходящем в этой
системе, равен отношению бесконечно малого количества теплоты Q, сообщенного системе, к термодинамической температуре системы
Слайд 25II закон термодинамики
I закон утверждает, что может
Q L
и L
Q
не устанавливая условий, при которых возможны эти превращения
I закон не рассматривает вопрос о направлении теплового процесса, а не зная направления нельзя предсказать характер и результат
Слайд 26Закон, позволяющий указать направление теплового потока и устанавливающий максимально возможный
предел превращения Q L в тепловых машинах, представляет собой
II закон термодинамики
Постулат Клаузиуса: Теплота не может переходить от холодного тела к более нагретому сама собой даровым процессом (без компенсации)
Томсон: Не вся теплота, полученная от теплоотдатчика, может перейти в работу, а только некоторая ее часть, а другая часть теплоты должна перейти в теплоприемник
Слайд 27II закон термодинамики показывает, что
для передачи теплоты тела должны быть
разнонагретыми (иметь различную температуру)
теплота передается от более нагретого тела
для обратного
перехода теплоты (от более холодного к более нагретому) необходимо затратить дополнительную энергию
для превращения теплоты в работу необходимо иметь два источника теплоты (горячий и холодный) и рабочее тело, совершающее работу (способное расширяться)
вся теплота, полученная от горячего источника ни при каких условиях не может быть превращена в работу
Слайд 28Математическое выражение
II закона термодинамики
Оценка степени необратимости (несовершенства)
Анализ процессов
Слайд 29Энтропия
Теплота не является функцией состояния (зависит от пути процесса)
Умножаем теплоту
на интегрирующий множитель
И назовем ее приведенной теплотой
Слайд 30Дж/К
Энтропия – функция состояния термодинамической системы, определяемая тем, что ее
дифференциал dS при элементарном равновесном (обратимом) процессе, происходящем в этой
системе, равен отношению бесконечно малого количества теплоты Q, сообщенного системе, к термодинамической температуре системы
Слайд 31Изменение энтропии для любого термодинамического процесса
Слайд 32Термодинамические процессы идеальных газов
К основным процессам, имеющим большое значение как
для теоретических исследований, так и для практических работ, относят
- изохорный
(v-const),
- изобарный (p-const),
- изотермический (T-const),
- адиабатный (q=0).
Слайд 33Основные законы идеальных газов
Бойль-Мариотт
(англ. физ. 1664; фр. хим. 1676)
Гей-Люссак
(фр.
физ. 1802)
Шарль
(фр. учен. 1787)
Идеальный газ – газ, в котором отсутствуют
силы взаимного притяжения и отталкивания между молекулами, а объем самих молекул пренебрежимо мал по сравнению с объемом газа
Слайд 34Уравнение состояния идеального газа
Слайд 35Удельная газовая постоянная – индивидуальна для каждого газа
термическое уравнение состояния
идеального газа – Клапейрон 1834
Слайд 36Смесь идеальных газов
В технике очень часто приходится иметь дело с
газообразными веществами, близкими по свойствам к идеальным газам и представляющими
механическую смесь отдельных газов
Для решения практических задач необходимо уметь определять основные параметры газовой смеси
Газовая смесь – смесь отдельных газов, не вступающих между собой ни в какие химические реакции
Каждый газ в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси
Слайд 37Молекулы газа создают давление на стенки сосуда, которое называется парциальным
(частичным)
Газовая смесь подчиняется закону Дальтона:
Общее давление смеси газов равно сумме
парциальных давлений отдельных газов, составляющих смесь
ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы он один находился в том же количестве, в том же объеме и при той же температуре, что и в смеси
Слайд 39Способы задания смеси газов:
Массовая концентрация
Объемная концентрация
Мольная концентрация
Слайд 40Молярная масса смеси газов
Газовая постоянная смеси газов
Слайд 41Соотношения между массовыми и объемными концентрациями