так как плоская граница (в отсутствие внешних сил) не может
существовать. Их можно наблюдать в сосудах, где сказывается кривизна поверхности, то есть когда расстояние между стенками соизмеримо с радиусом кривизны образующегося мениска жидкости.Капиллярное давление
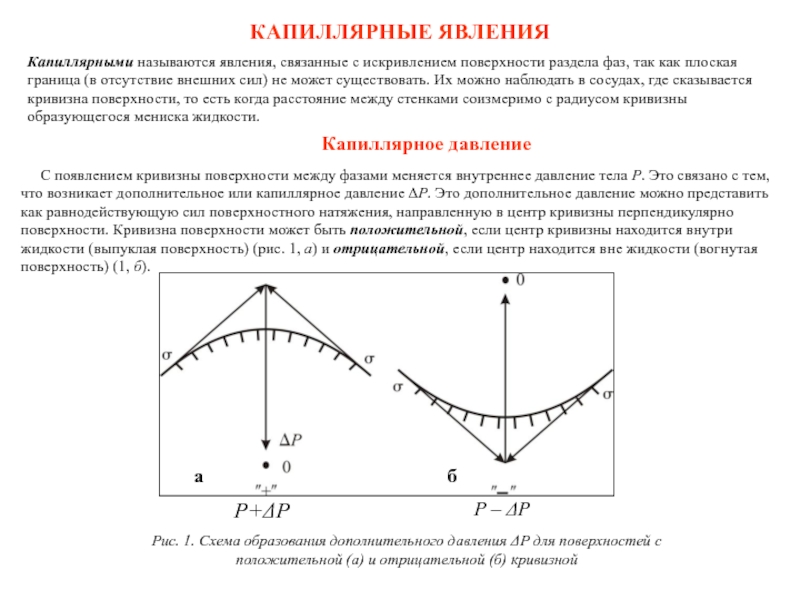
С появлением кривизны поверхности между фазами меняется внутреннее давление тела Р. Это связано с тем, что возникает дополнительное или капиллярное давление ∆Р. Это дополнительное давление можно представить как равнодействующую сил поверхностного натяжения, направленную в центр кривизны перпендикулярно поверхности. Кривизна поверхности может быть положительной, если центр кривизны находится внутри жидкости (выпуклая поверхность) (рис. 1, а) и отрицательной, если центр находится вне жидкости (вогнутая поверхность) (1, б).
Рис. 1. Схема образования дополнительного давления Р для поверхностей с положительной (а) и отрицательной (б) кривизной
а
б
P+ΔP
P – ΔP