Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Катализ
Содержание
- 1. Катализ
- 2. КатализВ общем случае катализ это ускорение реакции
- 3. КатализаторыЕсли катализатор не выходит в неизмен-ном виде,
- 4. Классификация каталитических процессов По фазовому составу
- 5. Гетерогенный катализВывод: Каждый катализатор ускоряет только конкретную реакцию или конкретный тип реакций.
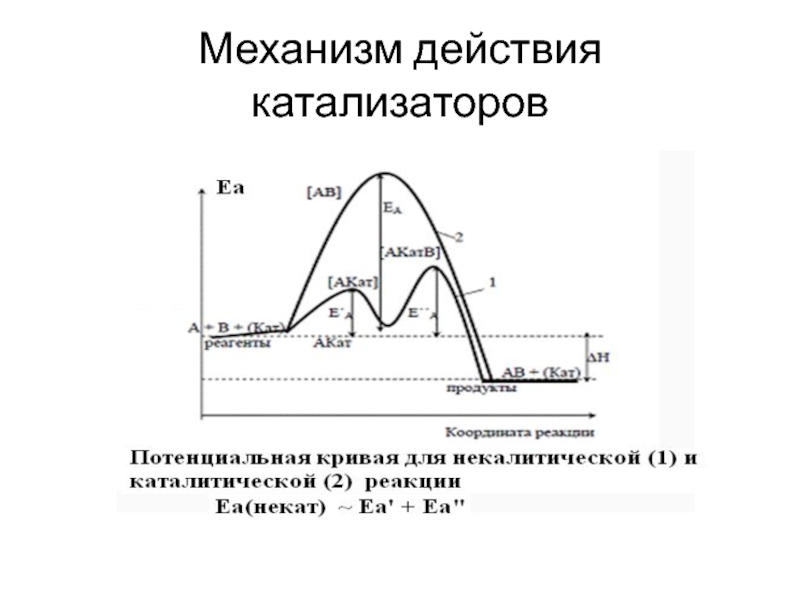
- 6. Механизм действия катализаторов
- 7. Эффективность катализатораВ гомогенном катализе мерой активности является
- 8. Эффективность катализатораИнтегральная избирательность или селективность – отношение
- 9. Виды гомогенного катализа Кислотно – основной (Катализатор
- 10. Кислотно – основной гомогенный катализ
- 11. Кислотно – основной катализПо C.Аррениусу (1884 г)
- 12. Кислотно – основной катализПо Дж.Брестеду и Т.Лоури
- 13. Кислотно – основной катализПо Г.Льюису кислота –
- 14. Общий механизм кислотно – основного катализа
- 15. Вывод уравнения
- 16. Анализ уравненияWp = k1k2CSCBH+/(k-1CB- + k2) 1. Предположим, что k-1CB-
- 17. Итоги по общему кислотно – основному катализуОбщий
- 18. Кислотно – основной катализПо Дж.Брестеду и Т.Лоури
- 19. Общий (Неспецифический) кислотный катализ Wp = k1CSCBH+=
- 20. Вернемся к общей схеме
- 21. 2. При условии k-1CB- >> k2 и
- 22. K3 = аBH+ /аB-aH+ =
- 23. Реакции специфического кислотно – основного катализаСпецифический кислотный
- 24. Специфический кислотный катализ в разбавленных растворах
- 25. Кислотно – основной катализПо C.Аррениусу (1884 г)
- 26. Специфический кислотный катализ в концентрированных растворахWp =
- 27. Слайд 27
- 28. Реакции электрофильно – нуклеофильного катализаЭлектрофильный катализ. В
- 29. Реакции электрофильно – нуклеофильного катализаНуклеофильный катализ. В
- 30. СуперкислотыТермин суперкислота введён Джеймсом Конантом в 1927
- 31. CуперкислотыМагическая кислота получила своё название за исключительную
- 32. Протонные суперкислотыК простым суперкислотам относят трифторметансульфоновую (CF3SO3H),
- 33. Карборановая кислотаКарборановая кислота — самая сильная кислота
- 34. Слайд 34
- 35. МЕТАЛЛОКOМПЛЕКСНЫЙ КАТАЛИЗОснован на взаимодействии субстрата с реагентом в координационной сфере
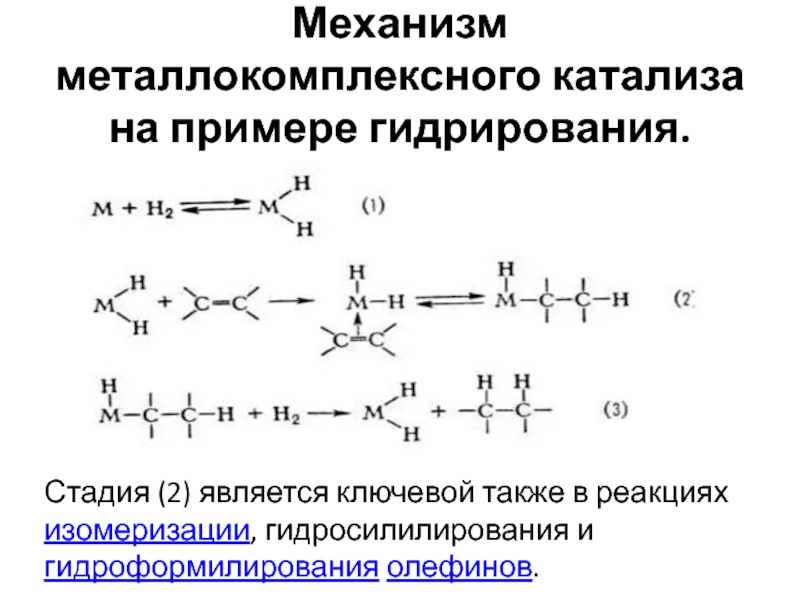
- 36. Механизм металлокомплексного катализа на примере гидрирования.Стадия (2) является ключевой также в реакциях изомеризации, гидросилилирования игидроформилирования олефинов.
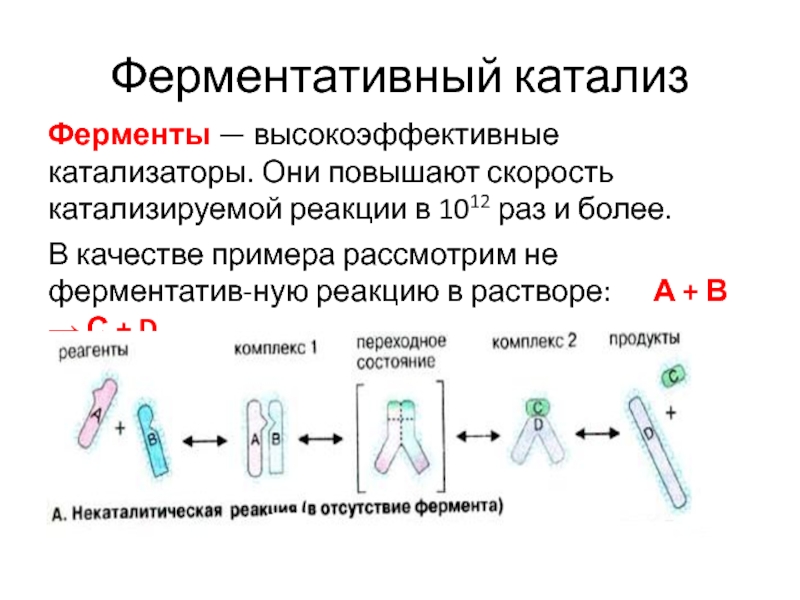
- 37. Ферментативный катализФерменты — высокоэффективные катализаторы. Они повышают
- 38. Неферментативный катализВещества A и В в растворе
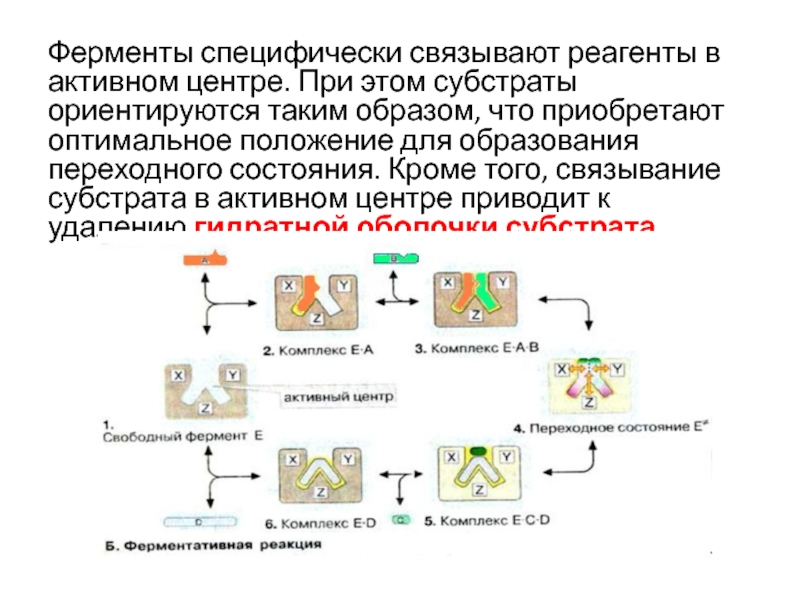
- 39. Ферменты специфически связывают реагенты в активном центре.
- 40. Основы ферментативного катализа
- 41. 1. Присоединение субстрата (S)к ферменту (Е) с
- 42. Типы ферментативных реакцийТип «пинг – понг»: Фермент
- 43. Тип - последовательных реакций: К ферменту последовательно
- 44. Механизмы катализаКислотно – основной катализ - в
- 45. Слайд 45
- 46. Слайд 46
- 47. Механизм Л.Михаэлиса и М.МентенаМеханизм простейшей кислотно –
- 48. Вывод уравненияДля нахождения концентрации CES применим МКСК:
- 49. Вывод уравненияТекущая концентрация CE по уравнению МБ
- 50. Анализ уравненияWp = k2 CS0CE0/(KМ + CS0)
- 51. Анализ уравненияФизический смысл константы Михаэлиса - она
- 52. Продолжение необходимого материала для экзамена
- 53. Кинетический и термодинамический контроль реакции
- 54. Температурный режимО кинетическом контроле прохождения химической реакции
- 55. Пример
- 56. Сульфирование нафталина
- 57. Схема реакции
- 58. Активационные параметры
- 59. Катализ – это все
- 60. Скачать презентанцию
КатализВ общем случае катализ это ускорение реакции под действием особых химических соединений – катализаторов.Катализатор – это вещество или тело, которые вступают в реакцию в одной или нескольких стадий и выходит в
Слайды и текст этой презентации
Слайд 2Катализ
В общем случае катализ это ускорение реакции под действием особых
химических соединений – катализаторов.
вступают в реакцию в одной или нескольких стадий и выходит в конце реакции в неизменном виде.Слайд 3Катализаторы
Если катализатор не выходит в неизмен-ном виде, а расходуется в
побочных реакциях, то такие стадии реакции называются стадиями отравления катализатора
(ингибирования) и вещества, способствующие протеканию побочных реакций называются каталитическими ядамиСлайд 4Классификация каталитических процессов
По фазовому составу каталитические реакции делятся:
Гомогенный
катализ (Исходные вещества и катализатор находятся в одной фазе)
Гетерогенный катализ
(Реакционная смесь и катализатор находятся в разных фазах). Реакция протекает на границе двух фаз, например,
газ – твердый катализатор
Ферментативный катализ ( Занимает промежу-
точное положение между гомогенным и гетероген-ным катализом, часто относят к микрогетерогенному)
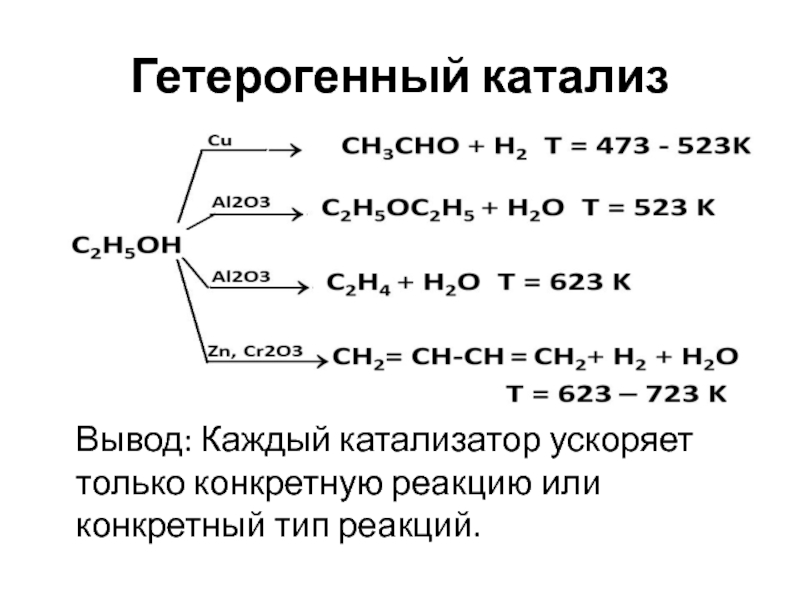
Слайд 5Гетерогенный катализ
Вывод: Каждый катализатор ускоряет только конкретную реакцию или конкретный
тип реакций.
Слайд 7Эффективность катализатора
В гомогенном катализе мерой активности является число оборотов реакции
nk (TOF), т.е. количество молекул, превращающихся за единицу времени на
одном активном центре : nk = W/Cкат ; С[моль/л]В гетерогенном катализе – удельная активность a = W/Sкат или a = W/mкат
Слайд 8Эффективность катализатора
Интегральная избирательность или селективность – отношение количества целевого продукта
к теоретически возможному из взятого количества исходного вещества: =
СПР/ СПР,теор*100%Самой высокой селективностью обладают ферменты и ряд гомогенных катализато-ров (95-100%). Для гетерогенного катализа обычно ниже (70%).
Слайд 9Виды гомогенного катализа
Кислотно – основной (Катализатор – кислота или
основание)
Металло –комплексный ( катализатор – ионы или металл, металлокомплексные соединения)
Ферментативный
(биокатализаторы - ферменты)Слайд 11Кислотно – основной катализ
По C.Аррениусу (1884 г) кислота – это
соединение, образующее при диссоциации в воде ионы водорода H3O+ ,
а основание – это соединение, образующее при диссоциации в воде гидроксид - ионы OН-Недостаток – применимо только для водных растворов
Слайд 12Кислотно – основной катализ
По Дж.Брестеду и Т.Лоури (1923 г) кислота
– это вещество, являющее донором протона, а основание – вещество,
являющее акцептором протона. В растворе сущест-вует кислотно – основное равновесие:HA + H2O H3O+ + A-
Кислота Основание Кислота Основание
Слайд 13Кислотно – основной катализ
По Г.Льюису кислота – это акцептор неподеленной
пары электронов, а основание вещество, являющее донором электронной пары.
Кислотами Льюиса
являются такие соединениями, как FeCl3, AlCl3, AlBr3, BF3 FeCl3 + :Cl- = FeCl-4
Основания: NH3, N2H4, NO3-, C6H5N
NH3 + Н+ = NН+4
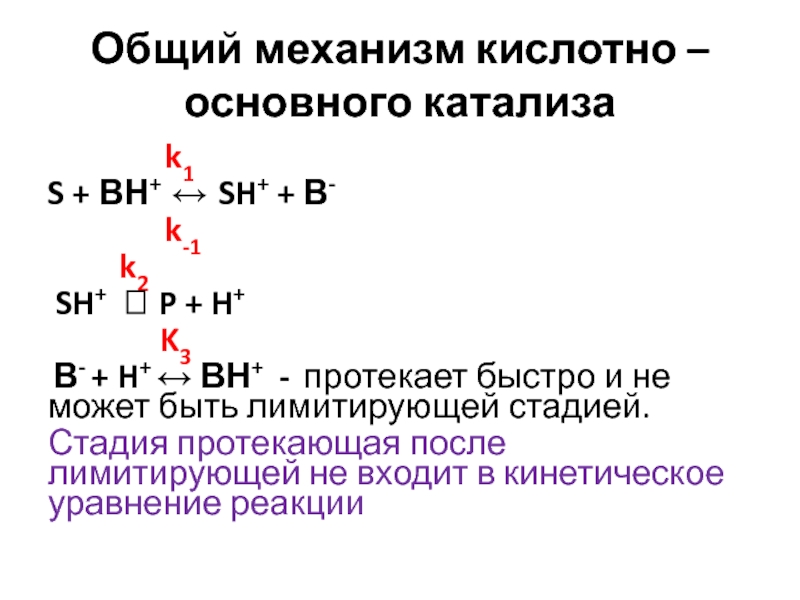
Слайд 14Общий механизм кислотно – основного катализа
k1
S + ВН+
SH+ + В- k-1
k2
SH+ P + H+
K3
В- + H+ ВН+ - протекает быстро и не может быть лимитирующей стадией.
Стадия протекающая после лимитирующей не входит в кинетическое уравнение реакции
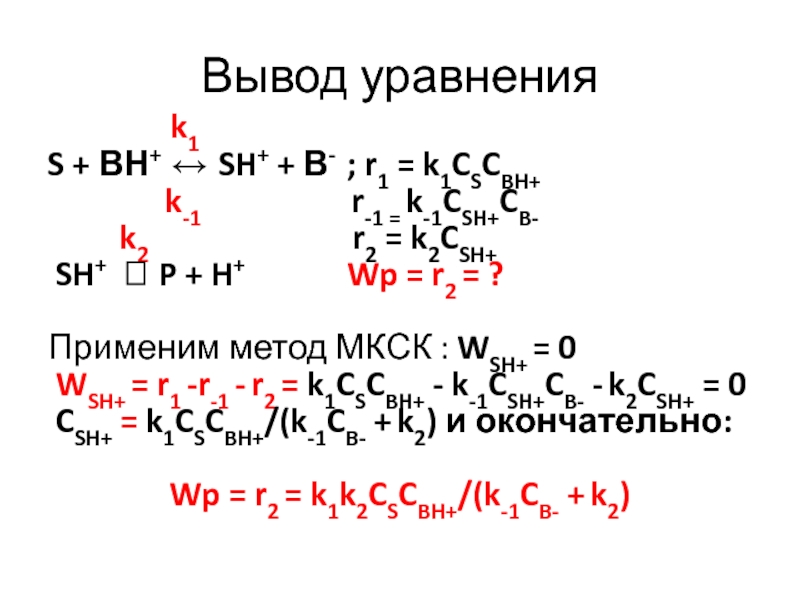
Слайд 15Вывод уравнения
k1
S + ВН+ SH+
+ В- ; r1 = k1CSCBH+k-1 r-1 = k-1CSH+CB-
k2 r2 = k2CSH+
SH+ P + H+ Wp = r2 = ?
Применим метод МКСК : WSH+ = 0
WSH+ = r1 -r-1 - r2 = k1CSCBH+ - k-1CSH+CB- - k2CSH+ = 0
CSH+ = k1CSCBH+/(k-1CB- + k2) и окончательно:
Wp = r2 = k1k2CSCBH+/(k-1CB- + k2)
Слайд 16Анализ уравнения
Wp = k1k2CSCBH+/(k-1CB- + k2)
1. Предположим, что k-1CB-
k1CSCBH+
Вывод: лимитирующая стадия первая (k1)
Скорость реакции имеет первый порядок по катализатору ВН+ (n=1), что подтверждает каталитический характер реакции
Это случай - общего кислотного (неспецифического) катализа.
Вывод: лимитирующая стадия первая (k1)
Скорость реакции имеет первый порядок по катализатору ВН+ (n=1), что подтверждает каталитический характер реакции
Это случай - общего кислотного (неспецифического) катализа.
Слайд 17Итоги по общему кислотно – основному катализу
Общий кислотный катализ .
В этом случае катализатором являются кислоты Бренстеда, т.е. НА (или
ВН+):S + ВН+ SH+ + В-
Общий основной катализ . В этом случае катализатором являются основания Бренстеда, т.е. В :
S + В ВH+ + S-
Лимитирующая стадия – это первая стадия образования SH+ или S-
Слайд 18Кислотно – основной катализ
По Дж.Брестеду и Т.Лоури (1923 г) кислота
– это вещество, являющее донором протона, а основание – вещество,
являющее акцептором протона. В растворе сущест-вует кислотно – основное равновесие:HA + H2O H3O+ + A-
Кислота Основание Кислота Основание
Слайд 19Общий (Неспецифический) кислотный катализ
Wp = k1CSCBH+= kнаблCS ; kнабл
= Wp/CS ;
kнабл = k’1CB’H+ k”1CB”H+ =
kiCBiH+Например реакция йодирования ацетона:
СH3COCH3 + HCl СH3C=CH2(OH) + Cl-
СH3C=CH2(OH) + J2 СH3COCH2 J + HJ
kнабл = k’1C HCl + k”1CHJ + k’”1CH2O
Слайд 20Вернемся к общей схеме
k1
S + ВН+ SH+ + В-
k-1
k2
SH+ P + H+
Wp = r2 = k1k2CSCBH+/(k-1CB- + k2)
2 случай: k-1CB- >> k2
Слайд 212. При условии k-1CB- >> k2 и получим:
Wp = k1k2CSCBH+/k-1CB-
= k2(k1/k-1)*CSCBH+/CB-
Wp = k2K1*CSCBH+/CB-
Воспользуемся третьей стадией
регенерации катализатораK3
В- + H+ ВН+
В растворе вместо Сi надо использовать активность ионов аi =i*Ci
K3 = аBH+ /аB-aH+
Слайд 22 K3 = аBH+ /аB-aH+ = CBH+/CB- aH+ *(B-/BH+
)
Обратите внимание, что мы оставили aH+
Отсюда получим, что
CBH+/CB-
= K3 aH+*B-/BH+ и окончательно Wp = k2K1K3CSaH+*B- /BH+
Этот случай называют специфическим кислотным катализом
Слайд 23Реакции специфического кислотно – основного катализа
Специфический кислотный катализ. В этом
случае катализатором являются кислоты Аррениуса, т.е. ионы H3O+ :
S + H3O+ SH+ + H2O P + H3O+Специфический основный катализ. В этом случае катализатором являются основания Аррениуса, т.е. ионы OН- :
S + OН- H2O + S- P + HA
Лимитирующей стадией является вторая стадия – распада SH+ или S-
Слайд 24
Специфический кислотный катализ в разбавленных растворах
Wp =
k2K1K3CSaH+*B- /BH+
В разбавленных растворах
B- /BH+ = 1 и
aH+= СH+ , тогда получим: Wp = k2K1K3CS СH+ = kнаблCS СH+
Лимитирующая стадия вторая и скорость реакции зависит от СH+
Слайд 25Кислотно – основной катализ
По C.Аррениусу (1884 г) кислота – это
соединение, образующее при диссоциации в воде ионы водорода H3O+ ,
а основание – это соединение, образующее при диссоциации в воде гидроксид - ионы OН-Слайд 26Специфический кислотный катализ в концентрированных растворах
Wp = k2K1Ka3CSaH+*B- /BH+ =kнаблCS(aH+B-
/BH+)
Гаммет ввел новую функцию называемую –кислотность: h0 = aH+B-
/BH+ или функция кислотности Н0 = -ln(aH+B- /BH+ )
Окончательно: Wp = kнаблCS h0
Функция Н0 является аналогом рН , который работает в области существенно большем чем значений рН = 0-14. (рН за пределами этого интервала не работает )
Слайд 28Реакции электрофильно – нуклеофильного катализа
Электрофильный катализ. В этом случае катализаторами
являются кислоты Льюиса и механизм включает образование с одним из
реагентов донорно – акцепторных связей.Примеры: - реакция Фриделя –Крафта –
Слайд 29Реакции электрофильно – нуклеофильного катализа
Нуклеофильный катализ. В этом случае катализаторами
являются основания Льюиса: амины,R3N, R2HN, RNH2 .
Принято обозначать нуклеофильное
замещение символом SN2 и для мономолекулярного замещения SN1.Напомним, что по Г.Льюису кислота – это акцептор неподеленной пары электронов, а основание вещество, являющее донором электронной пары.
Слайд 30Суперкислоты
Термин суперкислота введён Джеймсом Конантом в 1927 году для классификации
более сильных кислот, чем обычные минеральные кислоты. В 1994 году
Джордж Олах был удостоен Нобелевской премии[1] за своё исследование суперкислот и их применения в прямом наблюдении карбкатионов.Слайд 31Cуперкислоты
Магическая кислота получила своё название за исключительную способность растворять воск.
Она является смесью пентафторида сурьмы, который является кислотой Льюиса, и
фторсульфоновой кислоты — кислоты Брёнстеда.Сильнейшей суперкислотной системой является гексафторсурьмяная кислота, смесь плавиковой кислоты и пентафторида сурьмы [H+ SbF6−].
Фторсурьмяная кислота в 2·1019 раз сильнее 100%-ой серной кислоты
Слайд 32Протонные суперкислоты
К простым суперкислотам относят трифторметансульфоновую (CF3SO3H), хлорную , хлорсульфоновую,
пентафторэтансульфоновую, фторсульфоновую (FSO3H) кислоты.
Во многих случаях суперкислота является не
одиночным соединением, а смесью соединений, совмещаемых для достижения высокой кислотности.Слайд 33Карборановая кислота
Карборановая кислота — самая сильная кислота (суперкислота) из допускающих
возможность хранения в специальных сосудах.
Химическая формула — H(CHB11Cl11). Карборановая часть
молекулы имеет икосаэдрическую структуру.Карборановая кислота приблизительно в миллион раз сильнее концентрированной серной кислоты и позволяет растворять не только металлы, но и стекло, при достаточно долгом воздействии.
Слайд 35МЕТАЛЛОКOМПЛЕКСНЫЙ КАТАЛИЗ
Основан на взаимодействии субстрата с реагентом в координационной сфере комплекса металла. Металлокомплексный катализ может осуществляться
под действием гомогенных и гетерогенных металлокомплексных
катализаторов.
Основные типы реакций, катализируемых
комплексами металлов: гидрирование, синтезы с участием оксида углерода,
полимеризация.
Слайд 36Механизм металлокомплексного катализа на примере гидрирования.
Стадия (2) является ключевой также в
реакциях изомеризации, гидросилилирования и
гидроформилирования олефинов.
Слайд 37Ферментативный катализ
Ферменты — высокоэффективные катализаторы. Они повышают скорость катализируемой реакции
в 1012 раз и более.
В качестве примера рассмотрим не
ферментатив-ную реакцию в растворе: А + В → С + D. Слайд 38Неферментативный катализ
Вещества A и В в растворе окружены оболочкой из
молекул воды (гидратной оболочкой) и под действием теплового движения перемещаются
случайным образом. Они могут вступать в реакцию друг с другом только в том случае, когда сталкиваются в благоприятной ориентации, что маловероятно и происходит редко.В растворе большая часть Еа расходуется на преодоление гидратных оболочек между A и В, сближение реагентов и другие химические процессы, в которых эти реагенты участвуют.
Слайд 39Ферменты специфически связывают реагенты в активном центре. При этом субстраты
ориентируются таким образом, что приобретают оптимальное положение для образования переходного
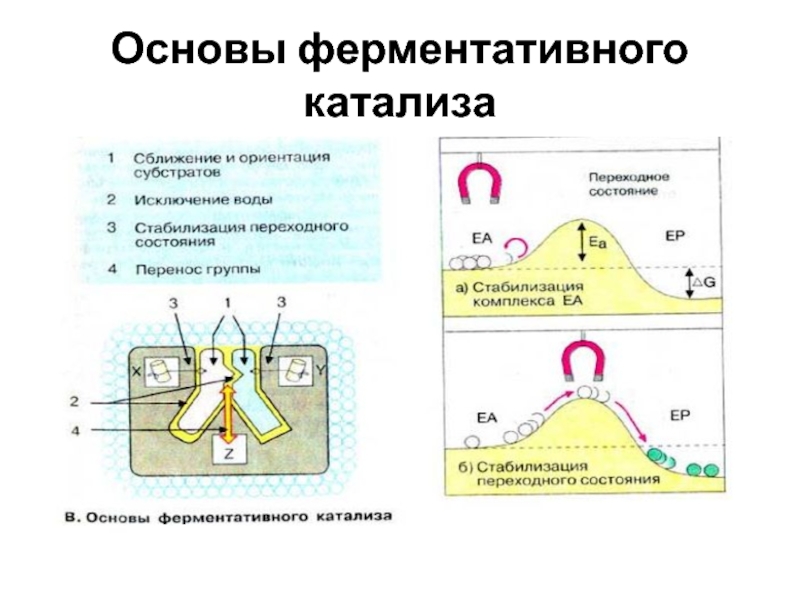
состояния. Кроме того, связывание субстрата в активном центре приводит к удалению гидратной оболочки субстратаСлайд 411. Присоединение субстрата (S)к ферменту (Е) с образованием фермент –субстратного
комплекса ЕS.
2. Преобразование фермент – субстратного комплекса в один или
несколько переходных комплексов (Е-Х) за одну или несколько стадий3. Превращение переходного комплекса в комплекс фермент – продукт (Е-Р)
4. Отделение конечных продуктов от фермента.
Основные стадии катализа
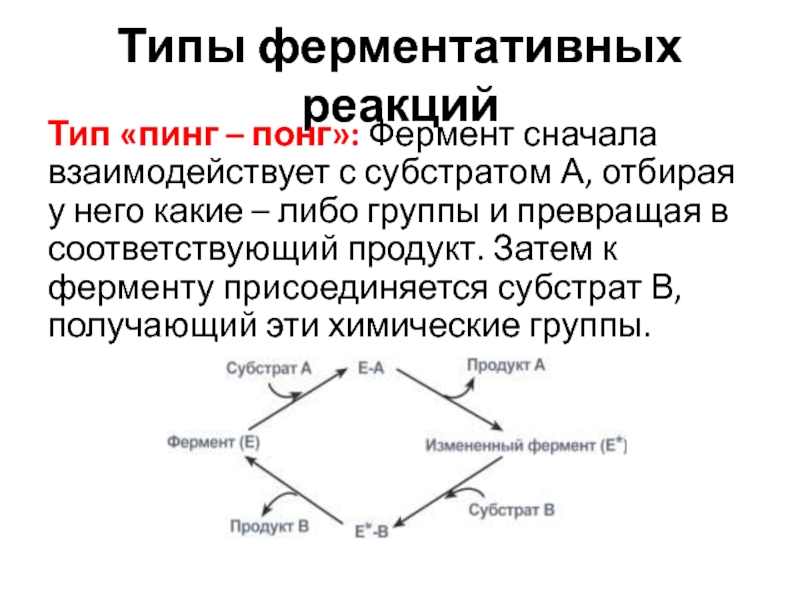
Слайд 42Типы ферментативных реакций
Тип «пинг – понг»: Фермент сначала взаимодействует с
субстратом А, отбирая у него какие – либо группы и
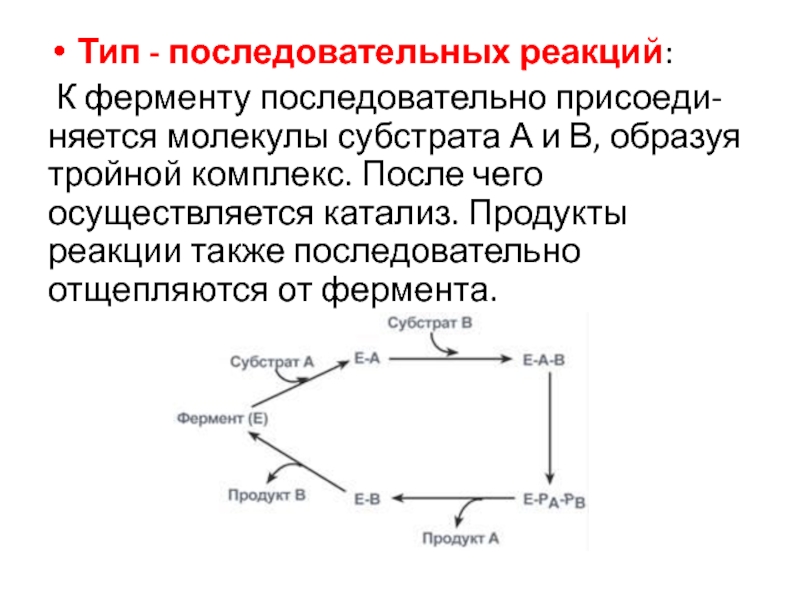
превращая в соответствующий продукт. Затем к ферменту присоединяется субстрат В, получающий эти химические группы.Слайд 43Тип - последовательных реакций:
К ферменту последовательно присоеди-няется молекулы субстрата
А и В, образуя тройной комплекс. После чего осуществляется катализ.
Продукты реакции также последовательно отщепляются от фермента.Слайд 44Механизмы катализа
Кислотно – основной катализ - в активном центре фермента
находятся группы специфических аминокислотных остатков, которые являются донорами или акцепторами
протонов.Слайд 47Механизм Л.Михаэлиса и М.Ментена
Механизм простейшей кислотно – основной (КО) ферментативной
реакции: E enzyme
k1 Е + S ЕS ; r1 = k1CSCE
k-1 r-1 = k-1CES
k2 r2 = k2CES
ЕS P + Е; где Е – фермент и S - субстрат
Лимитирующей стадией специфического КО катализа является вторая стадия – распада ES : Wp = r2 = ? ; Второе условие S0 >> Е0
Слайд 48Вывод уравнения
Для нахождения концентрации CES применим МКСК:
WES = r1
- r-1 - r2 = k1CSCE - k-1CES - k2CES
=0CES = k1CSCE /(k-1 + k2) = KМCSCE;
Введем обозначение
KМ = (k-1 + k2)/k1 ,
где KМ – константа Михаэлиса ;
Тогда CES = CSCE/KМ
Слайд 49Вывод уравнения
Текущая концентрация CE по уравнению МБ
CE
= CE0 - CES ;CES = CSCE/KМ = CS(CE0 - CES )/KМ отсюда
CES = CSCE0/(KМ + CS)
Окончательно
Wp = k2CES = k2CSCE0/(KМ + CS)
Напомним, что CS0 >> CE0 и следовательно:
CS CS0 - (метод избыточных концентраций)
Слайд 50Анализ уравнения
Wp = k2 CS0CE0/(KМ + CS0)
Обозначим : Wmax
= k2CE0
– это максимальная скорость образования продукта в начальный
момент времени и тогда:Wp = WmaxCS0/(KМ + CS0)
- уравнение Михаэлиса – Ментена для ферментативного катализа
Слайд 51Анализ уравнения
Физический смысл константы Михаэлиса - она численно равна концентрации
субстрата (Км = [S]0), при которой активность фермента составляет половину
максимальной, т. е.Wp = Wmax/ 2.
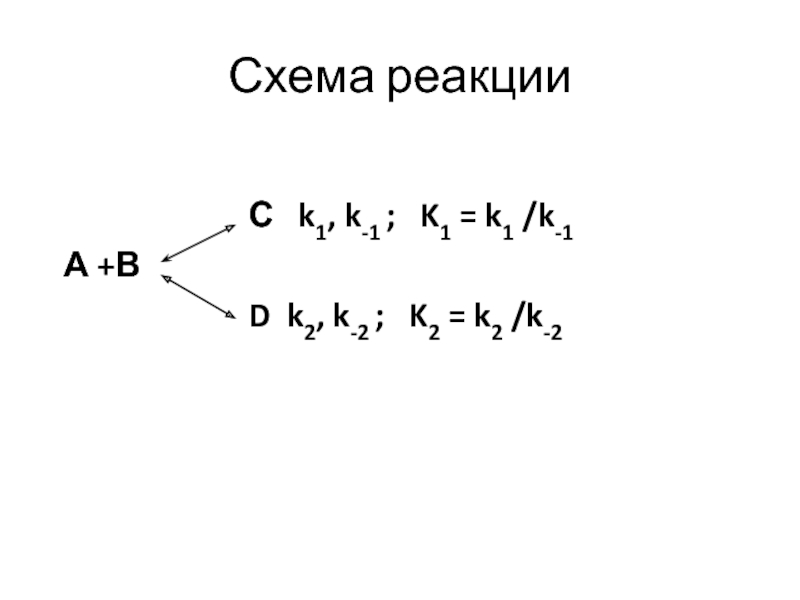
Слайд 53Кинетический и термодинамический контроль реакции
А
+В С + DРеагенты А +В образуют два продукта С и D
и их соотношение зависит от температуры. Состав продуктов может определятся термодинамикой равновесной системы, т.е. реакция подчинятся термодинамическому контролю. В других случаях, состав смеси продуктов может определяться скоростями конкурирующих реакций образования возможных продуктов (кинетический контроль реакции).
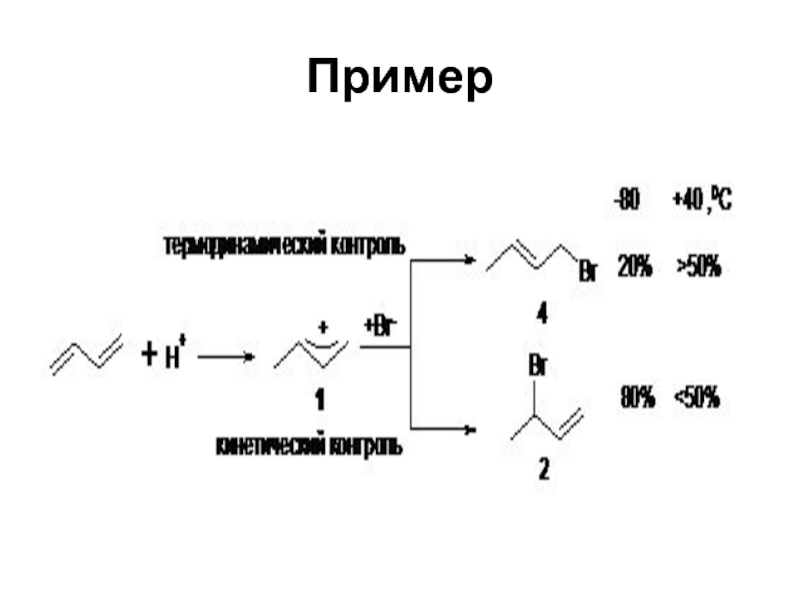
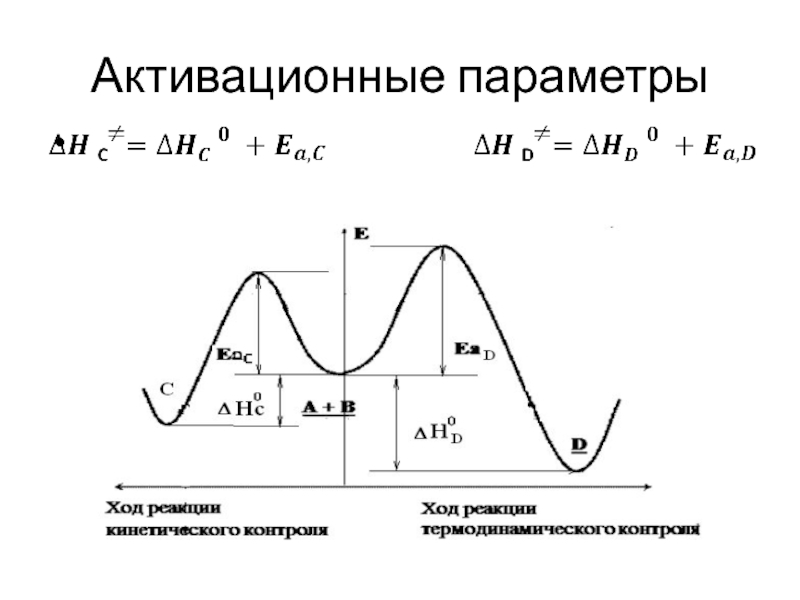
Слайд 54Температурный режим
О кинетическом контроле прохождения химической реакции говорят когда из
двух или более возможных продуктов реакции образуется преимущественно продукт более
быстрой реакции, как правило, менее энергетически выгодный и образуется при более низких температурах.Термодинамический контроль - продукт образуется при более высоких температурах.







































![Катализ Анализ уравненияФизический смысл константы Михаэлиса - она численно равна концентрации субстрата Анализ уравненияФизический смысл константы Михаэлиса - она численно равна концентрации субстрата (Км = [S]0), при которой активность](/img/thumbs/9e999be0cbfbd326e6fd5f8f4bf4431f-800x.jpg)























![Автоматизация звука
[ Р ] в слогах, словах, фразе,
предложениях, тексте у детей](/img/tmb/6/577954/93493577f437aaf90501124d2c9eb7d6-800x.jpg)