Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Катионы IV (Al 3+, Cr 3+, Zn 2+, Sn 2+, Sn (IV), As (III), As
Содержание
- 1. Катионы IV (Al 3+, Cr 3+, Zn 2+, Sn 2+, Sn (IV), As (III), As
- 2. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 3. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 4. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 5. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 6. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 7. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 8. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 9. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 10. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 11. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 12. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 13. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 14. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 15. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 16. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 17. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 18. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 19. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 20. Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+,
- 21. Слайд 21
- 22. Слайд 22
- 23. Скачать презентанцию
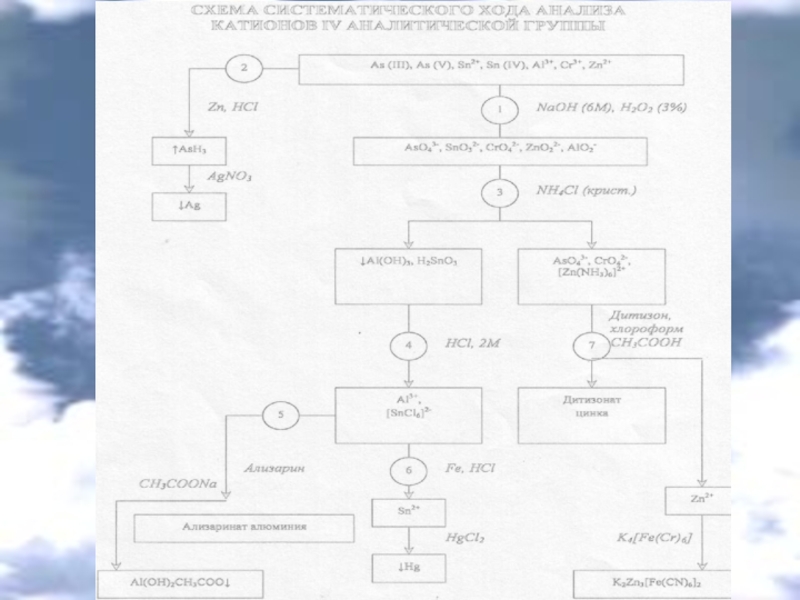
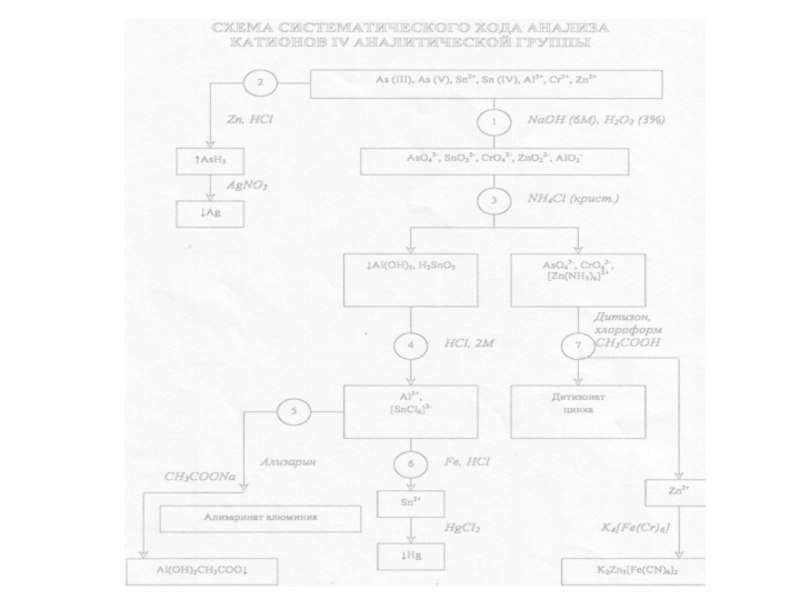
Катионы IV аналитической группыAl3+, Cr3+, Zn2+, Sn2+, Sn (IV), As (III), As (V)Действие группового реагента (избыток 6М раствора NaOH в присутствии 3% раствора H2O2):AlCl3 + 3NaOH → Al(OH)3↓+ 3NaClAl(OH)3↓ + 3NaOH
Слайды и текст этой презентации
Слайд 2Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Действие группового реагента (избыток 6М раствора NaOH в
присутствии 3% раствора H2O2):AlCl3 + 3NaOH → Al(OH)3↓+ 3NaCl
Al(OH)3↓ + 3NaOH → Na3[Al(OH)6]
CrCl3+ 3NaOH → Cr(OH)3↓ + 3NaCl
Cr(OH)3↓ + 3NaOH → Na3[Cr(OH)6]
2Na3[Cr(OH)6] + 3H2O2 →
→ 2Na2CrO4 + 2NaОН + 8H2O
Слайд 3Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Действие группового реагента:
ZnCl2 + 2NaOH → Zn(OH)2↓ +
2NaCl Zn(OH)2↓ + 2NaОH → Na2[Zn(OH)4]
SnCl2 + 2NaOH → Sn(OH)2↓+ 2NaCl
Sn(OH)2↓ + 2NaОН → Na2[Sn(OH)4]
Na2[Sn(OH)4] + H2O2 → Na2[Sn(OH)6]
Na2[SnCl6] + 4NaOH → Sn(OH)4↓ + 6NaCl
Sn(OH)4↓ + 2NaОH → Na2[Sn(OH)6]
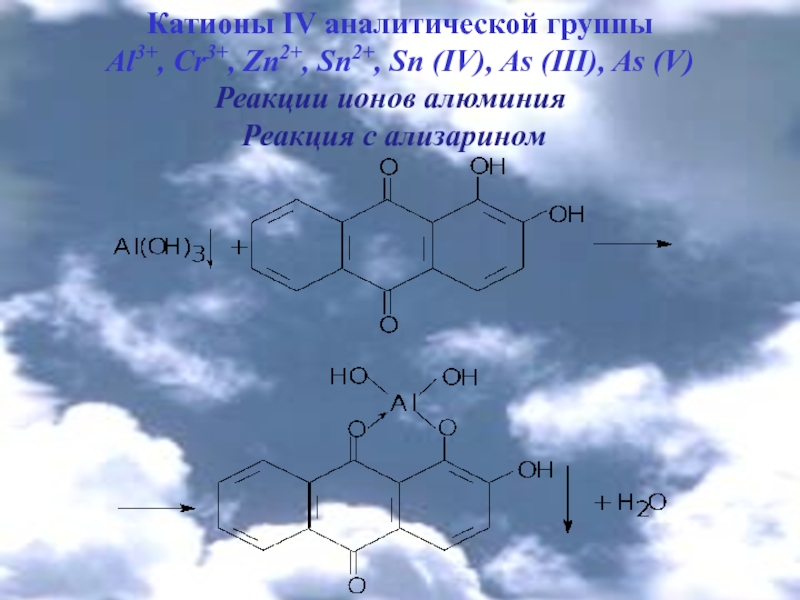
Слайд 4Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов алюминия
Реакция с ализарином
Слайд 5Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов алюминия
Реакция с раствором натрия ацетата CH3COONa
AlCl3
+ 3CH3COONa + 2H2O →→Al(OH)2CH3COO↓+2CH3COOH+3NaCl
Al(OH)2CH3COO↓ + 3НNO3 →
→ Al(NO3)3 + CH3COOH + 2H2O
Al(OH)2CH3COO↓ + 4KОН →
→K3[Al(ОН)6] + CH3COOK
Слайд 6Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов алюминия
Реакция с солями кобальта
4Al(OH)3 + 2Co(NO3)2
→ 2Co(AlO2)2 + 4NO2↑ + O2↑ +6H2O
Слайд 7Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов хрома (III)
Реакция с пероксидом водорода в
кислой среде2Cr3+ + 7H2O – 6e ↔ Cr2O72- + 14H+ 1
H2O2 + 2Н+ + 2e ↔ 2H2O 3
_____________________________________________________________________________________________________________________________________________________
2Cr3+ + 3H2O2 + H2O → Cr2O72- + 8H+
Слайд 8Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов хрома (III)
Реакция с пероксидом водорода в
кислой средеCr2O72-+3H2O – 8e ↔ 2CrO(О2)2+6H+ 1
H2O2 + 2Н+ + 2e ↔ 2H2O 4
______________________________________________________________________________________________________________________________________________________________________
Cr2O72- + 4H2O2 + 2H+→2CrO(О2)2 + 5H2O
Суммарная реакция взаимодействия Cr3+-ионов с Н2О2 в кислой среде имеет вид:
Cr3+ + 7H2O2 2CrO(О2)2 + 6Н+ + 4H2O
Слайд 9Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов хрома (III)
Образование перлов буры
3Na2B4O710H2O + 2Cr(OH)3
→ 2Cr(BO2)3 + 6NaBO2 + 13H2O
Слайд 10Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов цинка
Реакция с калия гексацианоферратом (ІІ)
K4[Fe(CN)6]3ZnCl2 + 2K4[Fe(CN)6] →
→ K2Zn3[Fe(CN)6]2↓ + 6KCl
K2Zn3[Fe(CN)6]2↓ + 12KОН →
→ 3K2[Zn(OH)4] + 2K4[Fe(CN)6]
Слайд 11Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов цинка
Реакция с сульфидами
ZnCl2 + Na2S
→ ZnS↓ + 2NaClZnS↓ + 2НNO3 → Zn(NO3)2 + Н2S
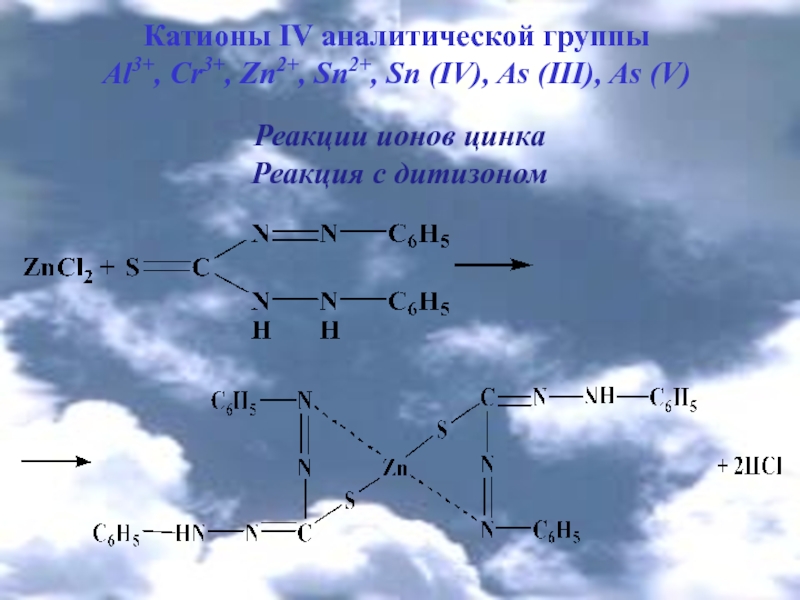
Слайд 12Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов цинка
Реакция с дитизоном
Слайд 13Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов олова (Sn2+)
Реакция с солями ртути (II)
HgCl2
+ SnCl2 → Hg2Cl2↓ + SnCl42Hg2+ + 2Cl- + 2e ↔ Hg2Cl2↓ 1
Sn2+ - 2е ↔ Sn4+ 1
___________________________________________________________________________________________________________________________________________________________________________________________
2Hg2+ + 2Cl- + Sn2+ ↔ Hg2Cl2↓ + Sn4+
Слайд 14Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов олова (Sn2+)
Реакция с солями ртути (II)
Hg2Cl2↓
+ SnCl2 → 2Hg↓ + SnCl4Hg2Cl2↓ + 2e ↔ 2Hg↓ + 2Cl- 1
Sn2+ - 2е ↔ Sn4+ 1
_____________________________________________________________________________________________________________________________________________________________________
Hg2Cl2↓ + Sn2+ ↔ 2Hg↓ + Sn4+
Слайд 15Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов олова (Sn2+)
Реакция с сульфид-ионами
SnCl2 +
H2S → SnS↓ + 2HClСлайд 16Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов мышьяка (III) и (V)
Реакция с сероводородом
H2SВ растворах арсенитов в кислой среде мышьяк (III) присутствует в виде HAsO2, а в сильнокислых – As3+:
НAsO2 + 3H+ ↔ As3+ + 2H2O
Cероводород или раствор Na2S образует желтый осадок As2S3:
Суммарно этот процесс можно представить уравнением:
2НAsO2 + 3H2S → As2S3↓ + 4H2O
Слайд 17Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов мышьяка (III) и (V)
Реакция с сероводородом
H2SПри действии H2S или Na2S на подкисленные хлороводородной кислотой растворы арсенатов выпадает осадок As2S5 :
2As5+ + 5H2S As2S5 + 10H+
Слайд 18Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов мышьяка (III) и (V)
Восстановление As (III)
и As (V) до арсина (AsH3)Металлический цинк в кислой среде восстанавливает As (III) и As (V) до газообразного арсина AsH3:
H3AsO3+3Zn+6HClAsH3+3ZnCl2+3H2O
H3AsO4+4Zn+8HClAsH3+4ZnCl2+4H2O
Слайд 19Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов мышьяка (III) и (V)
Восстановление As (III)
и As (V) до арсина (AsH3)6AgNO3 + AsH3 + 3H2O
H3AsO3 + 6Ag + 6HNO3
Слайд 20Катионы IV аналитической группы
Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As
(III), As (V)
Реакции ионов мышьяка (III) и (V)
Восстановление As (III)
и As (V) до арсина (AsH3)AsH3 + [HgCl2] AsH2HgCl + HCl
AsH3 + 2[HgCl2] AsН(HgCl)2 + 2HCl
AsH3 + 3[HgCl2] As(HgCl)3 + 3HCl
AsH3 + As(HgCl)3 As2Hg3 + 3HCl