Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классификация дисперсных систем
Содержание
- 1. Классификация дисперсных систем
- 2. КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ. ЭЛЕКТРОКИНЕТИЧЕСКИЕ СВОЙСТВА И УСТОЙЧИВОСТЬ
- 3. Коллоидная химия ‒ …… наука о поверхностных
- 4. Основные понятия:Дисперсность ‒ мерой её служит удельная
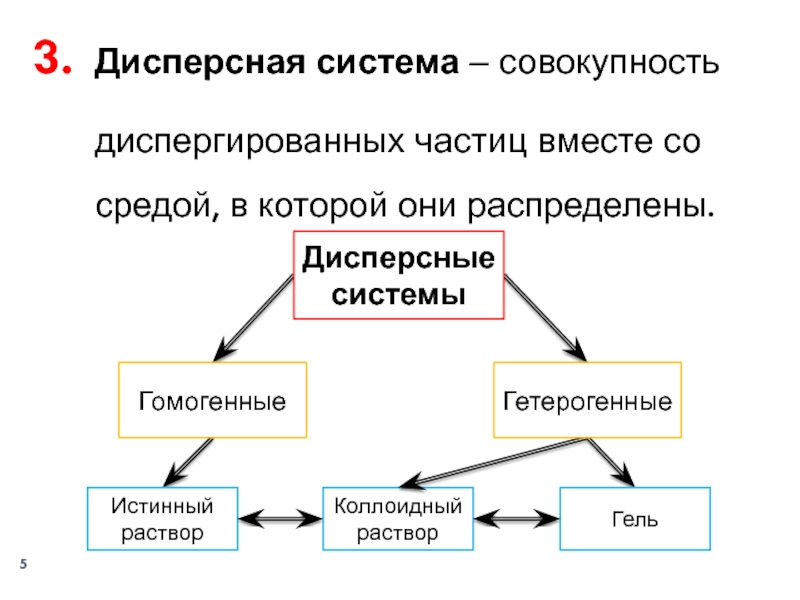
- 5. Дисперсная система ‒ совокупность диспергированных частиц вместе со средой, в которой они распределены.Дисперсные системыГомогенныеИстинный растворКоллоидный растворГельГетерогенные
- 6. Дисперсная фаза (ДФ) ‒ совокупность диспергированных частиц,
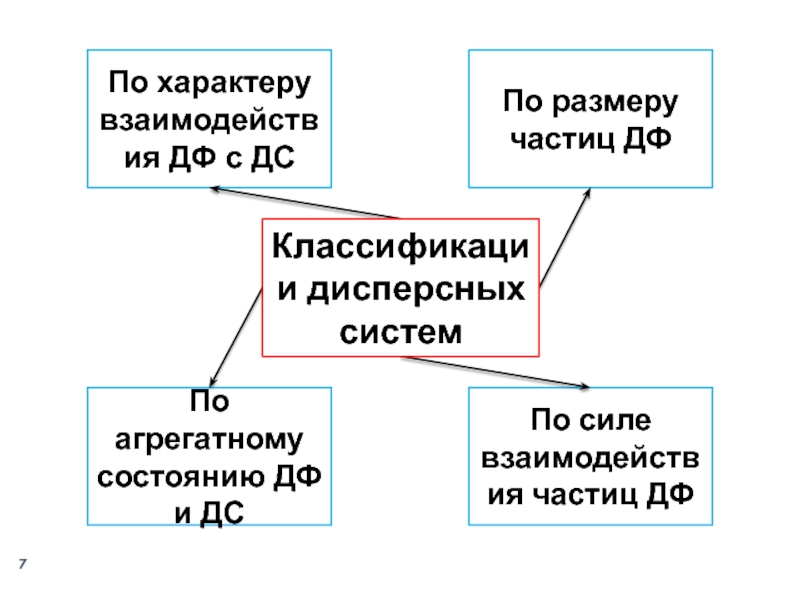
- 7. По размеру частиц ДФ По характеру взаимодействия
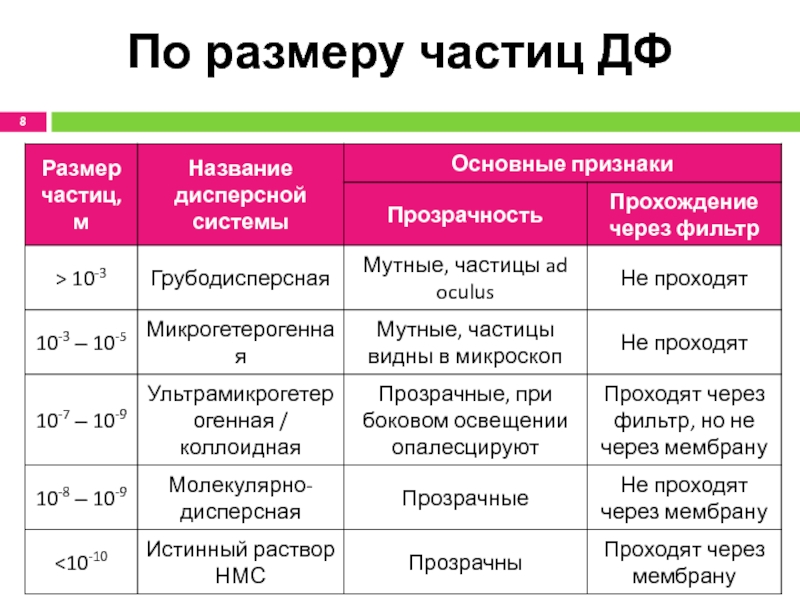
- 8. По размеру частиц ДФ
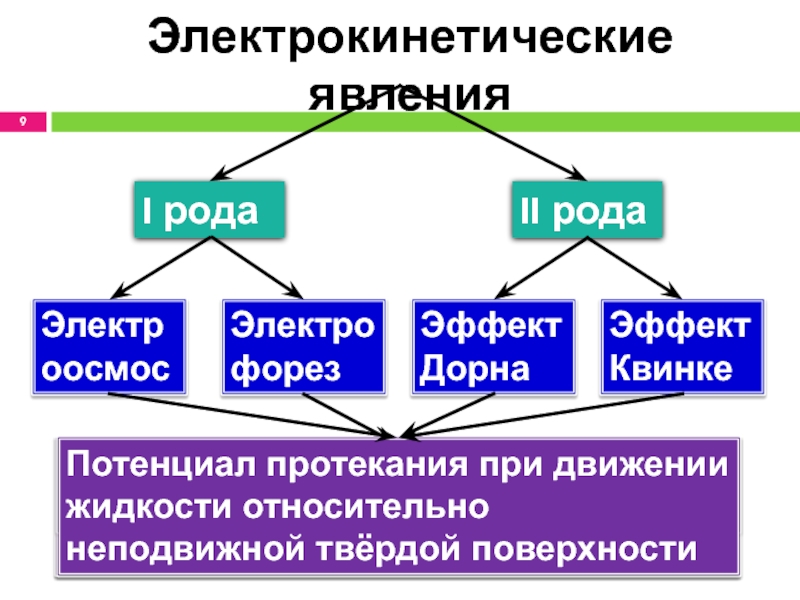
- 9. Электрокинетические явленияI родаII родаЭлектрофорезЭлектроосмосЭффект ДорнаЭффект КвинкеДвижение частиц
- 10. Мицеллярная теория лиофобных золейМицелла ‒ гетерогенная микросистема,
- 11. Мицеллярная теория лиофобных золей – агрегат с
- 12. Мицеллярная теория лиофобных золей– ядро с адсорбционным
- 13. Получение золя конденсационным методом по реакции обменаBaCl2 + H2SO4 ? BaSO4↓ + 2HClизбытокагрегатBa2+2Cl–ПОИпротивоионстабилизаторm[BaSO4]·nBa2+·(2n – x)Cl–{}x+·xCl–
- 14. Мицелла{m[BaSO4] • nBa2+ (2n – x)Cl–}x+ • xCl–агрегатадсорбционный слойядрогрануладиффузионный слойМИЦЕЛЛА
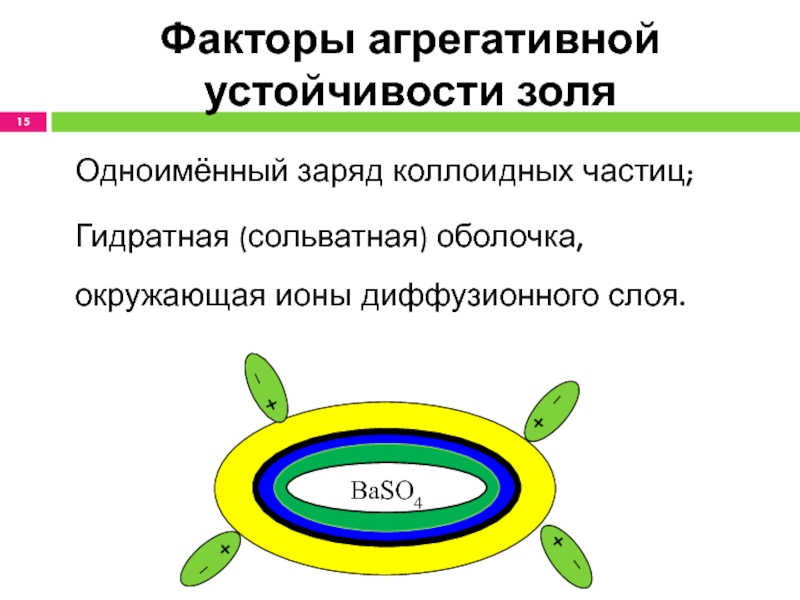
- 15. Факторы агрегативной устойчивости золяОдноимённый заряд коллоидных частиц;Гидратная (сольватная) оболочка, окружающая ионы диффузионного слоя.BaSO4
- 16. Возникновение ДЭС и потенциалов в мицелле{m[BaSO4] •
- 17. Возникновение ДЭС и потенциалов в мицеллеПо величине
- 18. Факторы, влияющие на ζКонцентрация стабилизатора.Состояние ИЭТ золя,
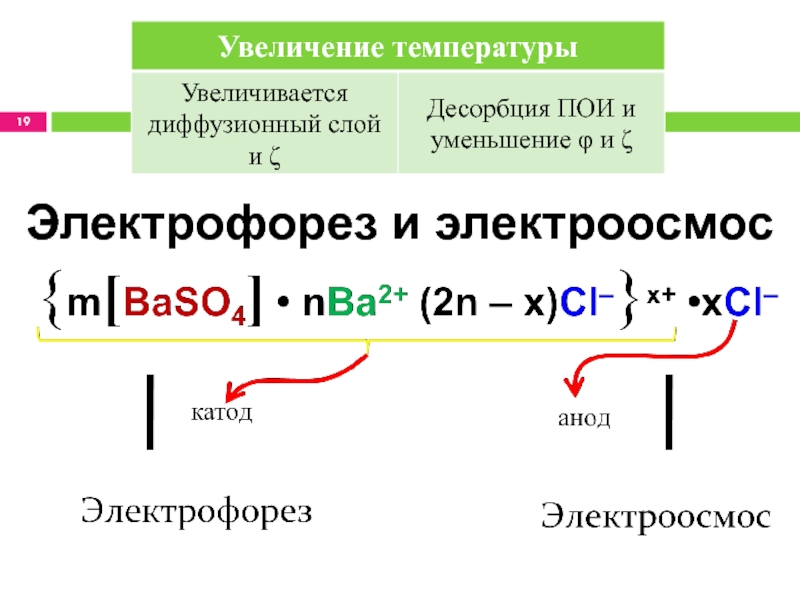
- 19. Электрофорез и электроосмос
- 20. Расчёт ζПоскольку ζ обнаруживает себя при попадании
- 21. Виды устойчивости растворов (по Пескову)… устойчивость ДФ
- 22. Коагуляция ‒ …… процесс слипания частиц, образование
- 23. Факторы, вызывающие коагуляциюУвеличение концентрации золя приводит к
- 24. Факторы, вызывающие коагуляциюДобавление электролитов наиболее сильное по
- 25. При изучении влияния электролитов на коагуляцию следует
- 26. чем выше заряд коагулирующего иона, тем меньше
- 27. Правило Дерягина ‒ Ландау …… устанавливает связь
- 28. Способность ионов одного заряда к гидратации (лиотропные ряды)Факторы, вызывающие коагуляциюКоагулирующая способностьСтепень гидратации ионов
- 29. Факторы, вызывающие коагуляцию«Ионы-партнёры», идущие в паре с
- 30. Смесями электролитов;Многозарядными ионами‒коагуляторами (чередование зон коагуляции);При смешивании
- 31. Аддитивность(суммирование γ ионов одинакового q и близких
- 32. 2. Чередование зон коагуляции‒+++‒‒‒‒ ζ+ ζ0‒ 30
- 33. 3. Гетерокоагуляция+‒0Причина явления ‒ электростатическое притяжение частиц
- 34. … вызвана добавлением очень малых количеств ВМС
- 35. Вывод: адсорбционный слой является механическим препятствием для
- 36. Защитное число …… min масса ВМС (мг),
- 37. Процесс перехода свежевыпавшего при коагуляции осадка во
- 38. ---Теории коагуляцииАдсорбционная(Фрейндлих)Адсорбция ионов – коагулянтов на агрегате
- 39. спасибо за внимание!
- 40. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ. ЭЛЕКТРОКИНЕТИЧЕСКИЕ СВОЙСТВА И УСТОЙЧИВОСТЬ КОЛЛОИДНЫХ РАСТВОРОВ
Лекция №8
Лектор:
к.х.н., доцент Иванова Надежда Семёновна
Слайд 3Коллоидная химия ‒ …
… наука о поверхностных явлениях и дисперсных
системах.
… наука о коллоидном состоянии вещества.
… физика и химия реальных
тел.Слайд 4Основные понятия:
Дисперсность ‒ мерой её служит удельная поверхность (Sуд). Sуд
‒ площадь раздела фаз, приходящаяся на единицу массы или объёма
дисперсной фазы.Sуд = 6 · а-1
Гетерогенность ‒ мерой её служит поверхностное натяжение (σ ‒ величина энергии единицы поверхности).
Слайд 5Дисперсная система ‒ совокупность диспергированных частиц вместе со средой, в
которой они распределены.
Дисперсные системы
Гомогенные
Истинный раствор
Коллоидный раствор
Гель
Гетерогенные
Слайд 6Дисперсная фаза (ДФ) ‒ совокупность диспергированных частиц, размеры которых больше
молекулярных.
Дисперсионная среда (ДС) ‒ однородная непрерывная фаза, в которой возможен
переход из одной точки в другую без выхода за пределы этой фазы.Дисперсность и гетерогенность связаны друг с другом GS = σ · S. Для объекта коллоидной химии, дисперсной системы, GS велика, что делает его термодинамически неустойчивым.
Слайд 7По размеру частиц ДФ
По характеру взаимодействия ДФ с ДС
По
агрегатному состоянию ДФ и ДС
По силе взаимодействия частиц ДФ
Классификации дисперсных
системСлайд 9Электрокинетические явления
I рода
II рода
Электрофорез
Электроосмос
Эффект Дорна
Эффект Квинке
Движение частиц ДФ в неподвижной
ДС
Движение жидкости относительно неподвижной твёрдой поверхности пористых мембран
Потенциал оседания при
движении частиц ДФ в неподвижной жидкостиПотенциал протекания при движении жидкости относительно неподвижной твёрдой поверхности
Слайд 10Мицеллярная теория лиофобных золей
Мицелла ‒ гетерогенная микросистема, состоящая из микрокристалла
ДФ, окружённого сольватированными ионами стабилизатора.
В мицелле выделяют следующие части:
‒ микрокристаллы
ДФ; их число определяют «m».АГРЕГАТ
Слайд 11Мицеллярная теория лиофобных золей
– агрегат с адсорбированными на нём
потенциалопределяющими ионами (ПОИ).
– ионы, сообщающие заряд коллоидной частице; находят по
правилу Панета – Фаянса – Гана. Их число определяют «n».– ионы, заряд которых противоположен заряду ПОИ.
ЯДРО
ПОИ
ПРОТИВОИОНЫ
Входят в адсорбционный слой противоионов, прочно связанных электростатическим притяжением с ядром; «n – x».
Входят в диффузионный слой противоионов, число которых равно «х»
Слайд 12Мицеллярная теория лиофобных золей
– ядро с адсорбционным слоем противоионов, являющаяся
гигантским многозарядным ионом.
Источником ПОИ и противоионов являются стабилизаторы – электролиты
(один из реагентов, продукт реакции, постороннее вещество).ГРАНУЛА / КОЛЛОИДНАЯ ЧАСТИЦА
Слайд 13Получение золя конденсационным методом по реакции обмена
BaCl2 + H2SO4 ?
BaSO4↓ + 2HCl
избыток
агрегат
Ba2+
2Cl–
ПОИ
противоион
стабилизатор
m[BaSO4]
·nBa2+
·(2n – x)Cl–
{
}
x+
·xCl–
Слайд 14Мицелла
{m[BaSO4] • nBa2+ (2n – x)Cl–}x+ • xCl–
агрегат
адсорбционный слой
ядро
гранула
диффузионный слой
МИЦЕЛЛА
Слайд 15
Факторы агрегативной устойчивости золя
Одноимённый заряд коллоидных частиц;
Гидратная (сольватная) оболочка, окружающая
ионы диффузионного слоя.
BaSO4
Слайд 16Возникновение ДЭС и потенциалов в мицелле
{m[BaSO4] • nBa2+ (2n –
x)Cl–}x+ • xCl–
На границе между ядром и всеми противоионами возникает
ДЭС и потенциал, который называется электротермодинамическим (ϕ,ε)На границе между гранулой и противоионами диффузионного слоя возникает ДЭС и электрокинетический потенциал (ζ)
Слайд 17Возникновение ДЭС и потенциалов в мицелле
По величине 0 ≤ ζ
< ϕ. При ζ = 0 имеет место изоэлектрическая точка
золя (ИЭТ), в которой происходит полное разрушение золя.ζкрит. = ±30 мВ. При этом значении золь начинает разрушаться.
Т.о., по величине ζ можно судить об устойчивости золя: чем больше ζ, тем устойчивее золь.
Слайд 18Факторы, влияющие на ζ
Концентрация стабилизатора.
Состояние ИЭТ золя, ζ = 0.
Золь разрушается.
Концентрация посторонних электролитов.
При введении посторонних электролитов, ионы которых обладают
более высокой адсорбционной способностью, чем ионы стабилизатора, возможна перезарядка частиц золя.{m[BaSO4] • nBa2+
xCl–
x+
0
• 2nCl–}
(2n – x)Cl–}
Слайд 20
Расчёт ζ
Поскольку ζ обнаруживает себя при попадании мицеллы в электрическое
поле, для его расчёта используются данные электрофореза и электроосмоса.
Uэ.ф. –
электрофоретическая подвижностьU0 – скорость движения частиц при электрофорезе
η – вязкость ДС
ε0/ε – диэлектрическая постоянная ДС и ДФ
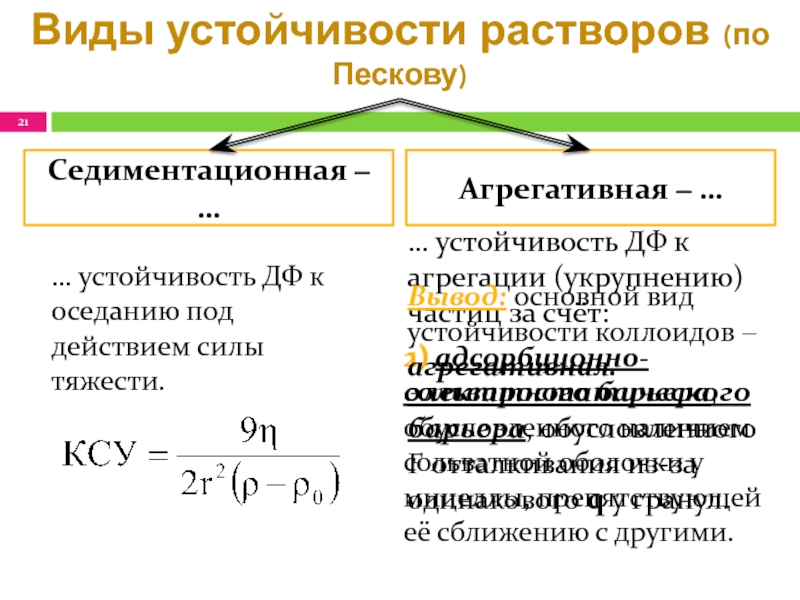
Слайд 21Виды устойчивости растворов (по Пескову)
… устойчивость ДФ к агрегации (укрупнению)
частиц за счёт:
1) электростатического барьера, обусловленного F отталкивания из-за
одинакового q у гранул.Седиментационная ‒ …
Агрегативная ‒ …
… устойчивость ДФ к оседанию под действием силы тяжести.
2) адсорбционно- сольватного барьера, обусловленного наличием сольватной оболочки у мицеллы, препятствующей её сближению с другими.
Вывод: основной вид устойчивости коллоидов ‒ агрегативная.
Слайд 22Коагуляция ‒ …
… процесс слипания частиц, образование крупных агрегатов с
потерей седиментационной и фазовой устойчивости и последующим разделением фаз.
… процесс
уменьшения степени дисперсности ДФ под действием тех или иных факторов.Стадии коагуляции
Вывод: для золей переход скрытой в явную происходит практически мгновенно!!!
явная
скрытая
Слайд 23Факторы, вызывающие коагуляцию
Увеличение концентрации золя приводит к уменьшению расстояния между
частицами, на котором начинают действовать силы притяжения.
Добавление неэлектролитов из-за способности
разрушения гидратной (сольватной) оболочки. Отсутствие оболочки позволяет частицам приблизиться на расстояние, на котором действуют силы притяжения.Слайд 24Факторы, вызывающие коагуляцию
Добавление электролитов наиболее сильное по 2-м причинам:
из-за адсорбции
ионов электролита на грануле и агрегате, снижении заряда гранулы и
ζ-потенциала;из-за уменьшения толщины диффузионного слоя, что приводит к уменьшению расстояния между частицами и возникновению сил притяжения.
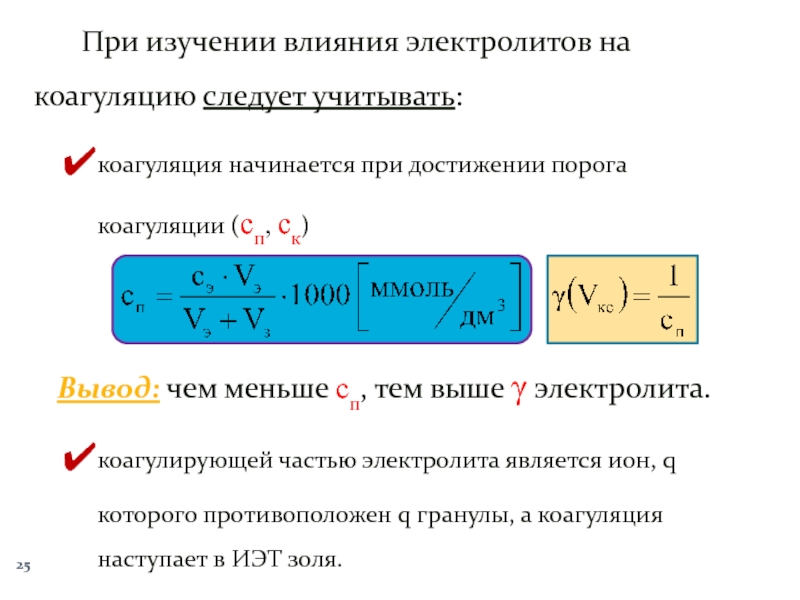
Слайд 25При изучении влияния электролитов на коагуляцию следует учитывать:
коагуляция начинается при
достижении порога коагуляции (сп, ск)
Вывод: чем меньше сп, тем выше
γ электролита.коагулирующей частью электролита является ион, q которого противоположен q гранулы, а коагуляция наступает в ИЭТ золя.
Слайд 26чем выше заряд коагулирующего иона, тем меньше сп и выше
γ электролита.
Правило Шульце ‒ Гарди …
… коагулирующее действие оказывает противоион
и его γ возрастает пропорционально некоторой высокой степени его заряда.… γ электролита возрастает с увеличением заряда коагулирующего иона, противоположного по знаку заряду гранулы
Слайд 27
Правило Дерягина ‒ Ландау …
… устанавливает связь между сп и
зарядом коагулирующего иона.
Теор.:
Эксп.:
Дерягин
Борис Владимирович
(1902‒1994)
Ландау Лев Давидович (1908 —
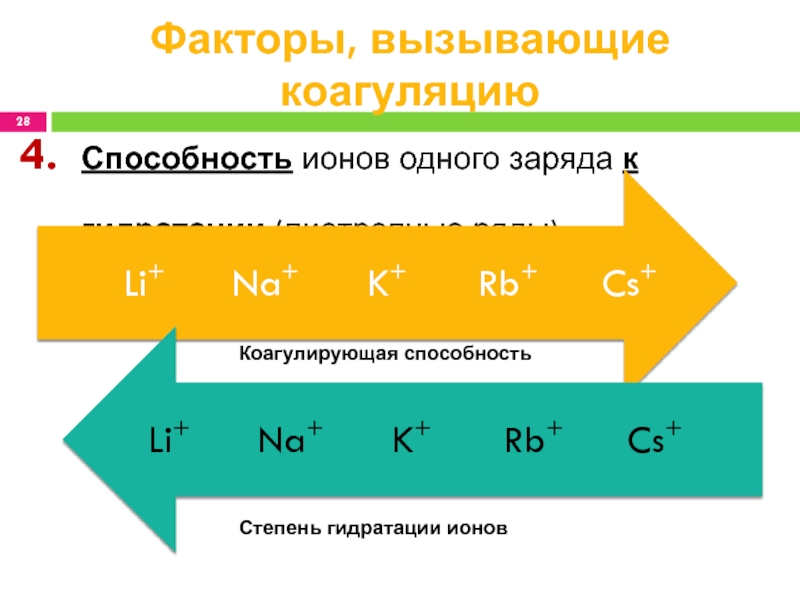
1968)Слайд 28Способность ионов одного заряда к гидратации (лиотропные ряды)
Факторы, вызывающие коагуляцию
Коагулирующая
способность
Степень гидратации ионов
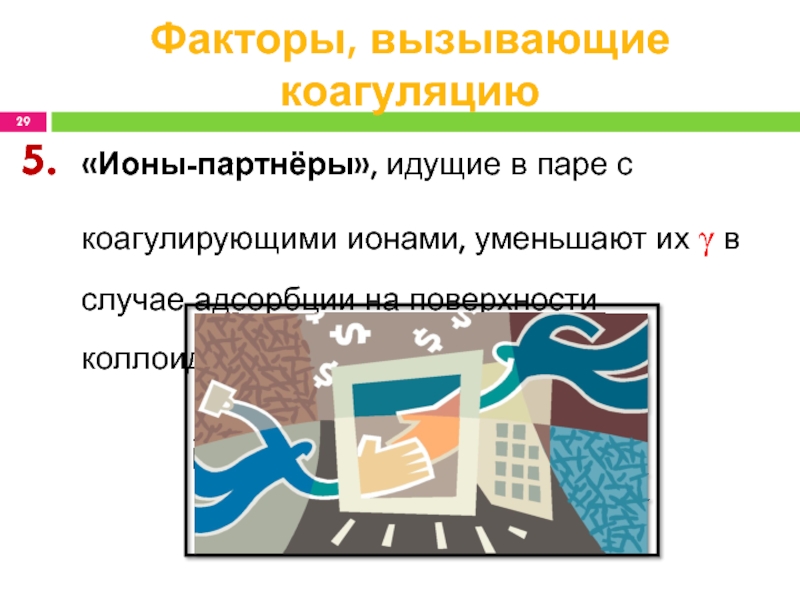
Слайд 29Факторы, вызывающие коагуляцию
«Ионы-партнёры», идущие в паре с коагулирующими ионами, уменьшают
их γ в случае адсорбции на поверхности коллоидной частицы.
Слайд 30Смесями электролитов;
Многозарядными ионами‒коагуляторами (чередование зон коагуляции);
При смешивании коллоидов с гранулами
разного по знаку заряда (взаимная коагуляция / гетерокоагуляция);
Добавлением очень малых
количеств ВМС (сенсибилизация).Особые случаи коагуляции
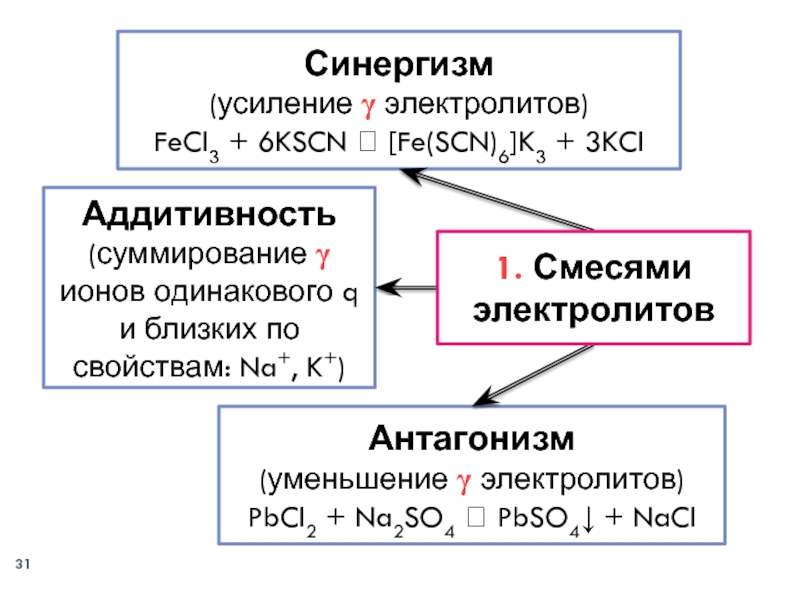
Слайд 31Аддитивность
(суммирование γ ионов одинакового q и близких по свойствам: Na+,
K+)
Антагонизм
(уменьшение γ электролитов)
PbCl2 + Na2SO4 ? PbSO4↓ + NaCl
Синергизм
(усиление γ
электролитов)FeCl3 + 6KSCN ? [Fe(SCN)6]K3 + 3KCl
1. Смесями электролитов
Слайд 32
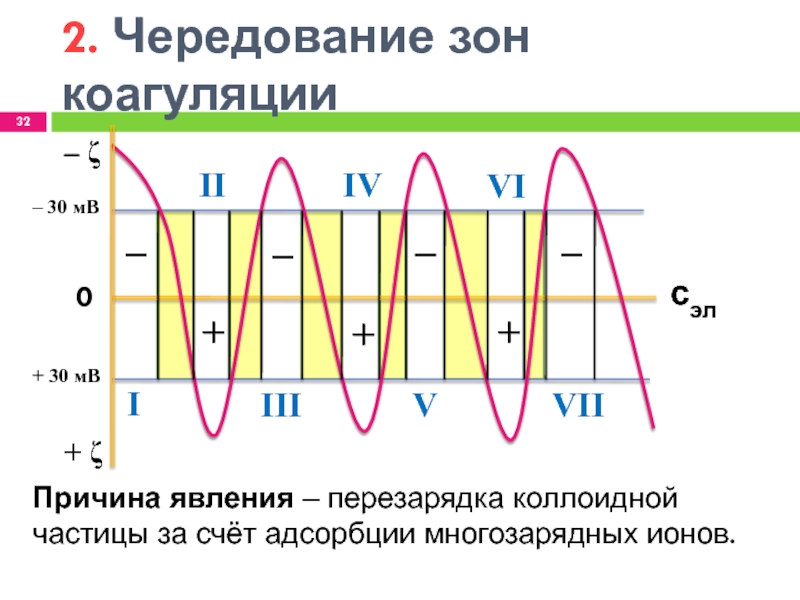
2. Чередование зон коагуляции
‒
+
+
+
‒
‒
‒
‒ ζ
+ ζ
0
‒ 30 мВ
+ 30 мВ
сэл
I
II
III
IV
V
VI
VII
Причина
явления ‒ перезарядка коллоидной частицы за счёт адсорбции многозарядных ионов.
Слайд 33
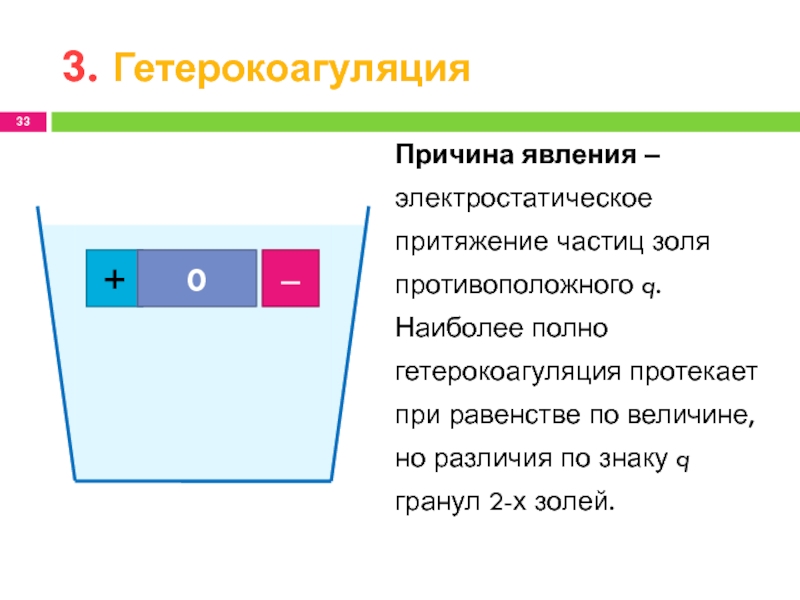
3. Гетерокоагуляция
+
‒
0
Причина явления ‒ электростатическое притяжение частиц золя противоположного q.
Наиболее полно гетерокоагуляция протекает при равенстве по величине, но различия
по знаку q гранул 2-х золей.Слайд 34… вызвана добавлением очень малых количеств ВМС и понижает устойчивость
коллоидов.
… связана с особенностями ВМС:
1. образование макроионов с большой адсорбционной
способностью;2. одновременная адсорбция макроионов на нескольких коллоидных частицах с образованием флокул (мостиковый механизм).
4. Сенсибилизация …
Слайд 35Вывод: адсорбционный слой является механическим препятствием для иона ‒ коагулянта.
…повышение
устойчивости коллоидов добавлением ВМС в концентрациях, достаточных для полного адсорбционного
насыщения поверхности мицелл защищаемого золя.Коллоидная защита …
+
‒
Слайд 36Защитное число …
… min масса ВМС (мг), достаточная для предотвращения
10 см3 гидрозоля от коагулирующего действия 1 см3 раствора NaCl
с ω=10% (массовая концентрация 100 г/л).
Слайд 37Процесс перехода свежевыпавшего при коагуляции осадка во взвешенное состояние (золь)
под влиянием пептизаторов ‒
б) адсорбция ионов пептизатора на поверхности
частиц осадка, появление у них одинакового q и за счёт электростатического отталкивания – переход в раствор.а) образование пептизатора за счёт хим. реакции;
пептизация
Адсорбционная
Диссолюционная
а) введение пептизатора;
Включают стадии:
↓Fe(OH)3 + FeCl3(пепт.) → {[Fe(OH)3]m·nFe3+·(3n‒x)Cl‒}x+ ·xCl‒
а) ↓Fe(OH)3 + HCl → FeOCl (пепт) + 2Н2О
б) ↓Fe(OH)3 + FeOCl (пепт) → {[Fe(OH)3]m·nFeО+·(n‒x)Cl‒}x+ ·xCl‒
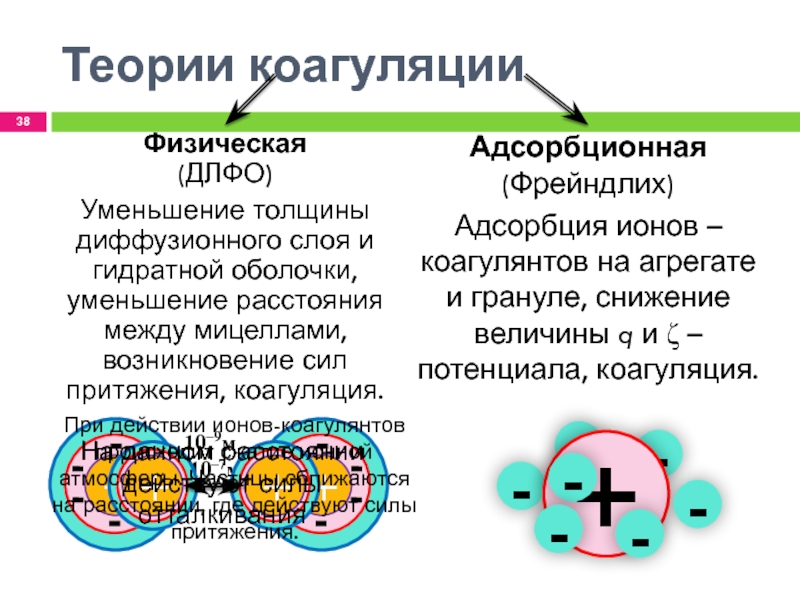
Слайд 38-
-
-
Теории коагуляции
Адсорбционная
(Фрейндлих)
Адсорбция ионов – коагулянтов на агрегате и грануле, снижение
величины q и ζ – потенциала, коагуляция.
+
-
-
-
-
Физическая
(ДЛФО)
Уменьшение толщины диффузионного слоя
и гидратной оболочки, уменьшение расстояния между мицеллами, возникновение сил притяжения, коагуляция.На данном расстоянии действуют силы отталкивания
При действии ионов-коагулянтов происходит сжатие ионной атмосферы. Частицы сближаются на расстоянии, где действуют силы притяжения.








![Классификация дисперсных систем Получение золя конденсационным методом по реакции обменаBaCl2 + H2SO4 ? BaSO4↓ + 2HClизбытокагрегатBa2+2Cl–ПОИпротивоионстабилизаторm[BaSO4]·nBa2+·(2n – x)Cl–{}x+·xCl– Получение золя конденсационным методом по реакции обменаBaCl2 + H2SO4 ? BaSO4↓ + 2HClизбытокагрегатBa2+2Cl–ПОИпротивоионстабилизаторm[BaSO4]·nBa2+·(2n – x)Cl–{}x+·xCl–](/img/thumbs/1b7e41c4c7c1c40abb4037e04593ae1f-800x.jpg)
![Классификация дисперсных систем Мицелла{m[BaSO4] • nBa2+ (2n – x)Cl–}x+ • xCl–агрегатадсорбционный слойядрогрануладиффузионный слойМИЦЕЛЛА Мицелла{m[BaSO4] • nBa2+ (2n – x)Cl–}x+ • xCl–агрегатадсорбционный слойядрогрануладиффузионный слойМИЦЕЛЛА](/img/thumbs/7295cf339726e577cf192decb5b28470-800x.jpg)
![Классификация дисперсных систем Возникновение ДЭС и потенциалов в мицелле{m[BaSO4] • nBa2+ (2n – x)Cl–}x+ Возникновение ДЭС и потенциалов в мицелле{m[BaSO4] • nBa2+ (2n – x)Cl–}x+ • xCl–На границе между ядром и](/img/thumbs/9e852fd1c603660bb165945edbd3ffb4-800x.jpg)