Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классификация и свойства оксидов
Содержание
- 1. Классификация и свойства оксидов
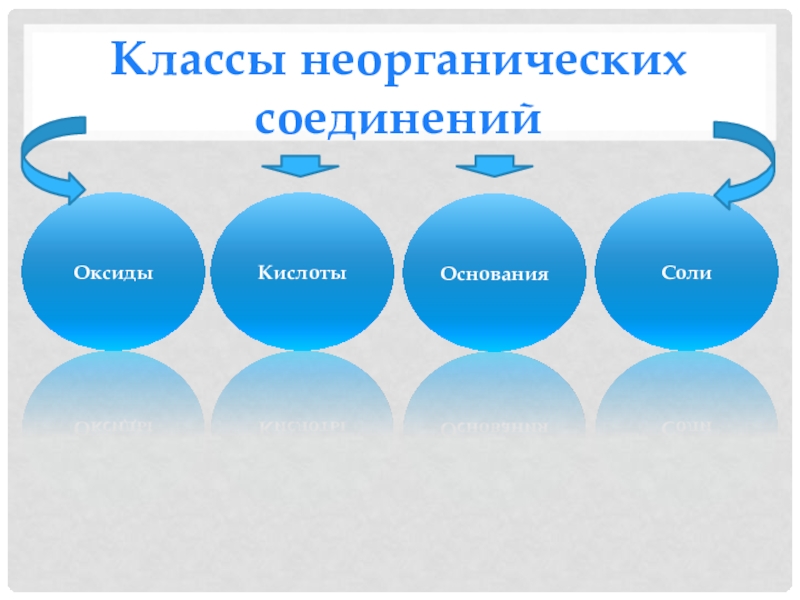
- 2. Классы неорганических соединенийОксидыКислотыОснованияСоли
- 3. оксидыБинарные соединения, состоящие из двух элементов, одним из которых является кислород
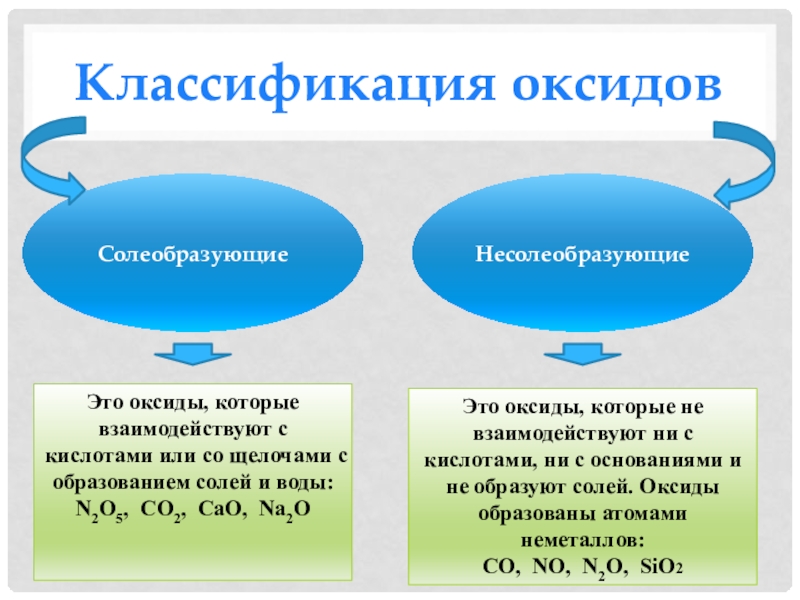
- 4. Классификация оксидовСолеобразующиеНесолеобразующиеЭто оксиды, которые не взаимодействуют ни
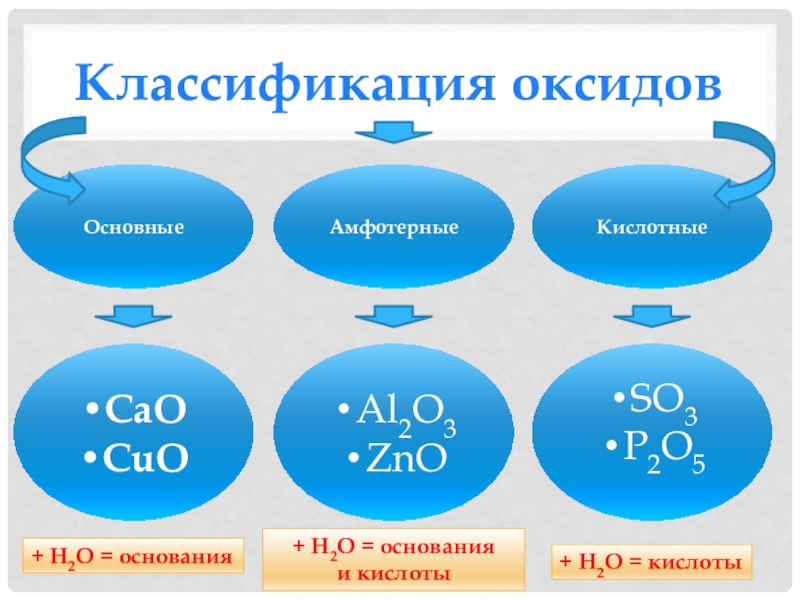
- 5. Классификация оксидовОсновные Амфотерные Кислотные CaOCuOAl2O3ZnOSO3P2O5 + Н2О
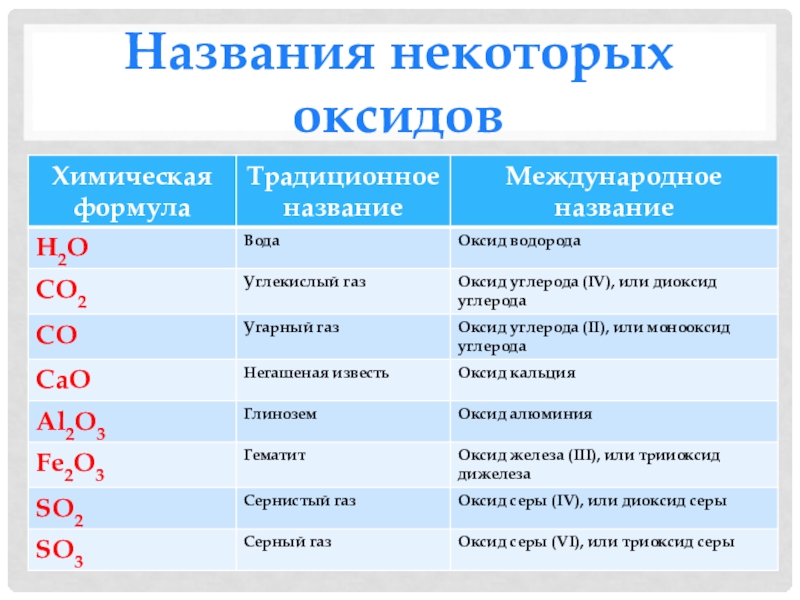
- 6. Названия некоторых оксидов
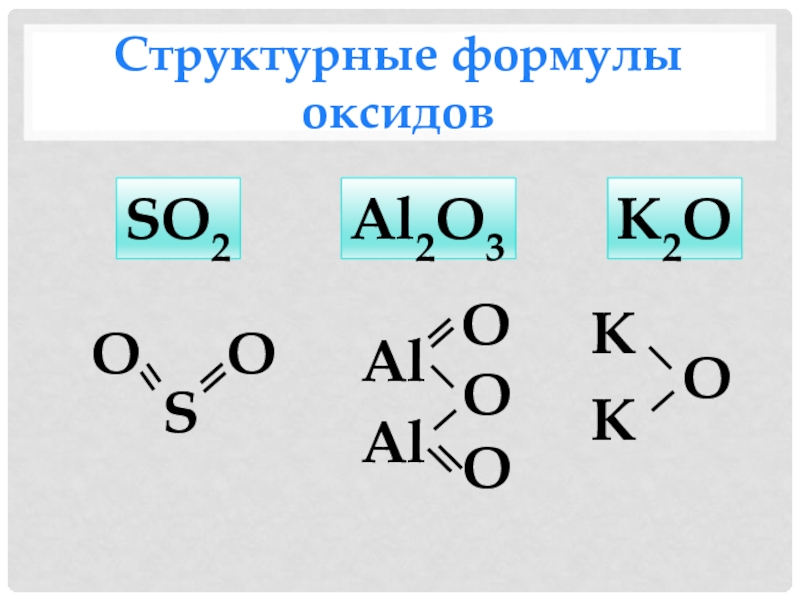
- 7. Структурные формулы оксидовSO2SООAl2O3AlAlОООК2OОКК
- 8. Получение оксидов 1. Взаимодействие простых веществ с
- 9. Получение оксидов 2. Горение сложных веществ:CH4 + O2 = CO2 + H2O22Метан
- 10. Получение оксидов 3. Окисление оксидов:FeO + O2 = Fe2O3CO + O2 = CO22422
- 11. Получение оксидов 4. Разложение нерастворимых оснований при нагревании:2Mg(OH)2 = MgO + H2OFe(OH)3 = Fe2O3 + H2O3
- 12. Получение оксидов 5. Разложение солей:CaCO3 = CaO + CO2CaSO4 = CaO + SO3
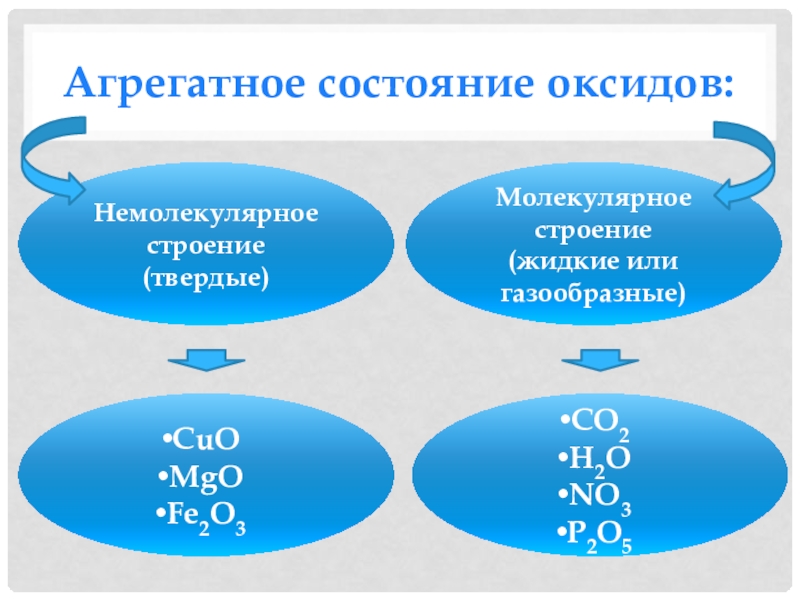
- 13. Агрегатное состояние оксидов:Немолекулярное строение(твердые)Молекулярное строение(жидкие или газообразные)CuOMgOFe2O3CO2H2ONO3P2O5
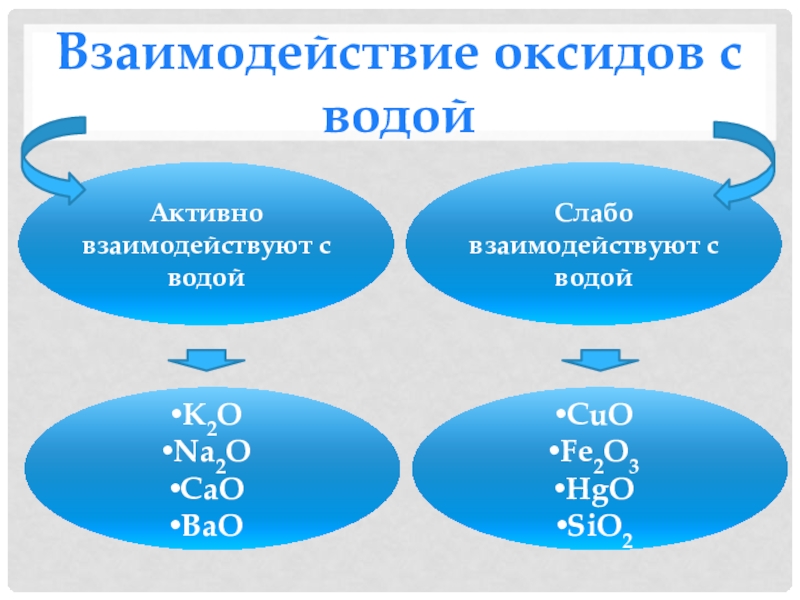
- 14. Взаимодействие оксидов с водойАктивно взаимодействуют с водойСлабо взаимодействуют с водойK2ONa2OCaOBaOCuOFe2O3HgOSiO2
- 15. Химические свойства основных оксидов1. Взаимодействие основных оксидов
- 16. Химические свойства основных оксидов2. Взаимодействие основных оксидов
- 17. Химические свойства основных оксидов3. Взаимодействие основных и
- 18. Химические свойства кислотных оксидов1. Взаимодействие с водой
- 19. Химические свойства кислотных оксидов2. Взаимодействие кислотных оксидов
- 20. Химические свойства кислотных оксидов3. Взаимодействие кислотных оксидов
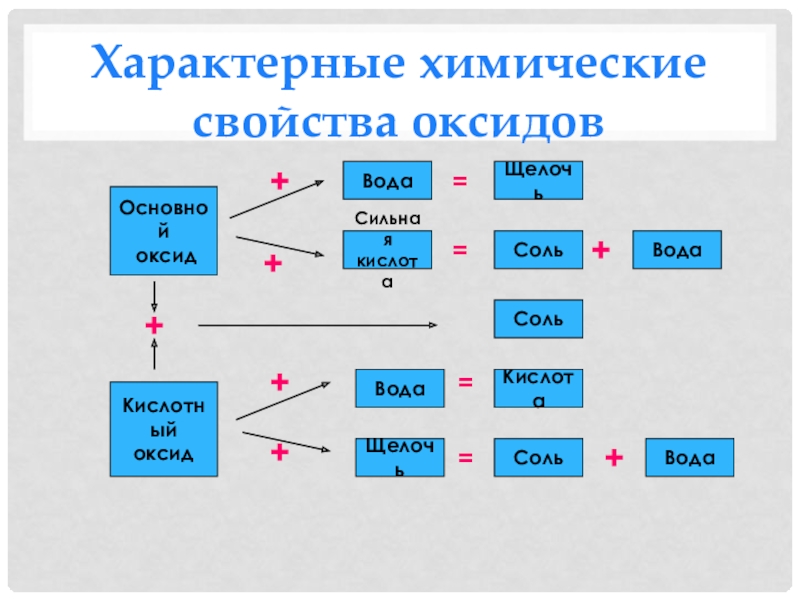
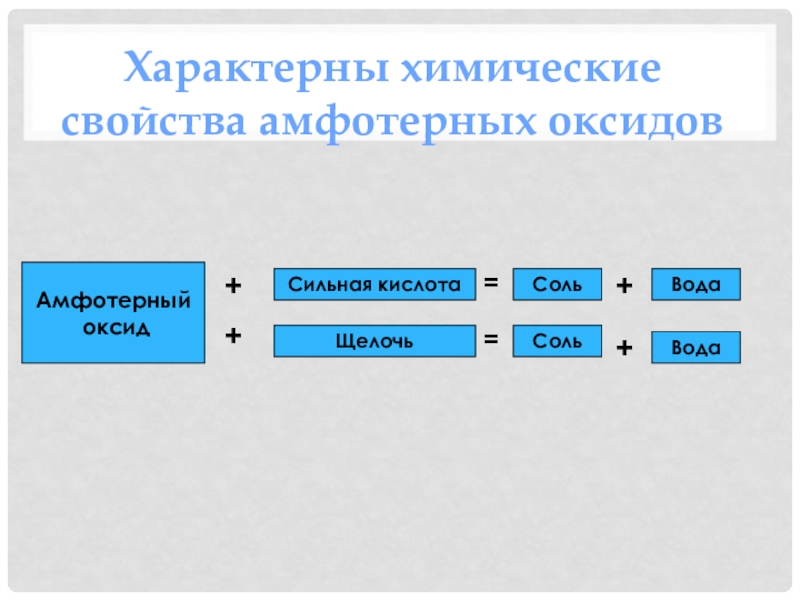
- 21. Характерные химические свойства оксидовОсновной оксидКислотныйоксидЩелочь Вода СильнаякислотаВода Вода Вода Соль Кислота Соль Соль Щелочь +++++++====
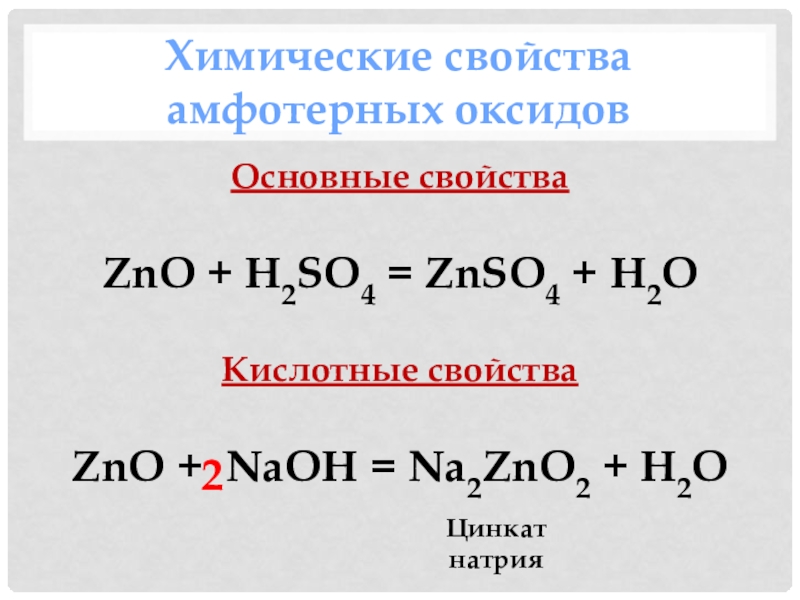
- 22. Химические свойства амфотерных оксидовОсновные свойстваZnO + H2SO4
- 23. Амфотерный оксидСильная кислотаЩелочь Соль Соль Вода Вода ++++==Характерны химические свойства амфотерных оксидов
- 24. Домашнее заданиеПар.41
- 25. Скачать презентанцию
Классы неорганических соединенийОксидыКислотыОснованияСоли
Слайды и текст этой презентации
Слайд 4Классификация оксидов
Солеобразующие
Несолеобразующие
Это оксиды, которые не взаимодействуют ни с кислотами, ни
с основаниями и не образуют солей. Оксиды образованы атомами неметаллов:
CO,
NO, N2O, SiO2Это оксиды, которые взаимодействуют с кислотами или со щелочами с образованием солей и воды: N2O5, CO2, CaO, Na2O
Слайд 5Классификация оксидов
Основные
Амфотерные
Кислотные
CaO
CuO
Al2O3
ZnO
SO3
P2O5
+ Н2О = основания
+ Н2О
= кислоты
+ Н2О = основания
и кислоты
Слайд 8Получение оксидов
1. Взаимодействие простых веществ с кислородом:
С + O2 =
CO2
Cu + O2 = CuO
Ca + O2 = CaO
2
2
2
2
Слайд 11Получение оксидов
4. Разложение нерастворимых оснований при нагревании:
2
Mg(OH)2 = MgO +
H2O
Fe(OH)3 = Fe2O3 + H2O
3
Слайд 13Агрегатное состояние оксидов:
Немолекулярное строение
(твердые)
Молекулярное строение
(жидкие или газообразные)
CuO
MgO
Fe2O3
CO2
H2O
NO3
P2O5
Слайд 14Взаимодействие оксидов с водой
Активно взаимодействуют с водой
Слабо взаимодействуют с водой
K2O
Na2O
CaO
BaO
CuO
Fe2O3
HgO
SiO2
Слайд 15Химические свойства основных оксидов
1. Взаимодействие основных оксидов с водой и
образованием щелочи:
Na2O + H2O = NaOH
2
CaO + H2O = Ca(OH)2
Слайд 16Химические свойства основных оксидов
2. Взаимодействие основных оксидов с сильными кислотами
с образованием соли и воды:
MgO + H2SO4 = MgSO4+ H2O
BaO
+ HCL = BaCL2 + H2O2
Слайд 17Химические свойства основных оксидов
3. Взаимодействие основных и кислотных оксидов между
собой с образованием соли:
CaO + CO2 = CaCO3
BaO + SiO2
= BaSiO3Слайд 18Химические свойства кислотных оксидов
1. Взаимодействие с водой с образование кислот:
SO3
+ H2O = H2SO4
P2O5 + H2O = H3PO4
2
3
Слайд 19Химические свойства кислотных оксидов
2. Взаимодействие кислотных оксидов со щелочами с
образованием соли и воды:
NaOH + SO2 = Na2SO3 + H2O
Ca(OH)2
+ CO2 = CaCO3 + H2O2