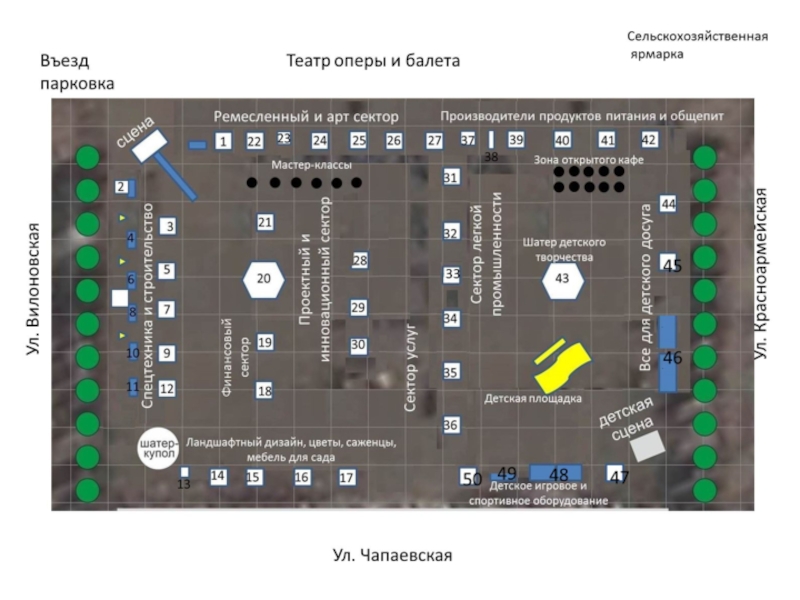
– кислород: H2O, CaO, SO3, Mn2O7.
Все оксиды делятся на солеобразующие
и несолеобразующие (безразличные).Солеобразующие, в свою очередь, делятся на основные, кислотные, амфотерные.
Основные – оксиды, которым соответствуют основания: Na2O, CaO.
Кислотные – оксиды, которым соответствуют кислоты: SO2, P4O10, CrO3, Mn2O7.
Амфотерные – оксиды, сочетающие в себе свойства основных и кислотных оксидов: BeO, ZnO, Cr2O3, Al2O3.
Несолеобразующие – некоторые оксиды неметаллов, не имеющие соответствующих им кислот и солей: N2O, NO, CO.