Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классификация химических реакций
Содержание
- 1. Классификация химических реакций
- 2. это процессы, в результате которых из одних
- 3. По числу и составу реагирующих и
- 4. I. По числу и составу реагирующих и
- 5. I. По числу и составу реагирующих и
- 6. I. По числу и составу реагирующих и
- 7. I. По числу и составу реагирующих и
- 8. I. По числу и составу реагирующих и
- 9. II. По изменению степеней окисления химических элементов:1.
- 10. III. По использованию катализатора:1. Некаталитические реакции –
- 11. III. По использованию катализатора:1. Каталитические реакции –
- 12. IV. По направлению:1. Необратимые реакции протекают в
- 13. V. По механизму:1. Радикальные реакции – идут
- 14. V. По механизму:2. Ионные реакции – идут
- 15. VI. По тепловому эффекту:1. Экзотермические реакции протекают
- 16. VI. По тепловому эффекту:2. Эндотермические реакции протекают
- 17. VII. По виду энергии, инициирующей реакцию:Фотохимические реакции
- 18. VIII. По фазовому составу:1. Гетерогенные реакции –
- 19. VIII. По фазовому составу:2. Гомогенные реакции –
- 20. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2это процессы, в результате которых из одних веществ образуются другие,
отличающиеся от них по составу и (или) строению.
Слайд 3 По числу и составу реагирующих и образующихся веществ
По
изменению степени окисления атомов элементов
По использованию катализатора
По направлению
По механизмуПо тепловому эффекту
По виду энергии, инициирующей реакцию
По фазовому составу
Классификация
химических реакций
Слайд 4I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие
без изменения состава веществ.
В неорганической химии к таким реакциям относят
процессы получения аллотропных модификаций одного химического элемента, например:Классификация
химических реакций
Sn (белое олово) Sn (серое олово)
Слайд 5I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие
с изменением состава вещества
1. Реакции соединения – реакции, при которых
из двух и более веществ образуется одно сложное вещество.Классификация
химических реакций
S + O2 = SO2
2SO2 + O2 = 2SO3
SO3 + H2O = H2SO4
Слайд 6I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие
с изменением состава вещества
2. Реакции разложения – это такие реакции,
при которых из одного сложного вещества образуется несколько новых веществ.Классификация
химических реакций
2HgO = 2Hg + O2
2KNO3 = 2KNO2 + O2
2KMnO4 = K2MnO4 + MnO2 + O2
Слайд 7I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие
с изменением состава вещества
3. Реакции замещения – это такие реакции,
в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе.Классификация
химических реакций
Zn + 2HCl = ZnCl2 + H2
2Na + 2H2O = 2NaOH + H2
Fe + CuSO4 = FeSO4 + Cu↓
Слайд 8I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие
с изменением состава вещества
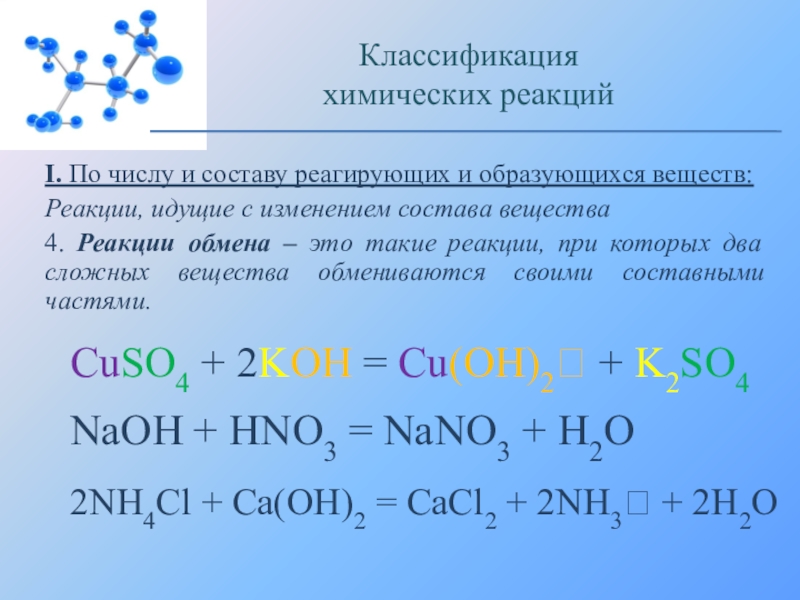
4. Реакции обмена – это такие реакции,
при которых два сложных вещества обмениваются своими составными частями.Классификация
химических реакций
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
NaOH + HNO3 = NaNO3 + H2O
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
Слайд 9II. По изменению степеней окисления химических элементов:
1. Окислительно-восстановительные реакции –
реакции, идущие с изменением степеней окисления элементов (все реакции замещения,
а также реакции соединения и разложения, в которых участвует хотя бы одно простое вещество).Классификация
химических реакций
CuSO4 + Fe = FeSO4 + Cu↓
Zn + 2HCl = ZnCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Слайд 10III. По использованию катализатора:
1. Некаталитические реакции – реакции, идущие без
участия катализатора:
Классификация
химических реакций
2HgO = 2Hg + O2↑
t
Слайд 11III. По использованию катализатора:
1. Каталитические реакции – реакции, идущие с
участием катализатора:
Классификация
химических реакций
2H2O2 = 2H2O + O2↑
MnO2
Слайд 12IV. По направлению:
1. Необратимые реакции протекают в данных условиях только
в одном направлении:
Классификация
химических реакций
Ba(ClO2)2 + H2SO4 = 2HClO2 + BaSO4↓
2. Обратимые реакции в
данных условиях протекают одновременно в двух направлениях:3H2 + N2 2NH3
N2O4 2NO2
Слайд 13V. По механизму:
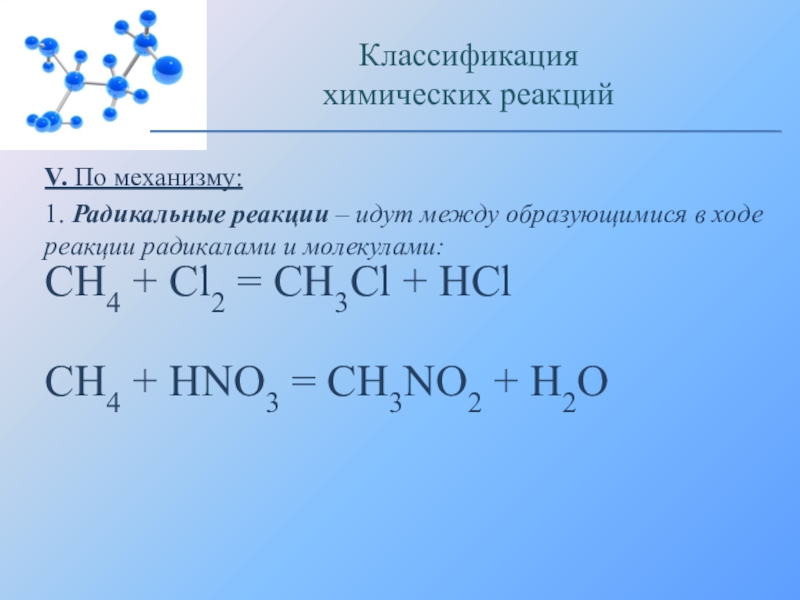
1. Радикальные реакции – идут между образующимися в
ходе реакции радикалами и молекулами:
Классификация
химических реакций
CH4 + Cl2 = CH3Cl +
HClCH4 + HNO3 = CH3NO2 + H2O
Слайд 14V. По механизму:
2. Ионные реакции – идут между уже имеющимися
или образующимися в ходе реакции ионами:
Классификация
химических реакций
C2H4 + HBr = C2H5Br
Слайд 15VI. По тепловому эффекту:
1. Экзотермические реакции протекают с выделением энергии:
Классификация
химических
реакций
4P + 5O2 = 2P2O5 + Q кДж
Слайд 16VI. По тепловому эффекту:
2. Эндотермические реакции протекают с поглощением энергии:
Классификация
химических
реакций
N2 + O2 = 2NO – Q кДж
2HgO = 2Hg↓
+ O2↑ - Q кДжСлайд 17VII. По виду энергии, инициирующей реакцию:
Фотохимические реакции инициируются световой энергией.
Радиационные
реакции инициируются излучениями большой энергии – рентгеновскими лучами, ядерными излучениями.
Электрохимические
реакции инициируются электрическим током (электролиз).Термохимические реакции инициируются тепловой энергией (все эндотермические реакции и множество экзотермических).
Классификация
химических реакций
Слайд 18VIII. По фазовому составу:
1. Гетерогенные реакции – реакции, в которых
реагирующие вещества и продукты находятся в разных агрегатных состояниях:
Классификация
химических реакций
CuO↓
+ H2↑ = Cu↓ + H2OСлайд 19VIII. По фазовому составу:
2. Гомогенные реакции – реакции, в которых
реагирующие вещества и продукты находятся в одном агрегатном состоянии (в
одной фазе):Классификация
химических реакций
2 СО↑ + О₂↑ = 2 СО₂↑