Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
КЛИНИЧЕСКАЯ ОЦЕНКА РЕЗУЛЬТАТОВ НЕКОТОРЫХ ИММУНОЛОГИЧЕСКИХ МЕТОДОВ ИССЛЕДОВАНИЯ
Содержание
- 1. КЛИНИЧЕСКАЯ ОЦЕНКА РЕЗУЛЬТАТОВ НЕКОТОРЫХ ИММУНОЛОГИЧЕСКИХ МЕТОДОВ ИССЛЕДОВАНИЯ
- 2. Иммунологические методы лабораторной диагностики можно условно разделить
- 3. Методы клинической иммунологии позволяют выявлять следующие нарушения:-
- 4. К первому уровню относится группа относительно простых,
- 5. Второй уровень, доступный только специально оснащенным лабораториям,
- 6. Существует также подразделение тестов на ориентировочные и
- 7. В наиболее общей форме показания к проведению
- 8. Условно перечисленные показания можно сгруппировать с учетом
- 9. Исследование клеточного иммунитета.Определение количества Т-лимфоцитов основано на
- 10. Помимо этих субпопуляций различают: Теофиллинчувствительные - это
- 11. В норме содержание в крови: Т-лимфоцитов -(53,6±1,7)%
- 12. Исследование гуморального иммунитета.Наиболее распространенным методом является определение
- 13. Исследование неспецифической резистентности организма.Одним из ведущих факторов
- 14. Оценка результатов иммунологических исследований Никогда не следует
- 15. Любое инфекционное заболевание бактериальной этиологии, сопровождается существенным
- 16. При вирусных инфекциях определяется умеренное снижение иммунной
- 17. Повышение показателей иммунитета происходит при различных аллергиях,
- 18. Избыточное увеличение содержания иммуноглобулинов, чаще всего классов
- 19. Вторичные иммунодефициты возникают под влиянием целого ряда
- 20. Проведение исследования иммунного статуса, по ориентировочному перечню,
- 21. Слайд 21
- 22. Опухолевые маркеры представляют собой макромолекулы, в основном
- 23. Термин “опухолевые маркеры” охватывает спектр молекул с
- 24. Опухолевые маркеры, как правило, не являются диагностическими,
- 25. Определение концентрации, а также изменений концентрации опухолевых
- 26. Человеческие антитела к мышиным иммуноглобулинам образуются у
- 27. Из-за низкой диагностической чувствительности и специфичности, а
- 28. Основным применением опухолевых маркеров является мониторинг течения
- 29. В ряде случае (до 50%) корректно определенный
- 30. Таким образом, суммируя вышесказанное, можно констатировать, что
- 31. 1. Раковый эмбриональный антиген (РЭА) представляет собой
- 32. 2. Углеводный антиген 19-9 (СА 19-9), гликолипид,
- 33. 3. Раковый антиген 72-4 (СА 72-4). Тест
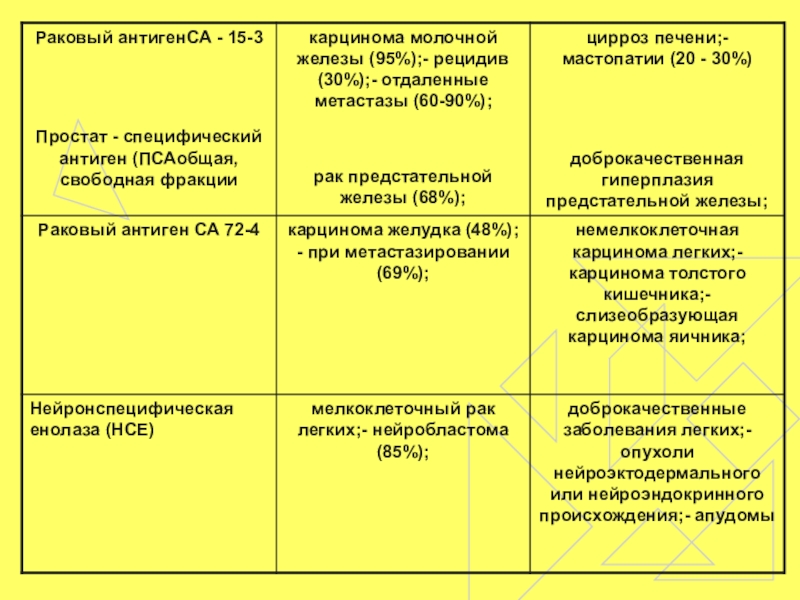
- 34. 4. Раковый антиген 15-3 (СА 15-3) является
- 35. 5. Раковый антиген 125 (СА 125) является
- 36. 6. Нейрон-специфическая енолаза (НСЕ) была обнаружена в
- 37. 7. Альфа-фетопротеин (АФП) также представляет собой гликопротеин
- 38. 8. Хорионический гонадотропин (ХГЧ) представляет собой гликопротеиновый
- 39. 9. Простата-специфический антиген (PSA) является гликопротеином (молекулярный
- 40. Тестирование PSA имеет два основных применения в
- 41. ДИАГНОСТИЧЕСКАЯ ЗНАЧИСОМТЬ ОПУХОЛЕВЫХ МАРКЕРОВ ПРИ РАЗЛИЧНЫХ ЗАБОЛЕВАНИЯХ
- 42. Слайд 42
- 43. Слайд 43
- 44. Прикладное значение морфологического исследованияТрошина Н.В.
- 45. В онкологии биопсия является наиболее достоверным методом
- 46. Однако до сих пор не изжиты недостатки
- 47. В настоящее время существуют следующие виды биопсий:а)
- 48. д) щипцовая- получение материала с помощью щипцов
- 49. Биопсии бывают срочными или плановыми. Срочные изготавливаются
- 50. Биопсии проводят также при клинически установленном диагнозе
- 51. 4.-для выявления индивидуальной чувствительности злокачественной опухоли к
- 52. Ещё раз о фиксации.Фиксация обеспечивает стабилизацию тканевых
- 53. Формалин - наиболее распространенная и универсальная фиксирующая
- 54. Этанол - для фиксации тканей применяют как
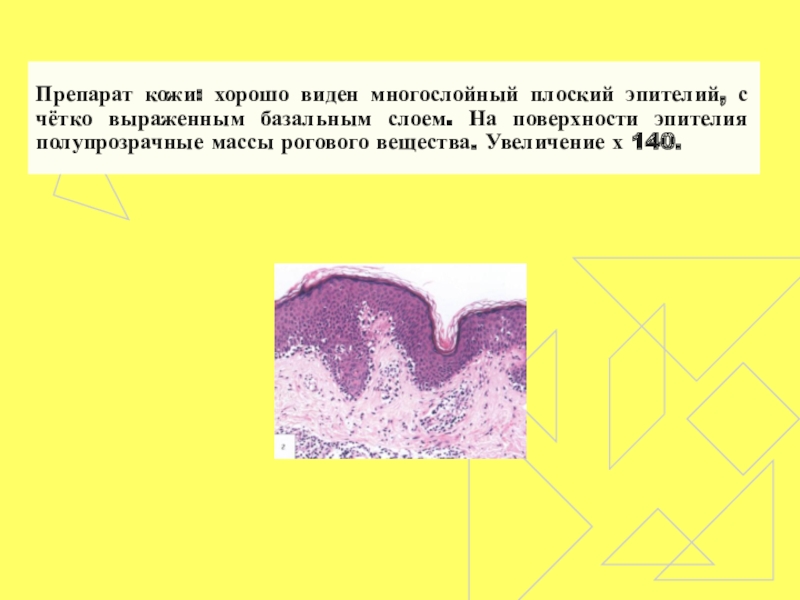
- 55. Препарат кожи: хорошо виден многослойный плоский эпителий,
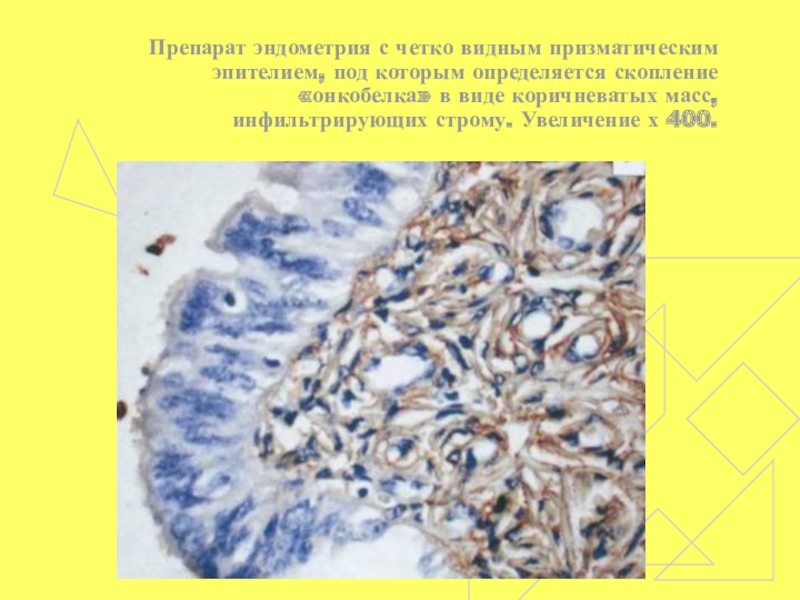
- 56. Препарат эндометрия с четко видным призматическим эпителием,
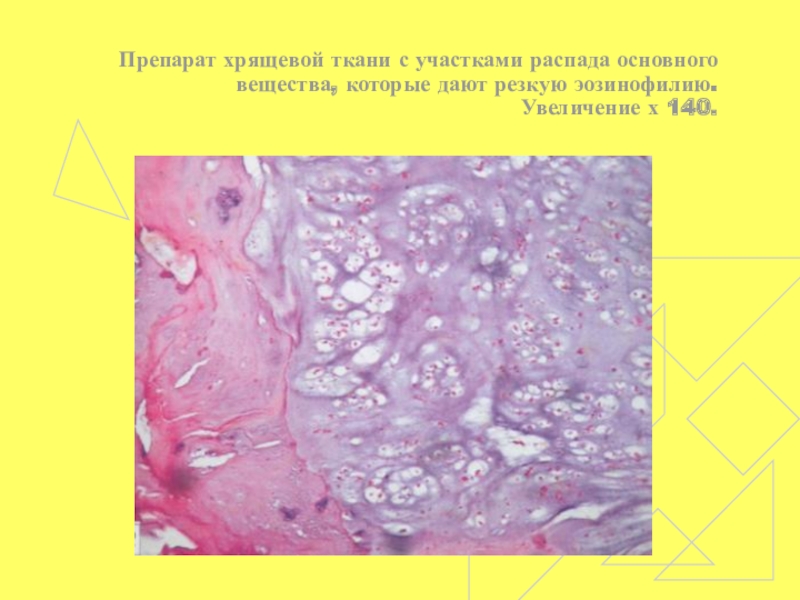
- 57. Препарат хрящевой ткани с участками распада основного вещества, которые дают резкую эозинофилию. Увеличение х 140.
- 58. Препарат почки, в поле зрения клубочек, светящийся зеленоватым цветом на темном поле. Увеличение х 200.
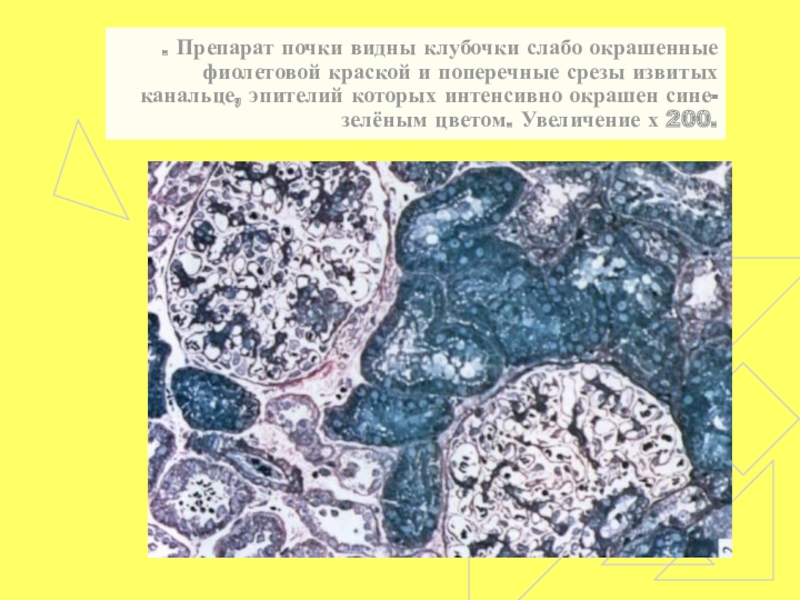
- 59. . Препарат почки видны клубочки слабо окрашенные
- 60. Ядра опухолевых клеток в поле зрения, светятся
- 61. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1КЛИНИЧЕСКАЯ ОЦЕНКА РЕЗУЛЬТАТОВ НЕКОТОРЫХ ИММУНОЛОГИЧЕСКИХ МЕТОДОВ ИССЛЕДОВАНИЯ.
Лекция для ФУВ.
Автор: Трошина
Н.В.
Слайд 2Иммунологические методы лабораторной диагностики можно условно разделить на следующие 2
группы:
*методы с использованием принципа взаимодействия «антиген-антитело» (исследование С-реактивного белка, ревматоидного
фактора, определение групп крови);*методы, применяемые для непосредственной оценки иммунных реакций организма и неспецифической резистентности.
Слайд 3Методы клинической иммунологии позволяют выявлять следующие нарушения:
- дефектность того или
иного звена иммунной системы (врожденные и приобретенные иммунодефициты);
- аутоагрессия против нормальных
компонентов организма (аутоиммунные заболевания) и избыточное скопление иммунных комплексов (болезни иммунных комплексов);- дисфункции, при которых в том или ином звене иммунитета развиваются признаки гипертрофии в ущерб функционированию других звеньев (гипергаммаглобулинемия, болезнь тяжелых цепей, миелома и др.).
Слайд 4К первому уровню относится группа относительно простых, доступных любому лечебному
учреждению методов.
1. Определение абсолютного и относительного количества лимфоцитов.
2.Тест розеткообразования (определение
Т-, В- и О-лимфоцитов, а также розеткообразование нейтрофилов).3. Определение чувствительности Т-лимфоцитов к теофиллину.
4. Определение иммуноглобулинов классов А, М, G.
5. Реакция торможения миграции лейкоцитов (РТМЛ) с различными митогенами и аллергенами.
6. Определение циркулирующих иммунных комплексов (ЦИК).
7. Определение титра комплемента гемолитическим методом.
8. Изучение фагоцитирующей способности нейтрофилов.
Слайд 5Второй уровень, доступный только специально оснащенным лабораториям, включает следующие исследования.
1.
Определение субпопуляций лимфоцитов с использованием моноклональных антител.
2. Реакция бласттрансформации лимфоцитов
(РБТЛ).3. Определение поверхностных иммуноглобулинов, а также иммуноглобулина Е.
4. Определение компонентов комплемента.
5. Изучение стадий фагоцитоза.
Слайд 6Существует также подразделение тестов на ориентировочные и аналитические.
К ориентировочным
относят те, результаты которых можно получить буквально в течение 1-2
сут.По ним можно судить об общей направленности сдвигов в иммунном статусе (абсолютное количество лимфоцитов, розеткообразование, иммуноглобулины А, М, G и фагоцитоз).
К аналитическим тестам относят реакции, позволяющие определить механизмы функциональных нарушений определенных звеньев иммунитета (теофиллин-чувствительность и теофиллин-резистентность, РТМЛ, РБТЛ и др.).
Назначают их обычно после первичного исследования иммунитета, а результаты определяются чаще всего на 3-7-е сутки.
Слайд 7В наиболее общей форме показания к проведению исследования иммунного статуса
можно представить следующим образом.
1. Подозрение на наличие генетически детерминированных дефектов
иммунной системы (первичные иммунодефициты).2. Аутоиммунные заболевания.
3. Аллергические заболевания.
4. Инфекционные заболевания с затяжным и хроническим течением.
5.Подозрение на наличие синдрома приобретенного иммунодефицита.
6. Злокачественные новообразования.
7. Проведение цитостатической, иммунодепрессивной и иммуномодулирующей терапии.
8. Подготовка к серьезным хирургическим вмешательствам и послеоперационный период.
9. Обследование реципиентов до и после аллотрансплантации.
Слайд 8Условно перечисленные показания можно сгруппировать с учетом диагностической значимости иммунологических
исследований:
** состояния, при которых данные методы имеют решающее диагностическое значение (первичные
иммунодефициты, дисгаммаглобулинемии, болезнь тяжелых цепей, СПИД, трансплантации и гемотрансфузия);** болезни, при которых оценка иммунного статуса и проведение специальных иммунологических проб позволяют провести дифференциальную диагностику внутри группы заболеваний (аутоиммунные заболевания, лейкозы, лимфомы, миеломатозы);
** заболевания при которых иммунологические исследования помогают оценить степень их тяжести, прогнозировать осложнения и исходы (инфекционные болезни с затяжным или хроническим течением, оценка степени риска при оперативных вмешательствах), осуществлять текущий контроль за лечением (антибиотикотерапия, применение цитостатиков и иммунодепрессантов, лучевая терапия.)
Слайд 9Исследование клеточного иммунитета.
Определение количества Т-лимфоцитов основано на их свойстве образовывать
комплекс (так называемую розетку) с эритроцитами (Е) барана, (Е-РОК).
Методика
выделения Е-РОК предусматривает проведение инкубации. Если же лимфоциты без инкубации активно соединяются с эритроцитами барана, то их характеризуют как Т-«активные» клетки (Еа=РОК). Слайд 10Помимо этих субпопуляций различают:
Теофиллинчувствительные - это лимфоциты, не взаимодействующие
с эритроцитами барана в присутствии теофиллина.
Теофиллинрезистентные лимфоциты - это
явление связано с наличием на поверхности Т-супрессоров рецепторов, блокируемых теофиллином, поэтому комплексы с эритроцитами не образуются. Т-хелперы аналогичных рецепторов не имеют и обозначаются как теофиллинрезистентные лимфоциты. Для популяции В-лимфоцитов (ЕАС-РОК) характерно образование комплексов с эритроцитами мыши.
Слайд 11В норме содержание в крови:
Т-лимфоцитов -(53,6±1,7)% (40-67%),
«активных» Т
-лимфоцитов - 22-39% (30,8±1,1%),
В-лимфоцитов - 16-36% (25,0±1,2%), а
соотношение Т-
супрессоров к Т-хелперам в норме 1:3.Слайд 12Исследование гуморального иммунитета.
Наиболее распространенным методом является определение количества иммуноглобулинов 3
основных классов (А, М, G) методом радиальной иммунодиффузии в геле.
В норме содержание иммуноглобулинов
класса А - (1,9*0,008) г/л (1,26-2,5);
класса М - (1,15*0,06) г/л (0,65— -1,65);
класса G - (11,5*0,5) г/л (7,50-15,46).
Иммуноглобулин класса D обычно не определяют из-за неясности до конца его биологической роли.
Для определения иммуноглобулина Е (крайне важный тест при диагностике аллергии) требуется комплекс оборудования и реактивов радиоиммунного или иммуноферментного анализа.
Слайд 13Исследование неспецифической резистентности организма.
Одним из ведущих факторов является способность к
фагоцитозу нейтрофилов и макрофагов.
Это свойство фагоцитов оценивают іn vіtro
по их активности связывания и поглощения стафилококка. Определяют следующие параметры:
1/ фагоцитарный показатель (процент фагоцитов из числа сосчитанных нейтрофилов - у здоровых лиц равный 40-80%),
2/ фагоцитарное число (среднее число микробов, поглощенных одним нейтрофилом,- в норме у взрослых - 4-9) и
3/ показатель завершенности фагоцитоза (отношение количества переваренных микробов к общему числу поглощенных).
Слайд 14Оценка результатов иммунологических исследований
Никогда не следует рассматривать отдельно какие-либо
параметры иммунитета.
Необходимо комплексное изучение клеточного и гуморального звеньев иммунитета,
а также факторов неспецифической защиты. Слайд 15Любое инфекционное заболевание бактериальной этиологии, сопровождается существенным ростом практически всех
показателей иммунной и неспецифической защиты (особенно количества Т-клеток, их функциональной
активности, увеличение содержания иммуноглобулинов, причем чаще всего класса G, усиление фагоцитирующей способности нейтрофилов).Рост показателей начинается в конце периода разгара и достигает, как правило, максимума в период поздней реконвалесценции. При помощи РТМЛ можно выявить сенсибилизацию к какому-либо бактериальному антигену и тем самым способствовать установлению этиологии инфекционного процесса, например пневмонии.
Слайд 16При вирусных инфекциях определяется умеренное снижение иммунной защиты, постепенно восстанавливающейся
в процессе выздоровления.
Естественно, что данная закономерность характерна лишь для
пациентов с нормальной реакцией на возбудитель, болезнь у которых протекает в обычном варианте с благоприятным, как правило, исходом.Слайд 17Повышение показателей иммунитета происходит при различных аллергиях, причем рост количественных
параметров клеточного иммунитета может сопровождаться снижением функциональной активности или нарушением
состава субпопуляций, что по сути скорее является иммунодефицитным состоянием.Увеличение количества ЦИК в крови не является положительным прогностическим показателем и встречается чаще всего при аутоиммунных заболеваниях.
Слайд 18Избыточное увеличение содержания иммуноглобулинов, чаще всего классов М и G,
встречается при парапротеинемиях (в частности, при миеломной болезни).
Увеличение содержания
какого-либо одного или нескольких иммуноглобулинов, а также изменения разнонаправленного характера наблюдаются при острых и хронических гепатитах, циррозах печени, диффузных заболеваниях соединительной ткани, инфаркте миокарда Слайд 19Вторичные иммунодефициты возникают под влиянием целого ряда факторов. К ним
относятся хронические инфекции или инвазии (малярия, токсоплазмоз, лейшманиоз, туберкулез, сифилис,
лепра, менингококковая и пневмококковая инфекции, вирусный гепатит В и т.д.). Отдельно рассматривается такой вторичный иммунодефицит, как ВИЧ-инфекция (СПИД).Нарушения иммунной системы могут быть вызваны пищевой недостаточностью белка или усиленной его потерей при заболеваниях кишечника и почек, усилением катаболизма белка при раке и миотонических дистрофиях.
Иммунодефицитные состояния возникают также при радиационных поражениях, гиповитаминозах, терапии цитостатиками, антибиотиками, кортикостероидами, иммунодепрессантами
Слайд 20Проведение исследования иммунного статуса, по ориентировочному перечню, необходимо при назначении
иммуномодулирующей терапии, так как в настоящее время уже известно, что
необоснованное применение иммуномодуляторов может привести к обратному эффекту.Показанием для данного вида лечения (чаще всего используются тималин или тактивин) является снижение абсолютного и относительного содержания Т-клеток, особенно числа «активных» Т-лимфоцитов, или снижение их функциональной активности (РТМЛ).
Показанием для проведения иммунокоррекции может явиться также значительный дисбаланс (разнонаправленные изменения) между различными параметрами иммунитета, что часто наблюдается при аллергических и аутоиммунных заболеваниях.
Слайд 22Опухолевые маркеры представляют собой макромолекулы, в основном белки с углеводным
или липидным компонентом, наличие и концентрация которых в периферической крови
и/или другой биологической жидкости коррелируют в определенной степени с наличием и ростом злокачественной опухоли в каждом конкретном случае.Они формируются внутри или на поверхности опухолевых клеток, или же происходит индукция их образования в других клетках.
Слайд 23Термин “опухолевые маркеры” охватывает спектр молекул с совершенно разными характеристиками.
Общим для них является связь с малигнизацией,
которая обусловливает их
использование в клинической детекции (диагноз, скрининг) и
наблюдении (мониторинг, прогноз) пациентов с раком.
Слайд 24Опухолевые маркеры, как правило, не являются диагностическими, хотя они и
могут давать информацию, которая при определенных условиях оказывается полезной для
диагностики, особенно у тех пациентов, которые обращаются за помощью к соответствующим специалистам.Ни один опухолевый маркер не является специфичным для того или иного злокачественного новообразования и что “нормальное” значение маркера не исключает полностью наличие опухоли или рецидив.
Слайд 25Определение концентрации, а также изменений концентрации опухолевых маркеров требует знания
in vivo и in vitro факторов, влияющих на получаемые результаты
и искажающих их. Это имеет отношение не только к врачам - лаборантам, но и к врачам, непосредственно отвечающим за лечение и наблюдение больного.Концентрация опухолевых маркеров зависит не только от степени его экспрессии, синтеза, высвобождения, экскреции, массы и распространенности опухоли, положения пациента во время забора образца крови, катаболизма опухолевого маркера.
Так, факторами, влияющими на результаты анализа in vitro, являются:
условия хранения,
время между забором крови и цетрифугированием ,
гемолиз и желтуха,
контакт емкостей для забора образцов с кожей,
загрязнение образца слюной,
влияние лекарственных препаратов.
Слайд 26Человеческие антитела к мышиным иммуноглобулинам образуются у пациентов, получавших мышиные
иммуноглобулины при диагностической иммуносцинтиграфии или иммунотерапии,
конкретный метод тестирования, т.к. принципиально
схожие наборы различных производителей могут давать совершенно разные результаты для одной и той же сыворотки, что в некоторых случаях может симулировать ремиссию или прогрессию, что, в свою очередь, может привести к неправильным терапевтическим заключениям.Слайд 27Из-за низкой диагностической чувствительности и специфичности, а также из-за ограниченности
прогностических показателей, большинство циркулирующих опухолевых маркеров непригодны для скринингового обследования
бессимптомных пациентов.Иная ситуация складывается в группах высокого риска и группах пациентов с определенной симптоматикой, т.е. в группах с более высокой ожидаемой частотой данного заболевания (например, АФП при циррозах печени, АФП и ХГЧ при герминомах, PSA у мужчин старше 50 лет с аденомой простаты).
Слайд 28Основным применением опухолевых маркеров является мониторинг течения заболевания и эффективность
хирургического лечения и/или радио-, химио- и гормонотерапии.
Именно динамика уровня
опухолевого маркера представляется критичной в данном случае, нежели единичное значение уровня, взятое само по себе. Определение динамики опухолевого маркера иногда позволяет к тому же проводить дифференциацию между доброкачественными и злокачественными заболеваниями по характеру повышения уровня маркера, которое при доброкачественных заболеваниях имеет тенденцию быть преходящим или оставаться в нижних пределах диапазона патологических значений.
Слайд 29В ряде случае (до 50%) корректно определенный профиль концентраций опухолевых
маркеров позволяет выявлять изменения в развитие опухолевого процесса на 1
- 6 месяцев раньше, чем прочие, в некоторых случаях инвазивные, диагностические методы.Следующее за хирургическим удалением опухоли тестирование уровней опухолевого маркера, таким образом, представляет собой важный неинвазивный метод мониторинга течения заболевания. Так, в зависимости от скорости, вторичный подъем уровня опухолевого маркера, последовавший за постоперативной нормализацией с большой вероятностью предполагает либо местный рецидив, либо отдаленные метастазы.
Слайд 30Таким образом, суммируя вышесказанное, можно констатировать, что тестирование опухолевых маркеров,
при условии корректной интерпретации результатов, показано в следующих случаях:
Проверка эффективности
терапии.Мониторинг течения заболевания.
Идентификация резидуальных опухолей.
Неадекватное слабое снижение уровня опухолевого маркера или отсутствие такового вообще говорит либо о неполном удалении опухоли, либо о наличии множественных опухолей.
Слайд 311. Раковый эмбриональный антиген (РЭА)
представляет собой гликопротеин с молекулярным
весом 180000 дальтон. Исследованиями с моноклональными антителами в молекуле РЭА
идентифицировано 6 различных антигенных детерминант.Также как альфа-фетопротеин, РЭА является опухолевоэмбриональным антигеном, продуцируемым в период жизни эмбриона и плода.
Слайд 322. Углеводный антиген 19-9 (СА 19-9), гликолипид, соответствует гаптену детерминанты
группы крови Льюис (а). Пациенты с редкой групповой принадлежностью Le
(a-b-) (3-7% населения), таким образом, неспособны экспрессировать СА 19-9. Это должно учитываться при интерпретации результатов. Компонент сыворотки, соответствующий СА 19-9, представляет собой муцин с молекулярным весом около 10000 дальтон.СА 19-9 является маркером выбора при карциноме поджелудочной железы.
Слайд 333. Раковый антиген 72-4 (СА 72-4). Тест на СА 72-4
выявляет в сыворотке опухолеассоциированный муциноподобный гликопротеин TAG 72 (молекулярный вес
400000 дальтон) с помощью 2 моноклональных антител, а именно: мышиных СС49, направленных против высокоочищенного TAG 72, и меченых антител 72-3, полученных против метастатических клеток карциномы молочной железы.СА 72-4 является опухолевым маркером, полезным для мониторинга течения заболевания и эффективности терапии при карциноме желудка.
Слайд 344. Раковый антиген 15-3 (СА 15-3) является третьим маркером, охарактеризованным
благодаря использованию гибридомной технологии. СА 15-3 представляет собой сывороточный муцингликопротеин
(молекулярный вес 300000 дальтон), обладающий высокой чувствительностью в отношении карциномы молочной железы.СА 15-3 является опухолевым маркером выбора при карциноме молочной железы.
Слайд 355. Раковый антиген 125 (СА 125) является вторым (после СА
19-9) маркером, обнаруженным в результате использования гибридомной технологии. Его молекулярный
вес 200000 дальтон. Данный маркер представляет собой дифференцировочный антиген, который происходит из дериватов целомического эпителия тканей плода. Он присутствует в клетках линий серозных карцином яичника, а также в участках ткани серозных аденокарцином, но не в слизеобразующих карциномах яичника. Верхняя граница нормы - 35 Ед/мл.Слайд 366. Нейрон-специфическая енолаза (НСЕ) была обнаружена в нейронах мозга и
периферической нервной системы и представляет собой фермент, расщепляющий глюкозу. Она
состоит из двух практически идентичных полипептидных цепей, молекулярный вес каждой - 39000 дальтон. НСЕ выявляется также в нейроэндокринной ткани, особенно в клетках APUD-системы, имеющих нейроэктодермальное происхождение и представленных в нейроэндокринной ткани. Верхняя граница нормы здоровых индивидов контрольной группы -12,5 нг/мл.Слайд 377. Альфа-фетопротеин (АФП) также представляет собой гликопротеин (молекулярный вес 70000
дальтон). АФП является физиологическим продуктом желточного мешка, печени и желудочно-кишечного
тракта плода. С помощью моноклональных антител на молекуле АФП идентифицируется от 3 до 7 различных эпитопов. АФП может обнаруживаться в сыворотке плода, начиная с 4-й недели беременности. Его концентрация достигает пика между 12 и 16 неделями и затем постепенно снижается вплоть до рождения. В возрасте 1 года нормальный уровень АФП в сыворотке такой же, как у взрослых, т. е. менее 15 нг/мл.АФП имеет два основных клинических применения:
во-первых, выявление и мониторинг первичной гепатоцеллюлярной карциномы, которая возникает, как правило, в цирротической печени;
во-вторых, мониторинг эффективности терапии и, в некоторой степени, диагностика гермином.
Слайд 388. Хорионический гонадотропин (ХГЧ) представляет собой гликопротеиновый гормон (молекулярный вес
46000 дальтон). Он состоит из двух нековалентно связанных субъединиц. ХГЧ-специфичная
антисыворотка взаимодействует с участком бета-цепи. ХГЧ образуется физиологически в синцитиотрофобластах плаценты. В герминомах он образуется трофобластическими структурами или синцитио-трофобластическими гигантскими клетками (клетками семиномы).Верхняя граница нормы у мужчин и небеременных женщин: 5 МЕд/мл. У мужчин и небеременных женщин патологическое повышение уровня ХГЧ является верным признаком наличия злокачественной опухоли.
Тестирование ХГЧ проводится, в основном:
во-первых, для обнаружения и мониторинга беременности;
во-вторых, для мониторинга гермином яичка и яичника.
Слайд 399. Простата-специфический антиген (PSA) является гликопротеином (молекулярный вес 34000 дальтон)
и обнаруживается в экскреторных протоках простаты.
Это физиологический экскреторный продукт
простаты, относящийся к каллекреинам. Он функционирует как сериновая протеаза для уменьшения вязкости спермы. Таким образом, органоспецифический PSA не является опухолеспецифическим.
В сперме он существует как мономер, тогда как в плазме он обнаруживается как в форме мономера, так и в виде комплекса с альфа-1-антихимотрипсином (молекулярный вес приблизительно 100000).
Слайд 40Тестирование PSA имеет два основных применения в клинической практике:
во-первых, для
мониторинга течения и эффективности терапии карциномы простаты;
во-вторых, для мониторинга состояния
пациентов с гипертрофией простаты в целях как можно более раннего обнаружения карциномы простаты.В кровяное русло PSA попадает в весьма ограниченном количестве:
- не более 2,5 нг/ мл у мужчин до50 лет;
- не более4,0 нг/ мл у мужчин 50 - 70 лет;
- не более 6,5 нг/мл у мужчин 70- 79 лет.
Слайд 45В онкологии биопсия является наиболее достоверным методом исследования.
Особенно на
ранних стадиях развития, от точности такого исследования зависит последующее лечение
и даже жизнь больного.На основании гистологической характеристики новообразований, их распространенности и индивидуальной чувствительности к химиопрепаратам, устанавливаемой с помощью биопсии, избираются хирургические, лучевые медикаментозные и комбинированные методы воздействия на опухоль, а также
определяется эффективность проведенных лечебных мероприятий, появление метастазов и рецидивов и выносится суждение о прогнозе.
Слайд 46Однако до сих пор не изжиты недостатки в оформлении документации,
допускаются ошибки в технике забора, обработки материала и его транспортировке
в лабораторию, что обуславливает неудачи в установлении правильного диагноза. Нередко эти ошибки дискредитируют сам метод биопсийного исследования.Слайд 47В настоящее время существуют следующие виды биопсий:
а) эксцизионные- хирургическое удаление
всего
патологического очага, (кожа, молочная железа, увеличенные лимфоузлы);
б) инцизионная- иссечение одного
или нескольких кусочков,в случае большого распространения процесса;
в)пункционная-изъятие материала обычной инъекционной
иглой (лимфоузлы, щитовидная железа, мягкотканные и костные опухоли);
г)трепан-биопсия-получение столбика тканей с помощью особых игл(кости, предстательная железа, костный мозг);
Слайд 48д) щипцовая- получение материала с помощью щипцов различной
конструкции (бронхоскопия, эзофагоскопия,
гастроскопия);
е) кюретаж - выскабливание полостей (матка, гайморова пазуха);
ж) направленная катетеризационная
биопсия - эндоскопические методы;з) аспирационная-удаление жидкости, скопившейся в
результате патологического процесса в полостях.
и) мазки-отпечатки-цитологический способ.
к)соскоб-удаление клеток с поверхности опухоли скальпелем или шпателем;
л) биопсия путём промывания полых органов-бронхи,
желудок;
м)случайная биопсия- кусочки самовыделяющиеся из больного при откашливании , выделения из влагалища, прямой кишки.
Слайд 49Биопсии бывают срочными или плановыми.
Срочные изготавливаются в течение 20
минут.
Плановые приготавливаются через 48 часов и более, в зависимости
от метода специального исследования. Материал необходимо присылать в лабораторию полностью, а если это невозможного вырезать кусочки размером 1,0 х 1,0см, которые фиксируются 10% формалином, 96% спиртом или смесью спирт-формалин в равных количествах.
Количество фиксатора должно превышать объем материала в 20 раз.
Флакон должен быть из светлого стекла с широким отверстием, плотно закрытым.
На флаконе должна быть этикетка с фамилией больного, диагнозом, названием материала.
Направление к присылаемому материалу должно быть заполнено согласно пунктам.
Слайд 50Биопсии проводят также при клинически установленном диагнозе со следующими целями:
1.-для
гистологического подтверждения диагноза, так как клинические данные могут оказаться ошибочными
и привести к калечащим операциям.2.-для получения точной морфологической характеристики опухоли, гистологической характеристики и степени дифференцировки,
3.-для определения распространенности опухолевого процесса как в поражённом органе, так и за его пределами, что определяет выбор лечения,
Слайд 514.-для выявления индивидуальной чувствительности злокачественной опухоли к химиопрепаратам.
5.-для выяснения половой
принадлежности гормонально зависимых опухолей
6.- для определения радикальности и абластичности
предпринимаемого хирургического вмешательства7.-для выявления или исключения рецидива опухоли.
Слайд 52Ещё раз о фиксации.
Фиксация обеспечивает стабилизацию тканевых структур и их
уплотнение. Выбор фиксирующей среды зависит от задач исследования (например, при
необходимости выявления гликогена объекты следует фиксировать не в формалине, а в этаноле).Объем фиксирующей жидкости должен превышать объем кусочков не менее, чем в 10 раз. При этом следят, чтобы кусочки в растворе не слипались и не прилегали ко дну банки. Охлаждение фиксируемых в формалине объектов нежелательно, т.к. при этом замедляется проникновение фиксатора в ткани.
Слайд 53Формалин - наиболее распространенная и универсальная фиксирующая жидкость. Формалин хорошо
проникает в ткани и потому может применяться для фиксации довольно
крупных объектов.После фиксации в формалине объекты могут быть залиты в парафин, целлоидин или порезаны на замораживающем микротоме.
Большим достоинством формалина как фиксатора является возможность сохранения в нем кусочков в течение длительного времени после завершения фиксации.
Недостатком формалина является ухудшение окраски тканей при продолжительной фиксации и хранении влажного архива.
Слайд 54Этанол - для фиксации тканей применяют как 95°, так и
абсолютный этиловый спирт, а также различные смеси этанола и формалина.
В практической работе следует применять этанол при фиксации нервной ткани для окраски по Нисслю и при планировании выявления гликогена. Лучшие результаты дает спиртовая фиксация в сравнении с формалиновой и при выявлении железа, бактерий, амилоида.
По сравнению с формалином спирт обладает меньшей проникающей способностью, поэтому кусочки для фиксации берут не толще 0,5 см.
Продолжительность фиксации от нескольких часов до суток.