Слайд 1КОЛЛИГАТИВНЫЕ
СВОЙСТВА
РАСТВОРОВ
Слайд 2ПЛАН:
Закон Рауля (1-ый закон)
Следствия из закона Рауля
(2-ой закон)
Осмос и осмотическое давление. Уравнение Вант-Гоффа
Коллигативные свойства
для разбавленных растворов электролитов
Применение и биологическое значение коллигативных свойств растворов
Слайд 3ИДЕАЛЬНЫЙ РАСТВОР - раствор, образование которого не сопровождается химическим взаимодействием
компонентов, изменением
объема и тепловым эффектом.
Сильно разбавленные растворы неэлектролитов, где Nв<<0,005 (мольная доля растворенного вещества)
А – растворитель, В – растворенное вещество
Слайд 4КОЛЛИГАТИВНЫЕ СВОЙСТВА – свойства растворов, которые определяются только количеством растворенного
вещества (зависят только от количества частиц в растворе) и не
зависят от природы этих частиц.
Это: 1) давление насыщенного пара
2) повышение температуры кипения
3) понижение температуры замерзания
4) осмотическое давление
Слайд 5Закон Рауля (I закон) 1882 год.
Относительное понижение давления пара
растворителя над раствором равно мольной доле растворенного вещества.
, т.к.
Р
= Ро NA и NA + NB = 1
Вода при атмосферном давлении 101,3 кПа кипит при 100о С потому, что при этой температуре давление водяного пара равно 101,3 кПа
Слайд 6Р = Ро – Р абсолютное понижение
давления
насыщенного пара
относительное понижение
давления насыщенного пара
Чем выше концентрация растворенного вещества, тем больше Р и Р/Ро
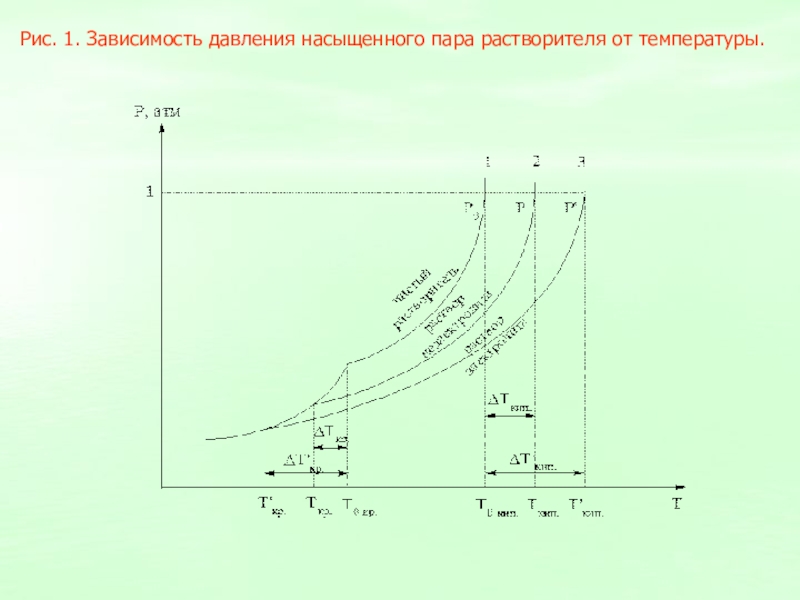
Слайд 7Следствием понижения давления насыщенного пара растворителя над раствором являются повышение
температуры кипения и понижение температуры замерзания раствора по сравнению с
чистым растворителем.
Для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорционально числу молей растворенного вещества (моляльной концентрации раствора Сm)
II закон Рауля Т = k Сm (k – константа)
Слайд 8Ткип = Ткип. р-ра – Ткип. р-рителя
Кэ = Еэ –
эбуллиоскопическая константа растворителя (зависит лишь от природы растворителя).
Ткип = Кэ
Сm = Еэ Сm
Тзам. = Тзам. р-рителя – Тзам. р-ра
Кк – криоскопическая постоянная растворителя (зависит лишь от природы растворителя).
Тзам = Кк Сm
Слайд 9Рис. 1. Зависимость давления насыщенного пара растворителя от температуры.
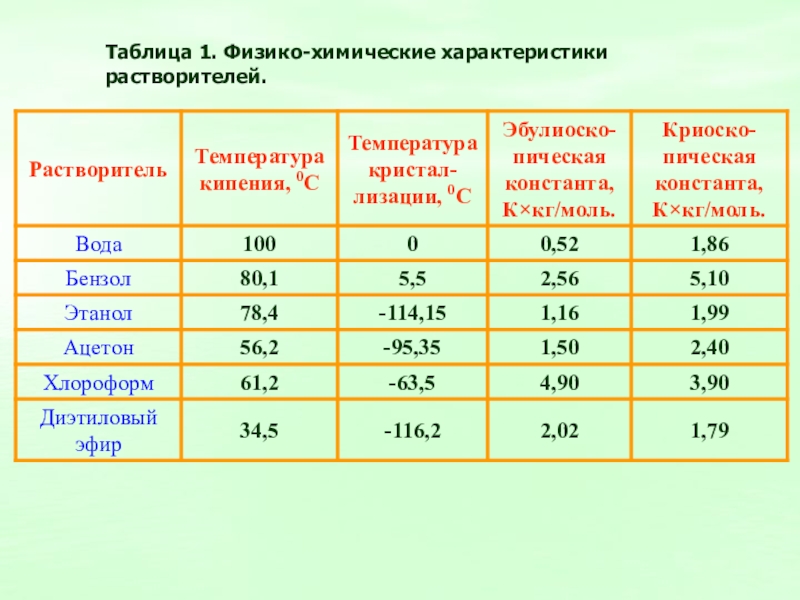
Слайд 10Таблица 1. Физико-химические характеристики растворителей.
Слайд 11Процесс самопроизвольного выравнивания концентрации веществ в термодинамической системе называется диффузией.
Диффузия – двусторонний процесс.
Осмос – процесс преимущественного одностороннего проникновения молекул
растворителя через полупроницаемую мембрану.
Осмотическое давление – дополнительное гидростатическое давление, при котором осмос прекращается.
Ргидр. = gh, где
- плотность жидкости, g = 9,8 м/с2, h – высота столба жидкости, м.
Слайд 13Для разбавленных растворов неэлектролитов зависимость осмотического давления от температуры и
концентрации выражается уравнением Вант-Гоффа (закон Вант-Гоффа)
Росм = См
R T
См=nB/Vр-ра (молярная концентрация неэлектролита, моль/л)
R – 8,31 Дж/мольК (газовая постоянная)
Т – температура по Кельвину (Т=273+tоС)
Росм – измеряется в кПа
Слайд 14Для применения законов Рауля и Вант-Гоффа к электролитам было предложено
использовать изотонический коэффициент (i). (Вант-Гофф)
Изотонические растворы – растворы, имеющие равные
осмотические давления.
Гипертонический раствор – имеет большее осмотическое давление по сравнению с другим раствором.
Гипотонический раствор – имеет меньшее осмотическое давление, по сравнению с другим раствором.
По Вант-Гоффу (причем i > 1):
Слайд 15С. Аррениус показал (1887 г), что для электролитов имеется степень
диссоциации ().
0 < ≤ 1, тогда i = 1
+ (n-1)
n – число ионов, на которые распадается молекула электролита,
- степень диссоциации (для сильных электролитов кажущаяся степень диссоциации).
Например, для: СаСl2 = Са2+ + 2Сl-
при каж=0,9 i = 1 + 0,9 (3 - 1) = 2,8
Слайд 16Для разбавленных растворов электролитов используются уравнения:
Слайд 17Эбуллиометрия – метод определения молекулярных масс растворенных веществ и концентрации
растворов, основанный на измерении повышения температуры кипения растворов.
Криометрия – метод
определения молекулярных масс растворенных веществ и состава антифризов, основанный на измерении температуры замерзания растворов.
Осмометрия – метод определения молекулярной массы растворенных веществ и их концентраций, основанный на измерении осмотического давления растворов.
Слайд 18Биологическое значение осмоса и осмотического давления
Животные и растительные клетки
в составе оболочки имеют полупроницаемые мембраны.
Оболочка эритроцитов свободно пропускает воду,
но непроницаема для ряда катионов.
Тургор клетки (всасывание воды корнями растений, набухание семян растений) – это показатель водного баланса, снижение которого приводит к старению и увяданию клеток.
Слайд 19Рис. 3. Изменения, происходящие с кровяными тельцами в растворах NaCl
различной концентрации:
а – изотонический раствор NaCl (0,9%);
б – гипотонический раствор
NaCl (0,1%);
в – гипертонический раствор NaCl (2%).
Слайд 20Осмолярность (осмоляльность) – суммарная концентрация всех кинетически активных частиц, определяющих
его осмотическое давление.
Осмотическое давление кровяных эритроцитов 7,6-7,9 атм. (740-780 кПа).
Физиологический раствор - 0,9% раствор NaCl, имеет такое же осмотическое давление (изотоничен крови).
Онкотическое давление – часть осмотического давления крови, создаваемое белками (альбумины, глобулины). Оно равно 0,04 атм. (0,5% от общего осмотического давления).
Падение осмотического давления в клетках (при обезвоживании организма) приводит к их коллапсу (за счет плазмолиза).
Увеличение осмотического давления в клетках приводит к осмотическому шоку (гемолиз).
При потерях крови применяют инертные высокомолекулярные заменители плазмы крови (поливинилпирролидон)
Слайд 21Осмотический гомеостаз – постоянство осмотического давления крови и других биологических
жидкостей характерно для высокоорганизованных животных.
Гипертонические повязки в хирургии – очистка
гнойных ран.
Слабительное действие MgSO47H2O (горькая соль) и Na2SO410H2O (глауберова соль) – также основано на явлениях осмоса.