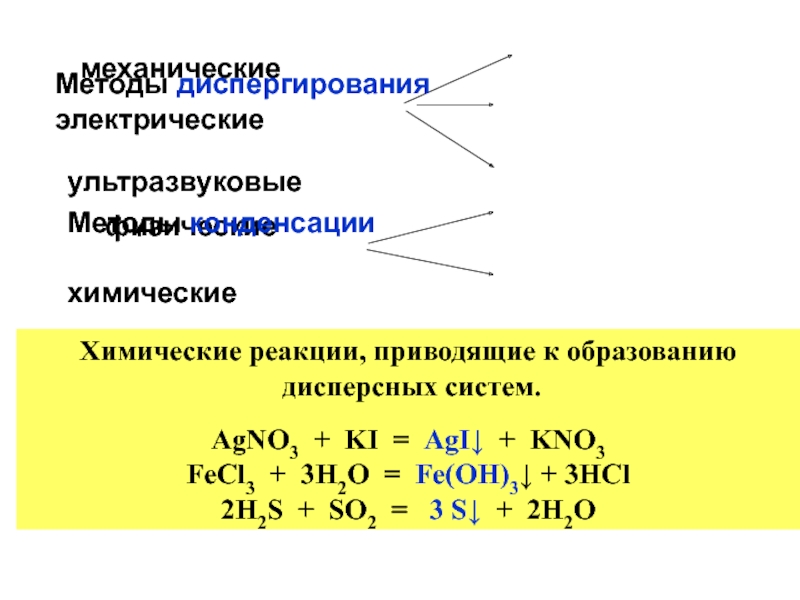
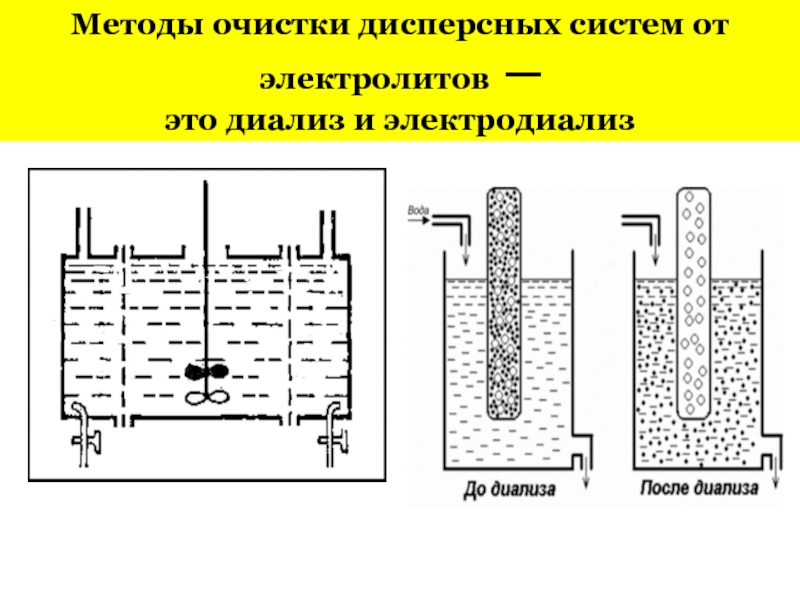
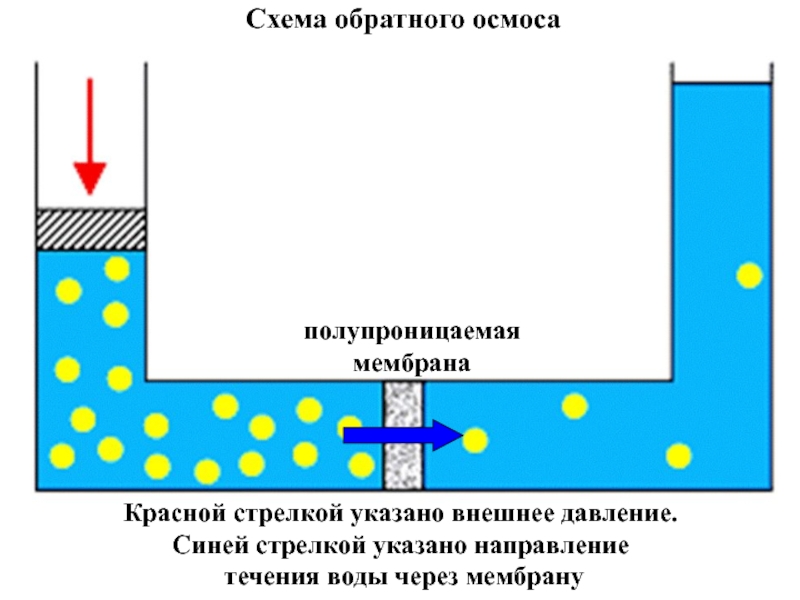
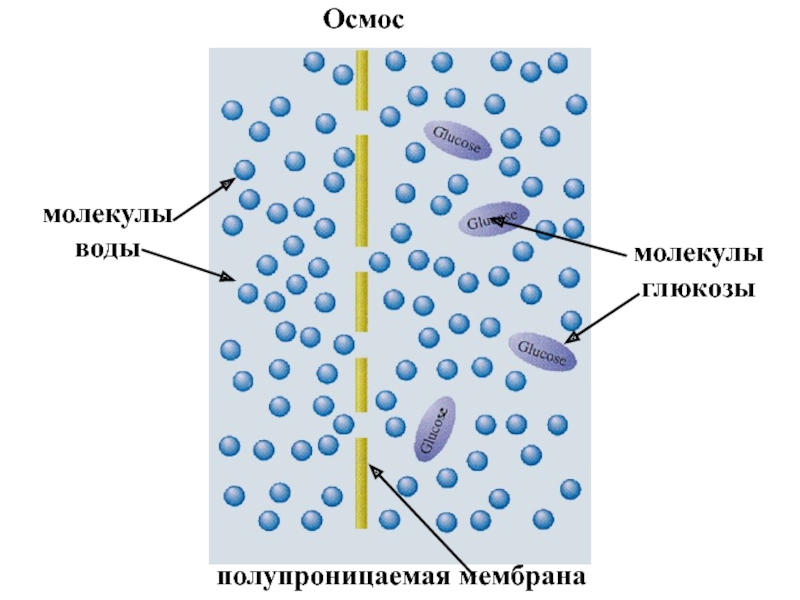
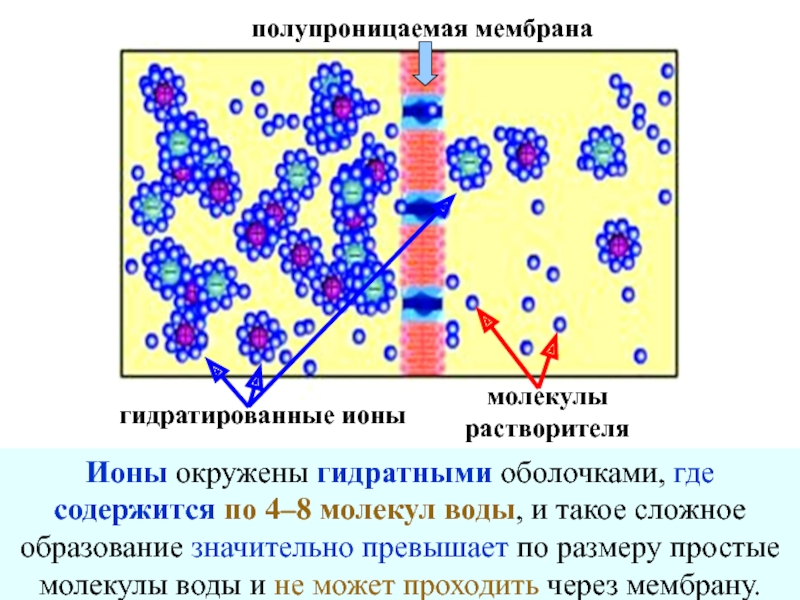
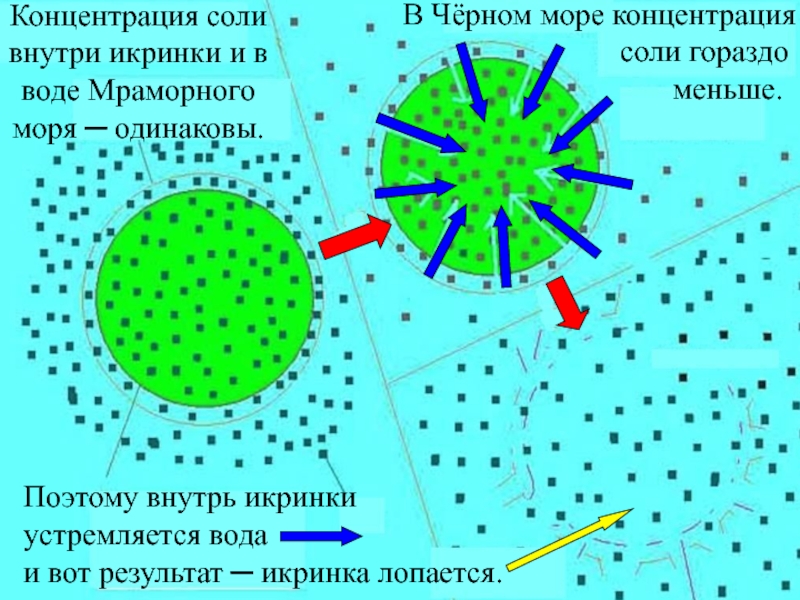
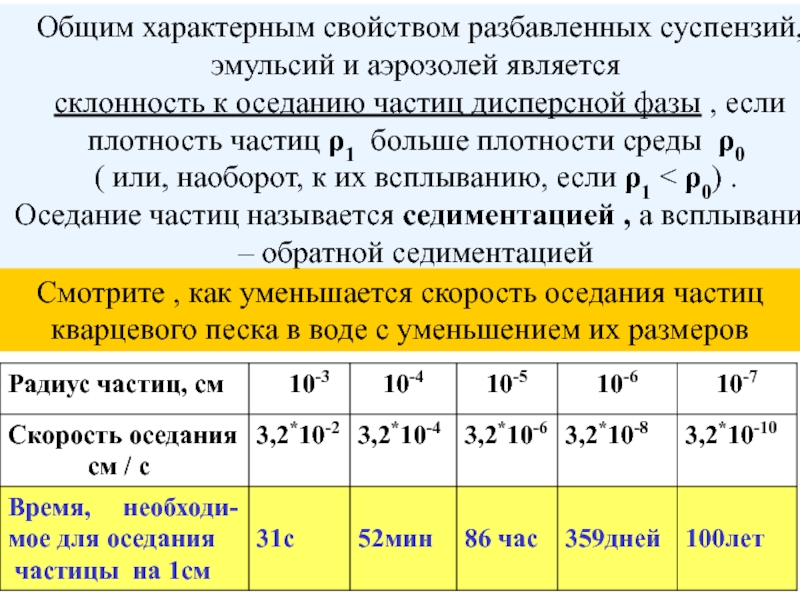
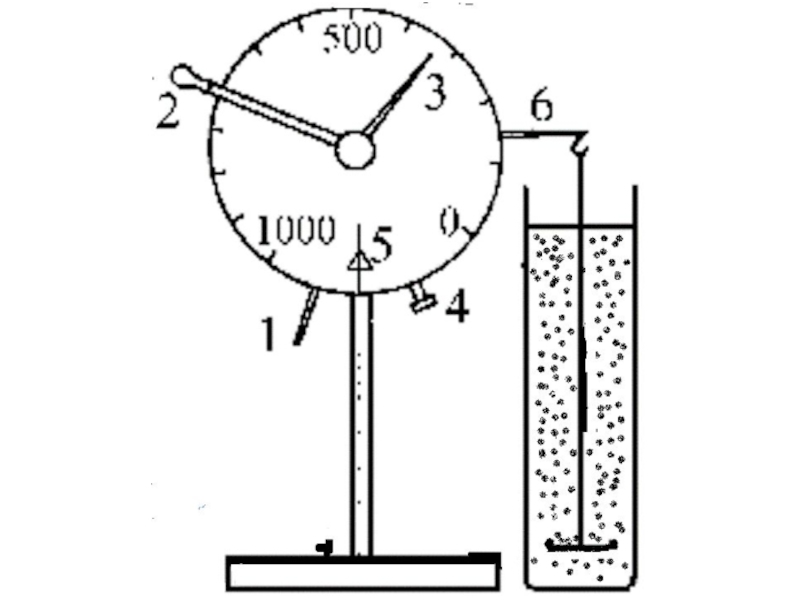
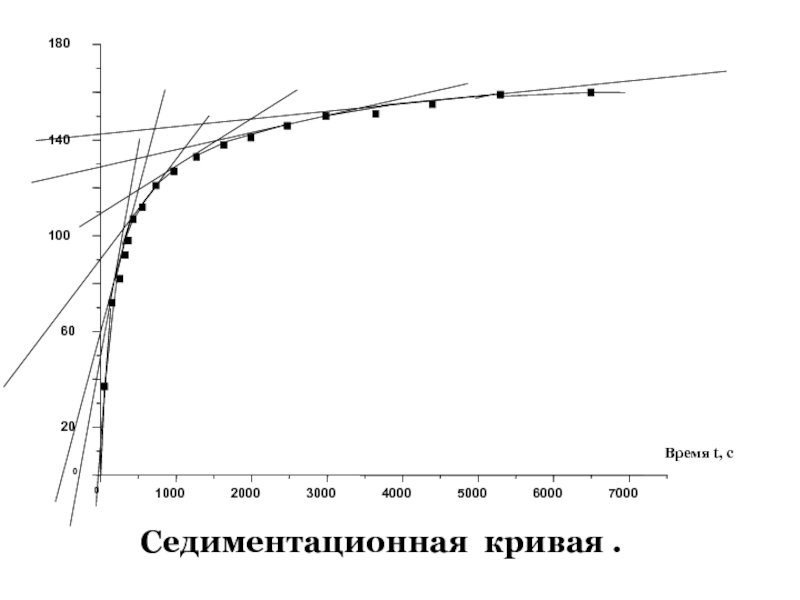
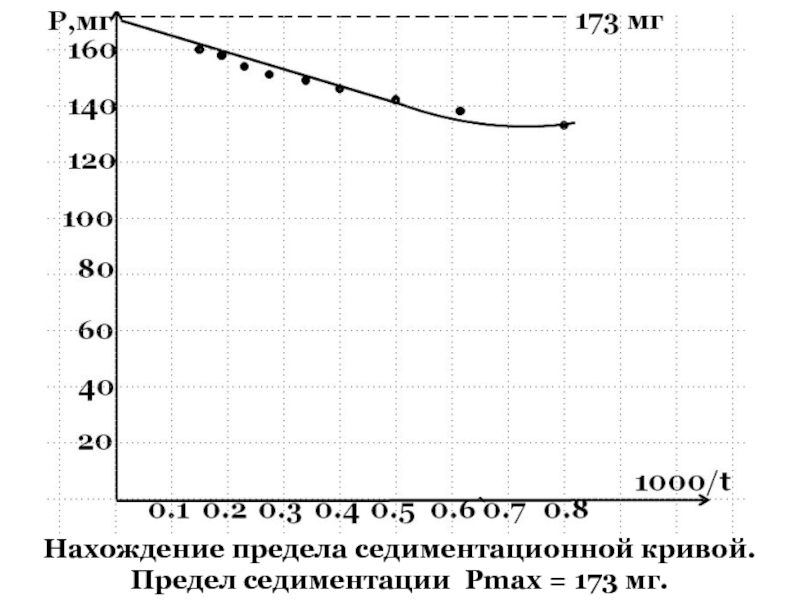
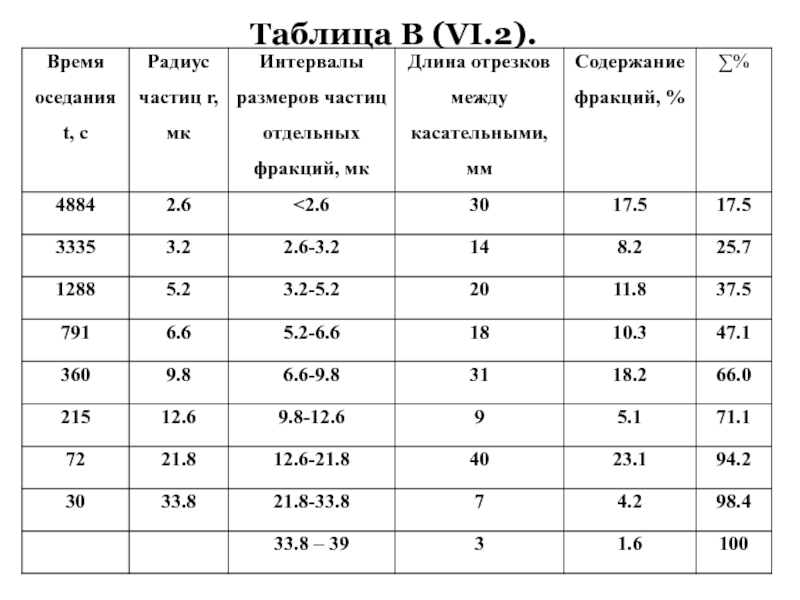
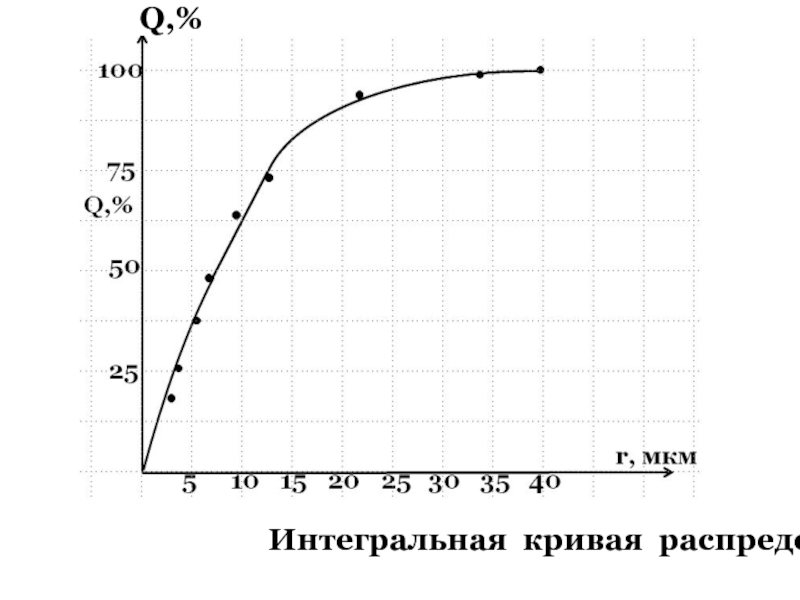
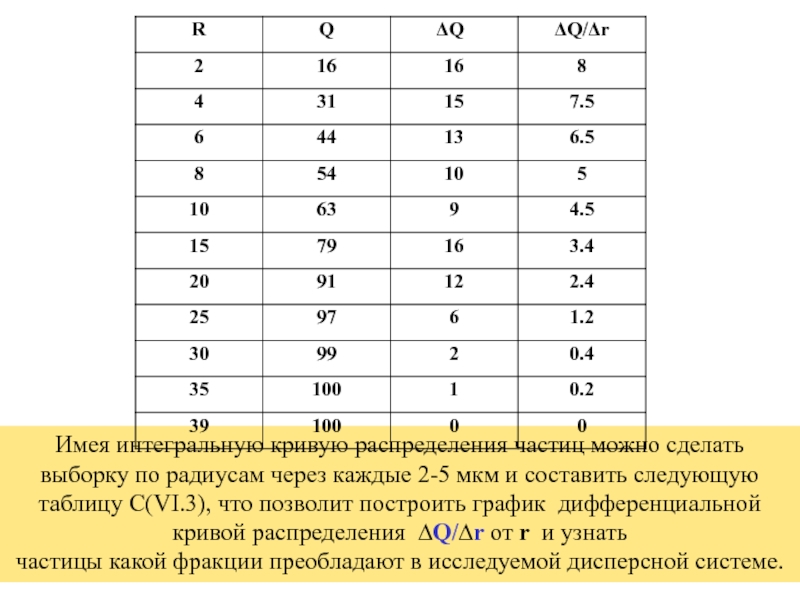
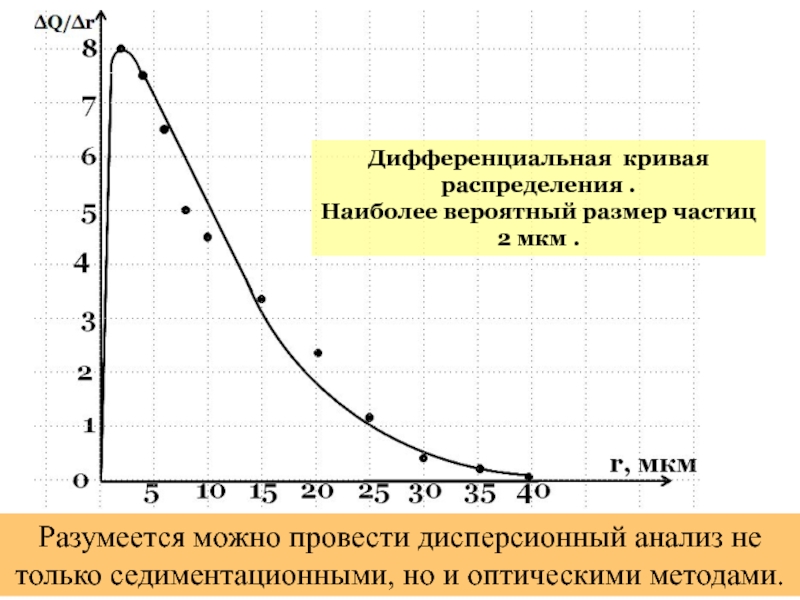
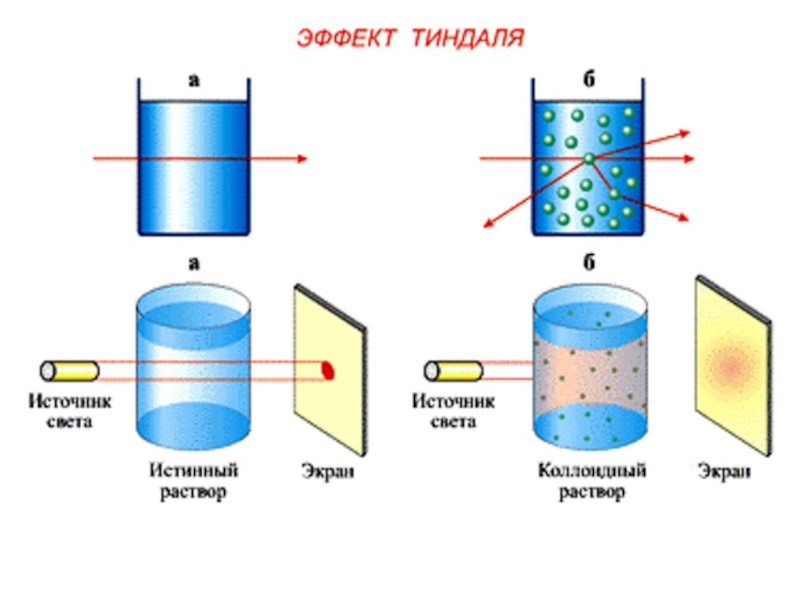
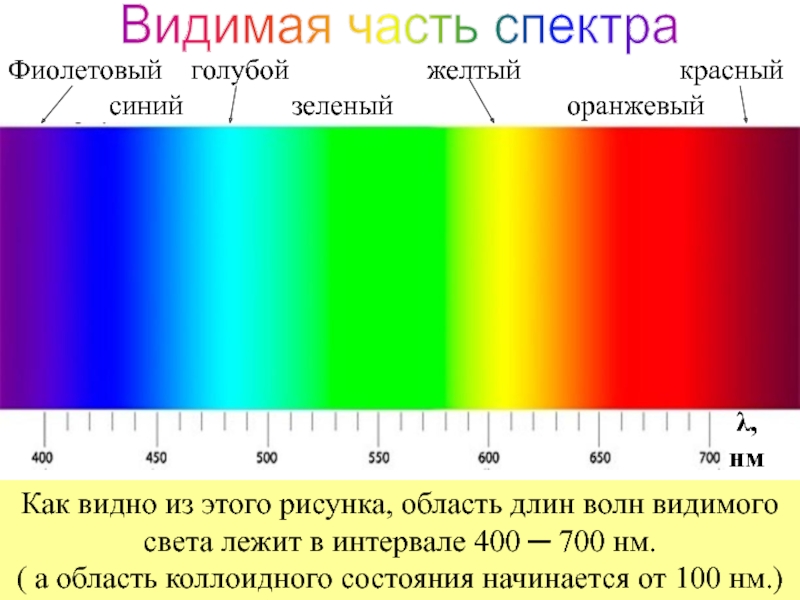
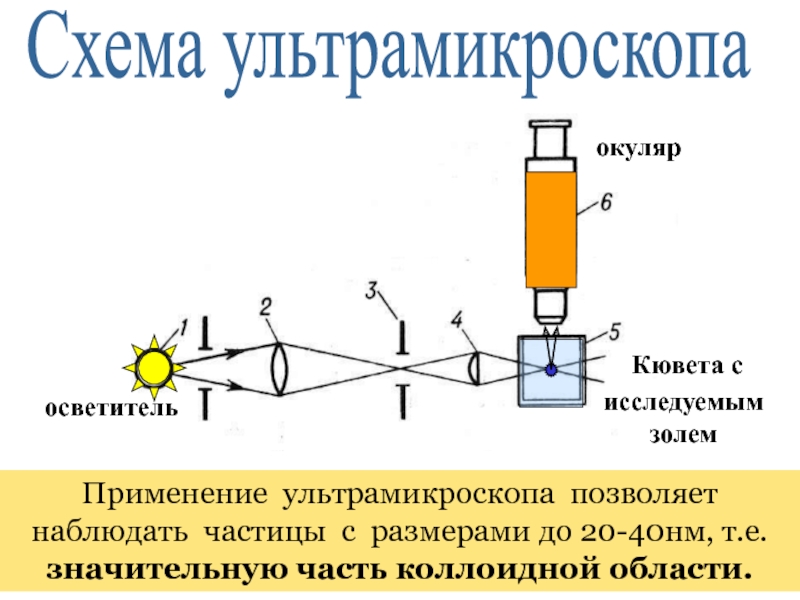
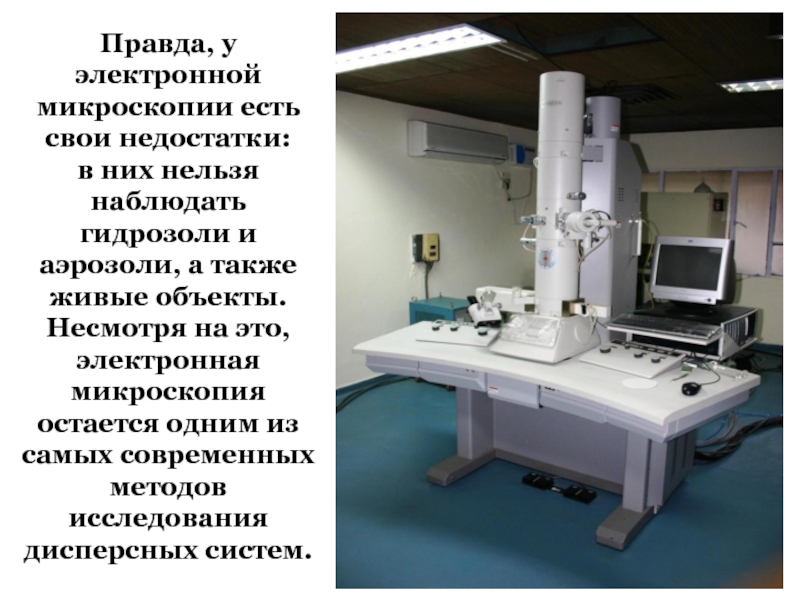
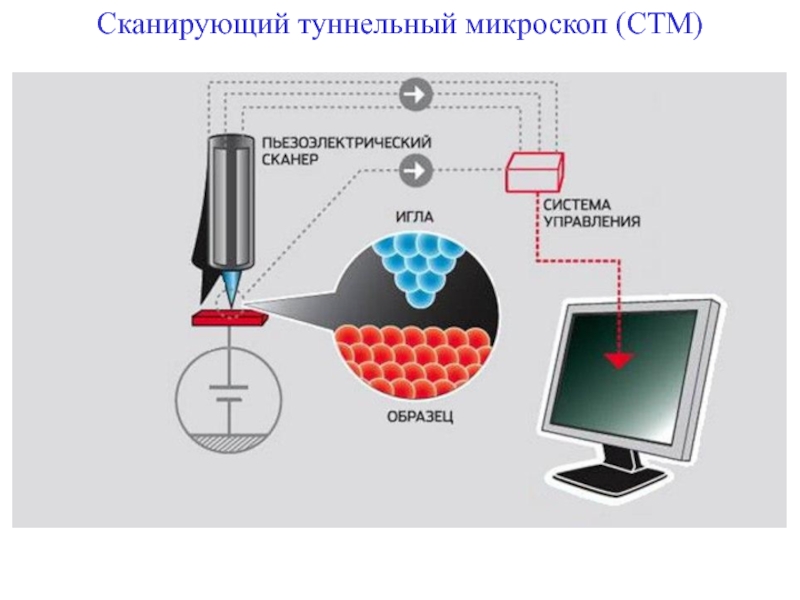
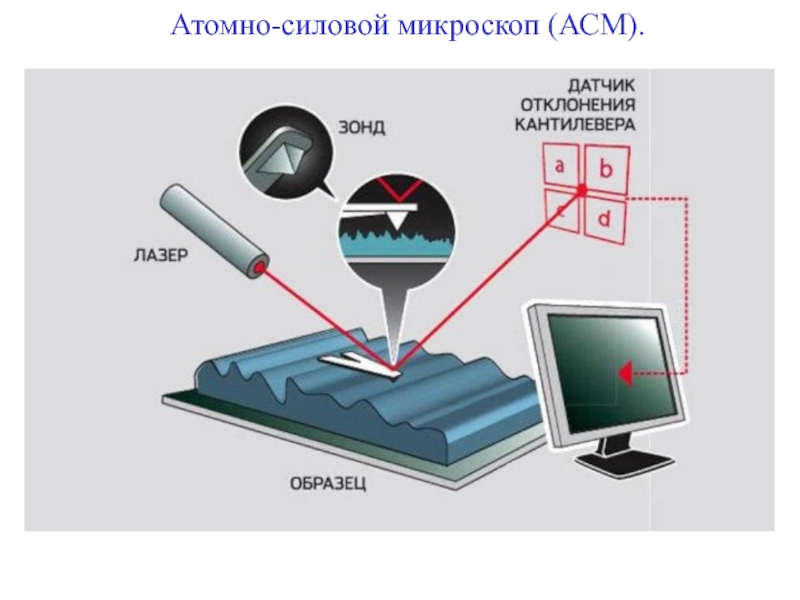
+ H2O + 2* 96500 Кл/ моль = Сu +
½O2 + H2SO4Физическая химия – наука, которая исследует взаимосвязь химических процессов и физических явлений, сопровождающих эти процессы .
В этой реакции выделяется энергия ( за счет которой и существуют живые организмы)
А для проведения этой реакции, напротив, необходимо затратить энергию
Большинство химических реакций связано с физическими явлениями ( выделение тепла, света, возникновение разности потенциалов и т.п.)