Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
КОМПЛЕКСОНО-МЕТРИЧЕСКОЕ ТИТРОВАНИЕ (КМТ)
Содержание
- 1. КОМПЛЕКСОНО-МЕТРИЧЕСКОЕ ТИТРОВАНИЕ (КМТ)
- 2. Реакции комплексообразованияМеn+ + nL → MeLnL –
- 3. Дентатность (зубчатость) Это характеристика лиганда - число
- 4. Комплексоны В методах титрования используют только такие
- 5. ЭДТАКомплексон III – ЭДТА (двунатриевая соль ЭДТУ,
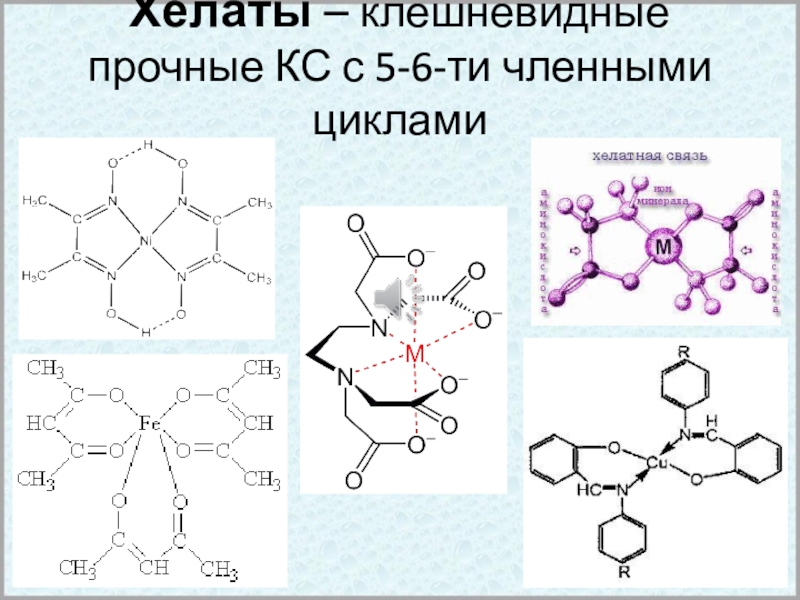
- 6. Хелаты – клешневидные прочные КС с 5-6-ти членными циклами
- 7. Фактор эквивалентности в КмТВ комплексонометрии фактор эквивалентности
- 8. Константы равновесия Реакция комплексообразованияMe2+ + Y4- ↔
- 9. Константы устойчивости Для комплексонатов Ме с ЭДТА
- 10. Требования к реакциям в КмТконст. устойчивости (β,
- 11. αY - молярная доля свободных анионов ЭДТА
- 12. Значения αY при разных рН можно рассчитать
- 13. Молярная доля (αМе)αMe – молярная доля свободных
- 14. Способы КМТ Прямое титрование – для определения
- 15. Индикаторы в КМТ– металлохромные индикаторы –
- 16. Механизм действия металлохромных индикаторов1) В раствор с
- 17. Правила выбора металлохромных индикаторовИндикатор выбирают не
- 18. Индикатор Эриохром черный Т (ЭХЧ)С20Н13О7N3S – органический
- 19. Кривые КМТ Это зависимости рМе от VТ,
- 20. Пример кривых КМТ100 мл 0,01 М р-ра
- 21. Особенности кривых КМТ Скачок титрования тем больше,
- 22. Достоинства КМТ Применяется для определения большого числа
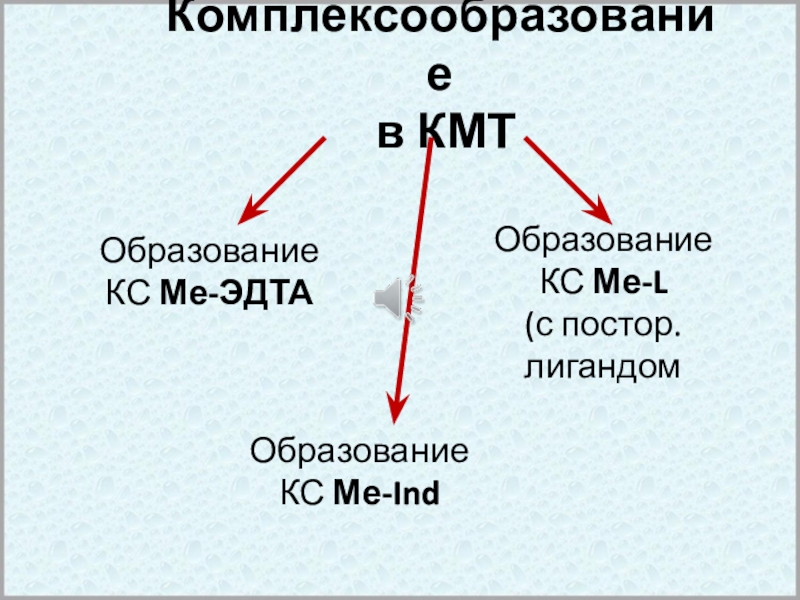
- 23. Комплексообразование в КМТОбразование КС Ме-ЭДТАОбразование КС Ме-IndОбразование КС Ме-L (с постор. лигандом
- 24. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1КОМПЛЕКСОНО-МЕТРИЧЕСКОЕ ТИТРОВАНИЕ
(КМТ)
– основано на проведении реакций комплексообразования с лигандами -
комплексонами
Слайд 2Реакции комплексообразования
Меn+ + nL → MeLn
L – лиганд, донор свободной
пары электронов (NH3, Н2О, CN-, Сl-, орг. соед. с функц.
группами –ОН, –СООН, >C=O или сод. S, P, Gal, O, As)Между ионом-комплексообразователем и лигандами образуются ковалентные связи по донорно-акцептоному механизму.
Например, K3[Fe(CN)6] – гексацианоферрат калия
Это КС, где Fe3+ - центральный ион-комплексообразователь (у него есть вакантные электронные орбитали),
CN- – лиганд (донор 1 пары электронов на N:)
6 – координационное число (характеристика иона-комплексообразователя – сколько он может предоставить мест для образования связей с лигандами)
Слайд 3Дентатность (зубчатость)
Это характеристика лиганда - число неподеленных электронных пар,
которые он может предоставить для связывания с ионом-комплексообразователем.
Монодентатные лиганды
– 1 пара электронов (NH3, Н2О, CN-, Сl-) Бидентатные лиганды – 2 пары электронов
Полидентатные : три-, тетра-, пента-, гекса-, …
Образование КС с монодентатными лигандами проходит ступенчато: Ме + L → MeL ; МеL+ L → MeL2 ; МеL2 + L → MeL3 и т.д.
Для титрования такие реакции обычно не используют из-за сложности определения ТЭ!!!
Слайд 4Комплексоны
В методах титрования используют только такие лиганды, которые образуют
КС с ионами металлов по одному механизму со строгим соблюдением
стехиометрии: Ме + L= MeL, т.е. Mе:L = 1:1(все координационные места иона-комплексообразователя занимает 1 лиганд !!!)
Полидентатные лиганды – комплексоны – это орг. соединения – произв. аминополикарбоновых кислот.
Комплексон I – НТУ (нитрилотриуксусная кислота)
N≡(CH2COOH)3 тетрадентатный
Комплексон II – ЭДТУ, H4Y (этилендиаминтетрауксусная кислота) (HOOCH2C)2=N-СН2-СН2-N=(CH2COOH)2 (гексадентатный , плохо растворимый в воде)
Слайд 5ЭДТА
Комплексон III – ЭДТА (двунатриевая соль ЭДТУ, трилон Б, Na2H2Y,
H2Y2- или Y4-).
ЭДТА хорошо растворим в воде, его можно получить
в чистом виде и использовать в качестве первичного стандарта.
Но чаще готовят раствор ЭДТА примерной концентрации и стандартизуют.Комплексон III образует со многими катионами Ме (Ca2+, Mg2+, Zn2+, …) достаточно прочные комплексонаты – внутрикомплексные соли с клешнеобразным строением (хелаты ).
Слайд 7Фактор эквивалентности в КмТ
В комплексонометрии фактор эквивалентности ионов Ме любой
валентности и ЭДТА всегда равен 1/z = 1/1, т.к. Mе:L
= 1:1.Me2+ + H2Y2- ↔ MeY2- + 2H+
Me3+ + H2Y2- ↔ MeY- + 2H+
Me4+ + H2Y2- ↔ MeY + 2H+
Реакция образования комплексонатов сопровождается выделением ионов Н+, сдвигающего равновесие реакции в обратную сторону.
В комплексонометрии рН среды имеет огромное значение,
для поддержания определенного рН используют буферные растворы (щелочной буфер: NH4OH + NH4Cl).
Слайд 8Константы равновесия
Реакция комплексообразования
Me2+ + Y4- ↔ MeY2- характеризуется Кравн, называемой
константой устойчивости КС (β):
Процесс диссоциации КС MeY2- ↔ Me2+
+ Y4- характеризуется константой нестойкости (Кнест):Слайд 9Константы устойчивости
Для комплексонатов Ме с ЭДТА βMeY приведены
в
справочниках при рН = 12 (без учета кислотности среды).
Если рН ≠ 12, рассчитывают условную константу устойчивости β᾽ (с учетом кислотности среды):Если в титруемой системе рН ≠ 12, и присутствуют посторонние лиганды, образующие КС с ионами Ме, рассчитывают дважды условную константу устойчивости β᾽᾽ (с учетом кислотности среды и побочных реакций):
Слайд 10Требования к реакциям в КмТ
конст. устойчивости (β, β᾽, β᾽᾽) д.
б. > 108 !!!
Быстрота протекания
Резкое изменение С(Меn+) в
ТЭЛабильность комплексоната (он д. быстро образовываться и быстро распадаться)
Прочность комплексоната, т.е.
Комплексонаты I, II, III вполне отвечают этим требованиям.
Слайд 11αY - молярная доля свободных анионов ЭДТА (Y4-):
где CY –
общая концентрация ЭДТА
СY = [Y4-] + [HY3-] + [H2Y2-] +
[H3Y-] + [H4Y]Молярная доля (αY)
Слайд 12Значения αY при разных рН можно рассчитать через ступенчатые константы
диссоциации ЭДТУ (K1, K2, K3, K4):
или взять в справочнике
(Лурье):Молярная доля (αY)
αY
αY
H4Y ↔ H3Y- + H+ К1 = 1,17∙102
H3Y- ↔ H2Y2- + H+ К2 = 4,68∙102
H2Y2- ↔ HY3- + H+ К3 = 1,45∙106
HY3- ↔ Y4- + H+ К4 = 1,82∙1010
Слайд 13Молярная доля (αМе)
αMe – молярная доля свободных ионов металла
,
где
αMe рассчитывается через ступенчатые константы образования (β1, β2, …,
βn ) комплексов МеLn
(из справочных таблиц): = 1 + β1∙[L] + β1∙β2∙[L]2 + … + β1∙β2∙…∙βn[L]n
Ме + L → MeL (β1)
МеL+ L → MeL2 (β2)
МеL2 + L → MeL3 (β3)
……………………….
МеLn-1 + L → MeLn (βn)
Слайд 14Способы КМТ
Прямое титрование – для определения ионов Ме, быстро
реагирующих с ЭДТА, и при наличии подходящего индикатора:
Меn+ + ЭДТА
→ Ме-ЭДТАmОВ = СЭДТА∙VЭДТА∙МОВ∙10-3
Обратное титрование – для определения ионов Ме, медленно образующих комплексы с ЭДТА, и при отсутствии подходящего индикатора:
Меn+ + изб.ЭДТА → Ме-ЭДТА + ост.ЭДТА
ост.ЭДТА + Mg2+ → Mg-ЭДТА
mОВ = (СЭДТА∙VЭДТА – СMg∙VMg)∙МОВ∙10-3.
Вытеснительное титрование – для определения ионов Ме, быстро реагирующих с ЭДТА, но при отсутствии подходящего индикатора:
Меn+ + изб. Mg-ЭДТА → Ме-ЭДТА + Mg2+
Mg2+ + ЭДТА → Mg-ЭДТА
Формула расчета массы ОВ как в прямом титровании.
Слайд 15Индикаторы в КМТ
– металлохромные индикаторы –
это органические соединения, образующие
с ионами Ме окрашенные КС.
Примеры: эриохром черный Т, мурексид, калькон,
ксиленовый оранжевый, …Окраска свободной формы индикатора (Ind) и связанной в КС с Ме (МеInd) – различная.
КС МеInd д.б. менее прочным, чем комплексонат МеY (βМеInd в 10-104 раз <, чем βМеY)!!!
КС МеInd д. легко разрушаться.
Слайд 16Механизм действия металлохромных индикаторов
1) В раствор с Men+ добавляют
мет/хр индикатор, часть ионов Меn+ свяжется с ним в
КС, которое придаст раствору окраску 1:Меn+ + Ind → MeInd
2) Начинают титровать (добавлять ЭДТА), сперва с ЭДТА образуют комплексонат свободные ионы Меn+ (MeY). Когда они все будут оттитрованы, ЭДТА вытесняет Ind из КС МеInd, в растворе образуется комплексонат МеY, и появляется свободная форма Ind, которая имеет другую окраску 2:
МеInd + Y → MeY + Ind
Слайд 17Правила выбора
металлохромных индикаторов
Индикатор выбирают не по скачку на кривой
титрования, как в КОТ и ОВТ.
Индикатор д. образовывать окрашенное КС
с определяемым Ме.КС Ме-Ind д. легко разрушаться под действием ЭДТА.
Изменение окраски д.б. контрастным.
мурексид
Слайд 18Индикатор Эриохром черный Т (ЭХЧ)
С20Н13О7N3S – органический азокраситель с хромофорной
группой –N=N-
КС [Са-ЭХЧ] – винно-красного цвета
Свободная форма ЭХЧ – синего
цветаCa + ЭХЧ → Са-ЭХЧ
Са-ЭХЧ + Y → СаY + ЭХЧ
В ТЭ будет резкий переход окраски:
от винно-красной до синей.
Слайд 19Кривые КМТ
Это зависимости рМе от VТ, где pMe =
-lg[Me]
В начале титрования: [Me] = С0Ме
До ТЭ: в
растворе неоттитрованный остаток ионов МеВ ТЭ: в растворе комплексонат Ме-ЭДТА
После ТЭ: в растворе избыток титранта ЭДТА и комплексонат Ме-ЭДТА:
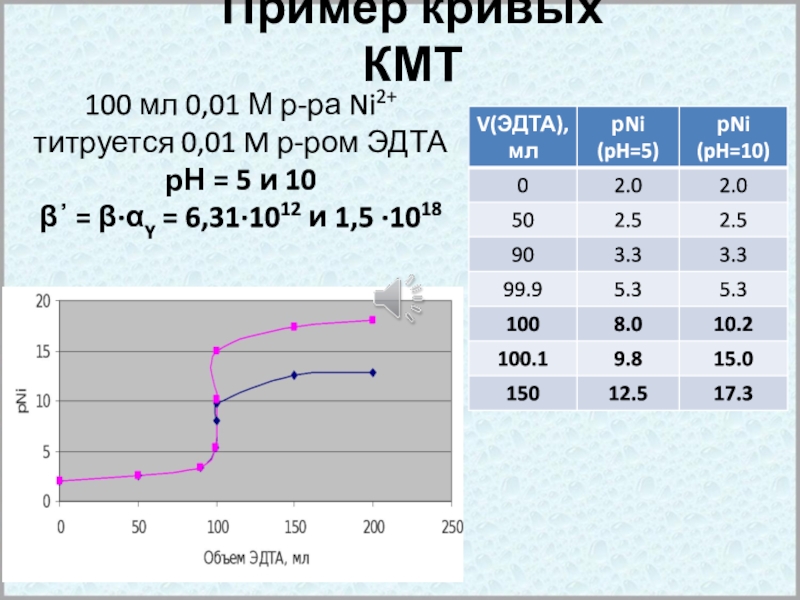
Слайд 20Пример кривых КМТ
100 мл 0,01 М р-ра Ni2+ титруется 0,01
M р-ром ЭДТА
рН = 5 и 10
β᾽ = β∙αY =
6,31∙1012 и 1,5 ∙1018 Слайд 21Особенности кривых КМТ
Скачок титрования тем больше, чем больше С(Ме), С(Y),
рН и β᾽(МеY)
(при С < 10-5 моль/л скачка нет)
Скачок
титрования зависит от присутствия посторонних лигандов (вплоть до невозможности титрования).До ТЭ ход кривой титрования не зависит от рН, в ТЭ и после – зависит от рН (в формулах есть β᾽).
Слайд 22Достоинства КМТ
Применяется для определения большого числа ионов Ме с
использованием 1 титранта – ЭДТА.
Экспрессность.
Простота.
Высокая точность.
Низкая
себестоимость.Возможность единичных определений и массовых анализов.
Селективность (определение 1 элемента в присутствии других)
Селективность КМТ обеспечивается контролем рН и введением посторонних лигандов









![КОМПЛЕКСОНО-МЕТРИЧЕСКОЕ ТИТРОВАНИЕ (КМТ) αY - молярная доля свободных анионов ЭДТА (Y4-):где CY – общая αY - молярная доля свободных анионов ЭДТА (Y4-):где CY – общая концентрация ЭДТАСY = [Y4-] + [HY3-]](/img/tmb/6/582663/6e41146e7946c03ff01a62dc92a01018-800x.jpg)






![КОМПЛЕКСОНО-МЕТРИЧЕСКОЕ ТИТРОВАНИЕ (КМТ) Индикатор Эриохром черный Т (ЭХЧ)С20Н13О7N3S – органический азокраситель с хромофорной группой Индикатор Эриохром черный Т (ЭХЧ)С20Н13О7N3S – органический азокраситель с хромофорной группой –N=N-КС [Са-ЭХЧ] – винно-красного цветаСвободная форма](/img/tmb/6/582663/6429be8929287b2961b5e99a16022fee-800x.jpg)
![КОМПЛЕКСОНО-МЕТРИЧЕСКОЕ ТИТРОВАНИЕ (КМТ) Кривые КМТ Это зависимости рМе от VТ, где pMe = -lg[Me] Кривые КМТ Это зависимости рМе от VТ, где pMe = -lg[Me] В начале титрования: [Me] = С0Ме](/img/tmb/6/582663/3f5d0fef97c2ffbdae3c3a7e5aa9981b-800x.jpg)