Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Коррозия металлов
Содержание
- 1. Коррозия металлов
- 2. План лекции Способы классификацииПоказатели коррозииМеханизм электрохимической коррозииТермодинамика электрохимической коррозииМетоды защиты металлов от коррозииВыводы
- 3. Коррозия металловСамопроизвольное разрушение металлов и сплавов вследствие
- 4. Классификация по виду коррозионной среды и условиям
- 5. Коррозия под напряжением – коррозия, вызванная одновременным
- 6. Классификация по характеру коррозионных разрушенийВиды коррозии:a -
- 7. Показатели коррозииИстинная или мгновенная дифференциальная скорость коррозии
- 8. Механизм электрохимической коррозииАнодное окисление металла: Катодное восстановление
- 9. В нейтральной и щелочной среде:В кислой среде:
- 10. Коррозия, при которой катодная реакция осуществляется с
- 11. Для электрохимических реакций свободная энергия Гиббса:Термодинамика электрохимической коррозииУсловие возможности электрохимической коррозии с водородной и кислородной деполяризацией:
- 12. Методы защиты металлов от коррозииОсновным условием противокоррозионной
- 13. Гальванические покрытияПреимущества электроосаждения перед другими методами защиты
- 14. Анодные и катодные покрытияПо отношению к стали
- 15. Электрохимическая защитаОснована на снижении скорости коррозии металлов
- 16. Электрохимическая защитаАнодная защита: при анодной защите потенциал
- 17. Энергетическая диаграмма процесса без ингибитора (1)
- 18. Примеры решения задачОпределите возможность электрохимической коррозии гальванопары
- 19. 4. Расчет потенциалов катодных процессов:5. Определение возможности коррозии:Вывод: В заданных условиях корродирует железо с кислородной деполяризацией
- 20. Выводы К окислительно-восстановительным относятся коррозионные процессы, некоторые
- 21. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2План лекции
Способы классификации
Показатели коррозии
Механизм электрохимической коррозии
Термодинамика электрохимической коррозии
Методы защиты
металлов от коррозии
Слайд 3Коррозия металлов
Самопроизвольное разрушение металлов и сплавов вследствие их взаимодействия с
окружающей средой
Классификация по механизму взаимодействия металлов с внешней средой
Химическая
коррозия – коррозия металла в средах, не проводящих электрический ток (газыО2, Сl2, HCl, SO2 CO2 и жидкая среда неэлектролитов: бром, расплавленная сера, бензол, фенол, нефть, керосин, смазочные масла)Электрохимическая коррозия характерна для сред, имеющих ионную проводимость (водные растворы кислот, щелочей, солей)
Слайд 4Классификация по виду коррозионной среды и условиям протекания
Газовая коррозия –
химическая коррозия металлов в газовой среде при минимальном содержании влаги
(не более 0,1 %) или при высоких температурах (в химической и нефтехимической промышленности).Атмосферная – коррозия металлов в атмосфере воздуха или любого влажного газа.
Подземная коррозия
Биокоррозия
Контактная коррозия
Радиационная коррозия
Коррозия внешним током и коррозия блуждающим током
Схема коррозии подземного трубопровода
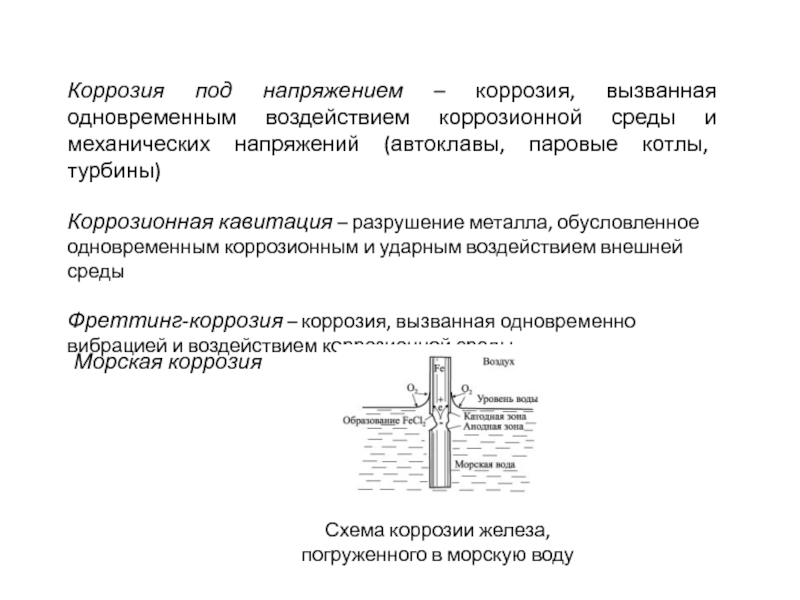
Слайд 5Коррозия под напряжением – коррозия, вызванная одновременным воздействием коррозионной среды
и механических напряжений (автоклавы, паровые котлы, турбины)
Коррозионная кавитация – разрушение
металла, обусловленное одновременным коррозионным и ударным воздействием внешней средыФреттинг-коррозия – коррозия, вызванная одновременно вибрацией и воздействием коррозионной среды
Морская коррозия
Схема коррозии железа, погруженного в морскую воду
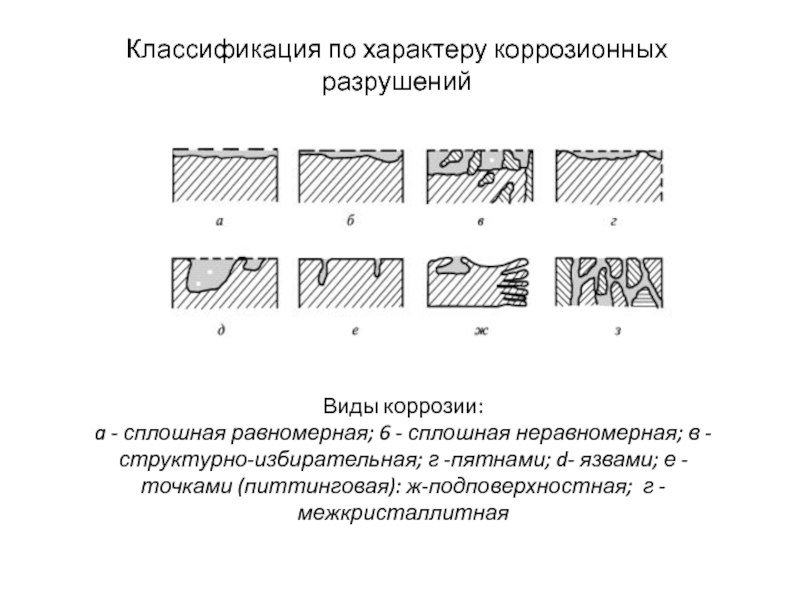
Слайд 6Классификация по характеру коррозионных разрушений
Виды коррозии:
a - сплошная равномерная; 6
- сплошная неравномерная; в -структурно-избирательная; г -пятнами; d- язвами; е
-точками (питтинговая): ж-подповерхностная; г - межкристаллитнаяСлайд 7Показатели коррозии
Истинная или мгновенная дифференциальная скорость коррозии в момент времени
t:
Средняя интегральная скорость:
где – показатель
коррозии: глубинный; изменение массы; объемный; механический и др.Глубинный показатель оценивает глубину коррозионного разрушения металла в единицу времени (например, мм/год).
Массовый показатель характеризует изменение массы (m) образца металла в результате коррозии, отнесенное к единице поверхности металла(S) и к единице времени t (г/ м2/ч):
Слайд 8Механизм электрохимической коррозии
Анодное окисление металла:
Катодное восстановление окислителя (Ох: H+,
H2O, O2, Cl- ):
Перенос электронов осуществляется на поверхности металла,
а перемещение ионов – в электролитеСлайд 9В нейтральной и щелочной среде:
В кислой среде:
Коррозия, при которой
катодная реакция сопровождается выделением H2 , называется коррозией с водородной
деполяризацией:Схема коррозии стали в растворе H2SO4 с выделением H2
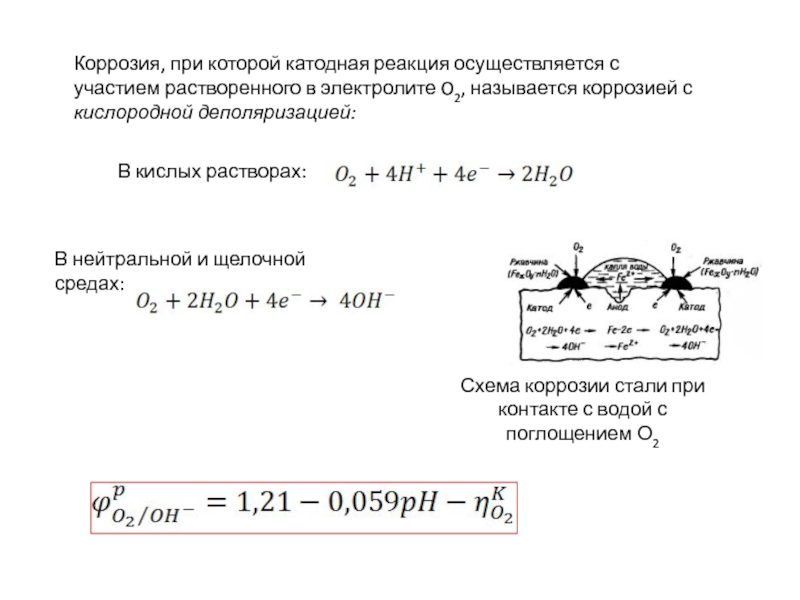
Слайд 10Коррозия, при которой катодная реакция осуществляется с участием растворенного в
электролите O2, называется коррозией с кислородной деполяризацией:
В кислых растворах:
В
нейтральной и щелочной средах:Схема коррозии стали при контакте с водой с поглощением О2
Слайд 11Для электрохимических реакций свободная энергия Гиббса:
Термодинамика электрохимической коррозии
Условие возможности электрохимической
коррозии с водородной и кислородной деполяризацией:
Слайд 12Методы защиты металлов от коррозии
Основным условием противокоррозионной защиты металлов является
уменьшение скорости коррозии. Уменьшить скорость коррозии можно:
путем подбора соответствующих
коррозионностойких сплавов;изменением состава агрессивной среды (деэарация, удаление солей из воды, вакуумирование, ингибиторная защита);
применением защитных покрытий (органические, например, лакокрасочные, и неорганические (гальванические, фосфатные);
изоляцией металла от агрессивной среды слоем более стойкого материала;
электрохимическими методами защиты (катодная, анодная).
Слайд 13Гальванические покрытия
Преимущества электроосаждения перед другими методами защиты от коррозии:
позволяет
регулировать толщину слоя;
экономно расходовать цветные металлы;
наносить покрытия из
металлов, имеющих высокую температуру плавления: Cr, Ni, Cu, Ag, Pt.Слайд 14Анодные и катодные покрытия
По отношению к стали цинковое покрытие является
анодным :
медное покрытие – катодным:
Вторичные процессы:
Слайд 15Электрохимическая защита
Основана на снижении скорости коррозии металлов путем смещения потенциала
до значений, соответствующих крайне низким скоростям растворения.
Катодная защита: Способы осуществления
катодной защиты:снижение скорости катодной реакции (деаэрация растворов, в которых протекает коррозионный процесс);
поляризация от внешнего источника тока;
создание контакта с другим материалом, имеющим в рассматриваемых условиях более отрицательный потенциал свободной коррозии (протекторная защита).
Слайд 16Электрохимическая защита
Анодная защита: при анодной защите потенциал защищаемой конструкции смещают
в положительную сторону до достижения устойчивого пассивного состояния.
Смещение потенциала коррозии
в сторону более положительных значений можно осуществлять:от внешнего источника тока (пропускание тока через защищаемый объект);
введением окислителей в раствор или введением в сплав элементов, способствующих повышению эффективности протекающего на поверхности металла катодного процесса.
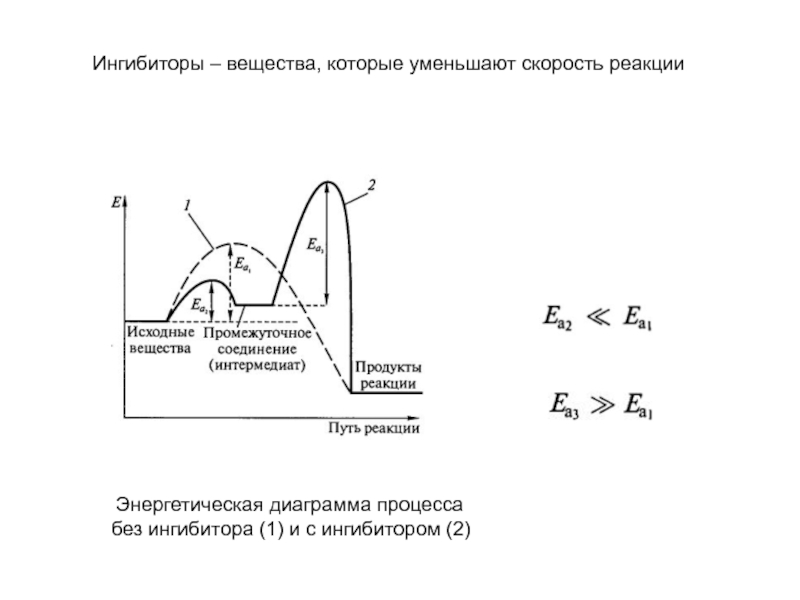
Слайд 17 Энергетическая диаграмма процесса без ингибитора (1) и с ингибитором
(2)
Ингибиторы – вещества, которые уменьшают скорость реакции
Слайд 18Примеры решения задач
Определите возможность электрохимической коррозии гальванопары Fe/Sn в среде
электролита с рН = 3 с доступом кислорода.
Решение
1. Электродные
потенциалы металлов в кислой среде:2. Определение катода и анода:
Анод – Fe; катод –Sn
3. Механизм коррозионного процесса:
Слайд 194. Расчет потенциалов катодных процессов:
5. Определение возможности коррозии:
Вывод: В заданных
условиях корродирует железо с кислородной деполяризацией
Слайд 20Выводы
К окислительно-восстановительным относятся коррозионные процессы, некоторые из них протекают
по химическому, другие по электрохимическому механизму.
Наиболее распространена электрохимическая коррозия
с поглощением кислорода и выделением водорода. На основе понимания механизма коррозии созданы и применяются различные методы защиты от коррозии.