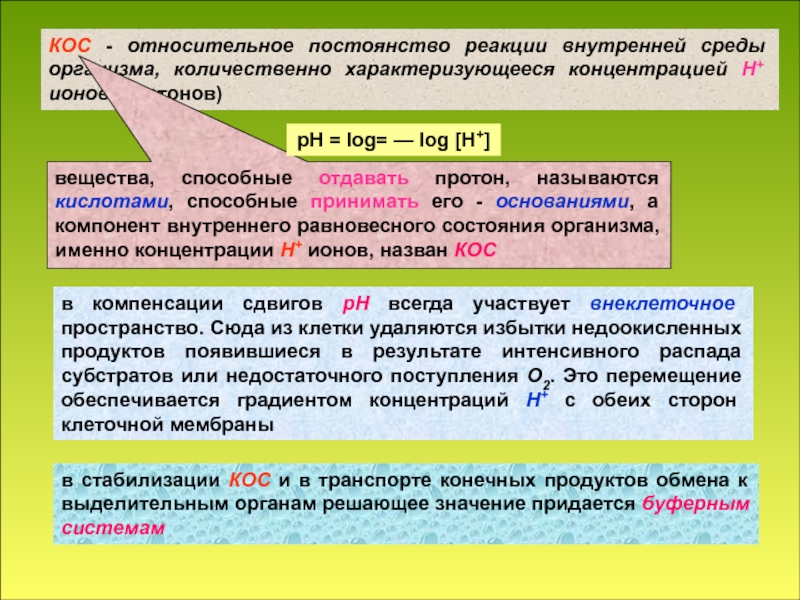
концентрацией Н+ ионов (протонов)
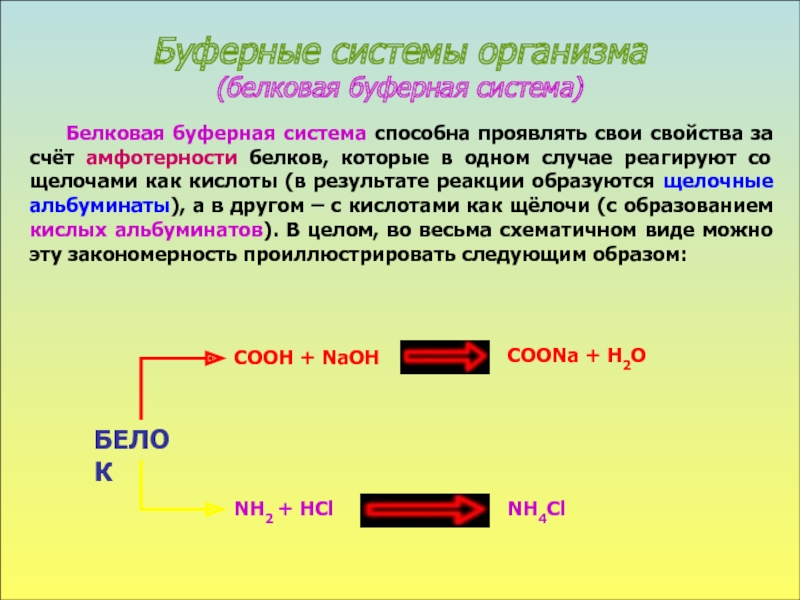
вещества, способные отдавать протон, называются кислотами, способные
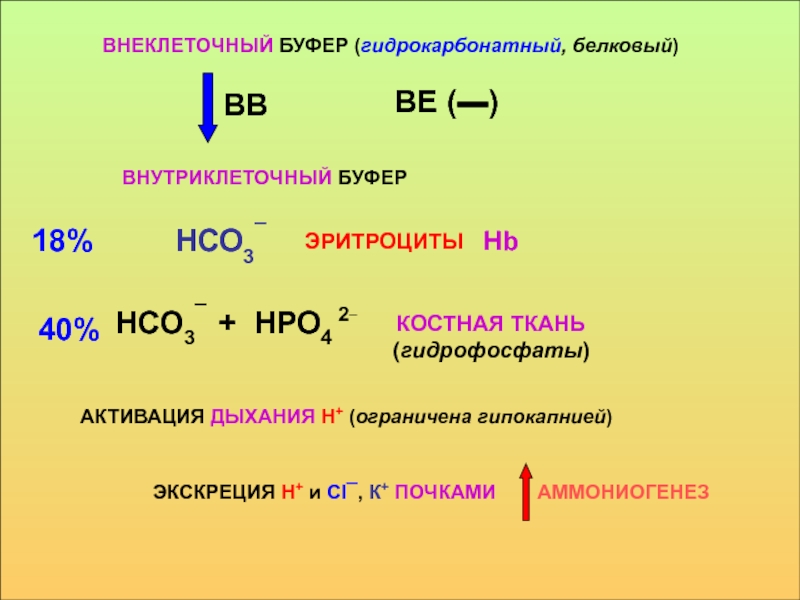
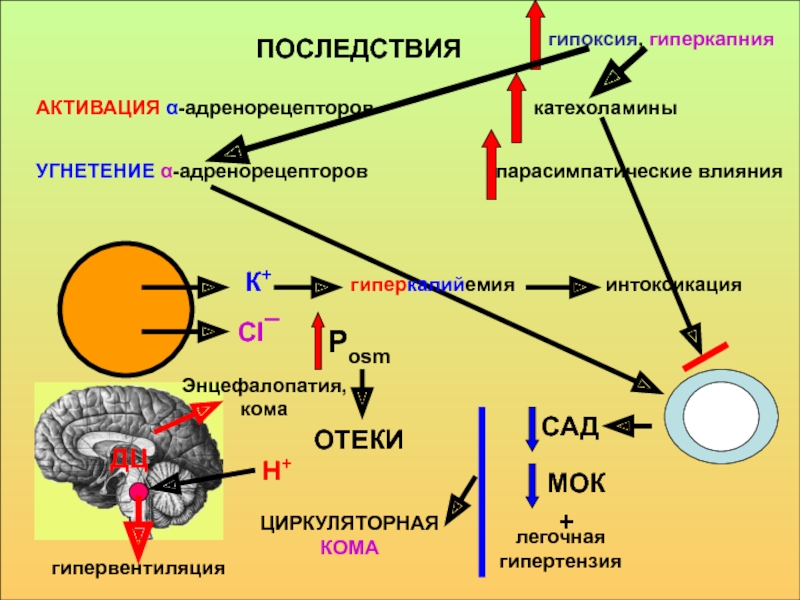
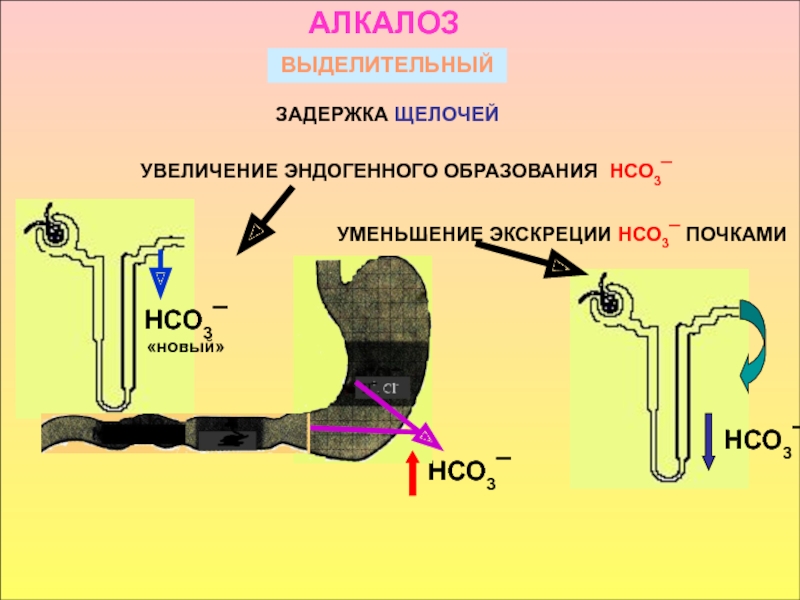
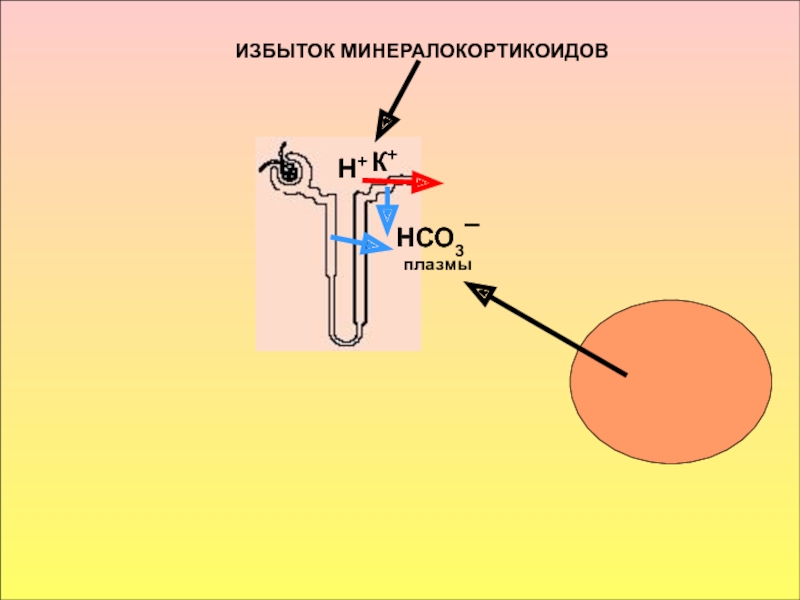
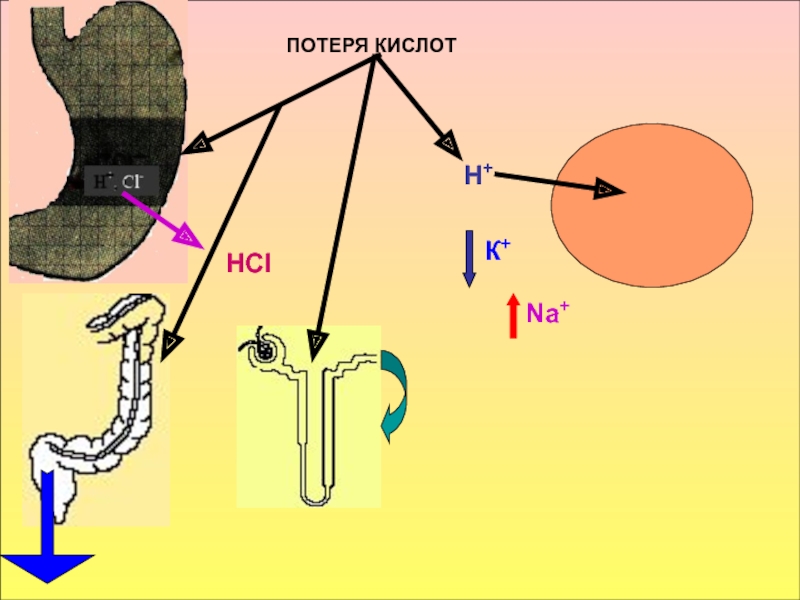
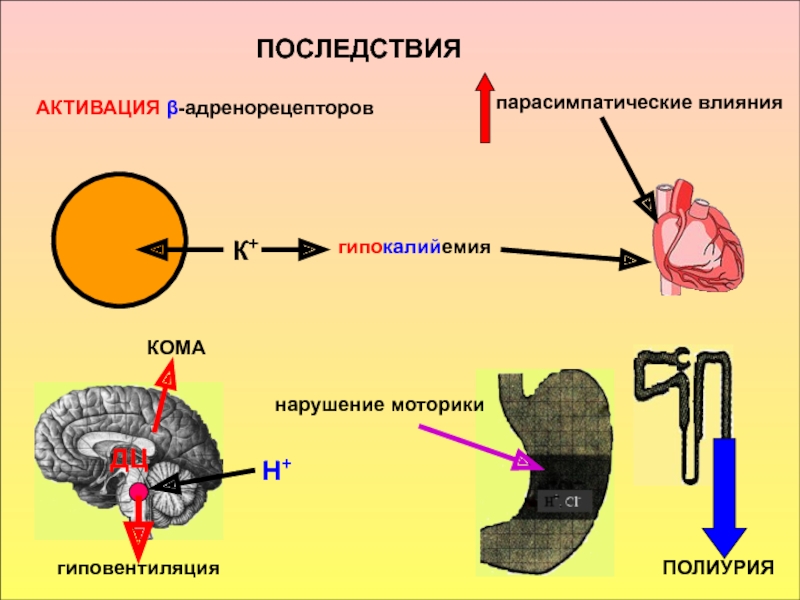
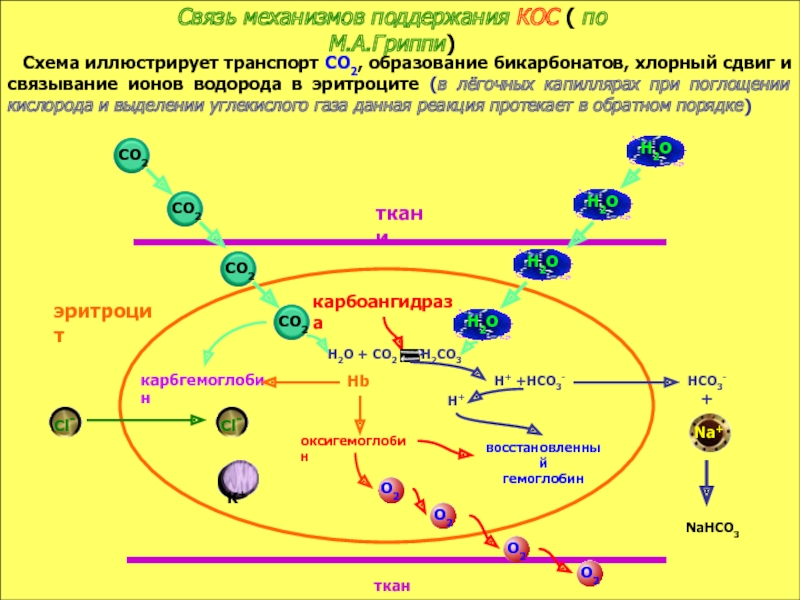
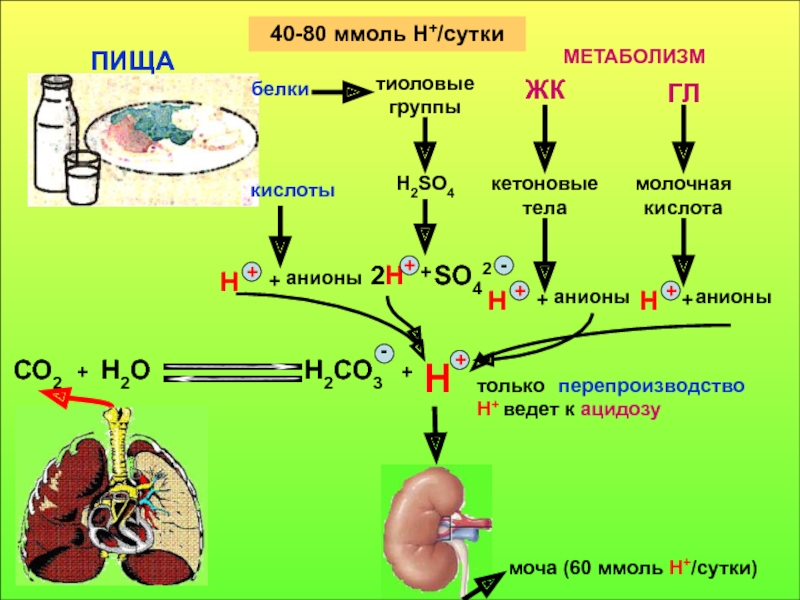
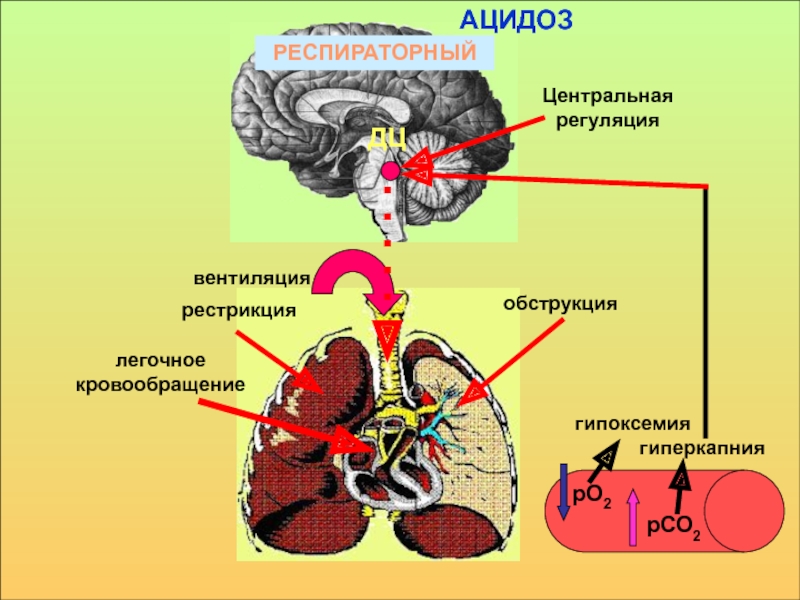
принимать его - основаниями, а компонент внутреннего равновесного состояния организма, именно концентрации Н+ ионов, назван КОСв компенсации сдвигов рН всегда участвует внеклеточное пространство. Сюда из клетки удаляются избытки недоокисленных продуктов появившиеся в результате интенсивного распада субстратов или недостаточного поступления О2. Это перемещение обеспечивается градиентом концентраций Н+ с обеих сторон клеточной мембраны
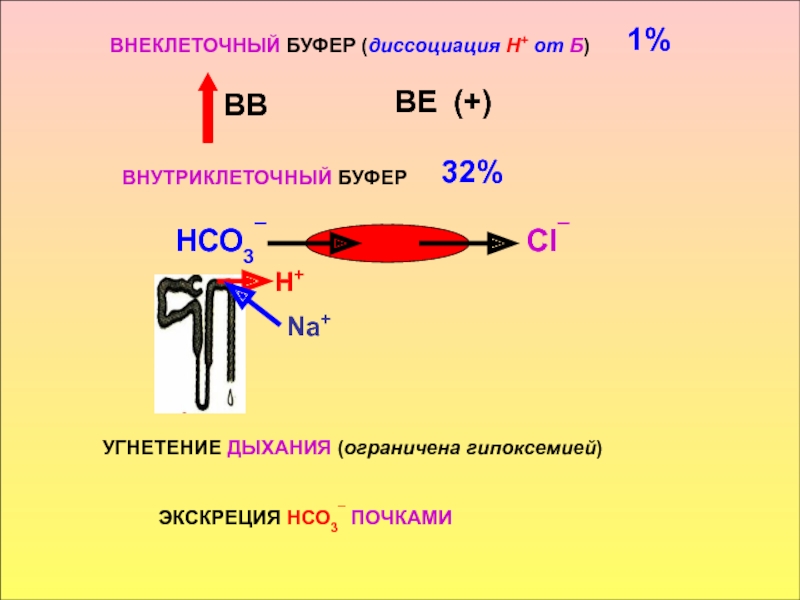
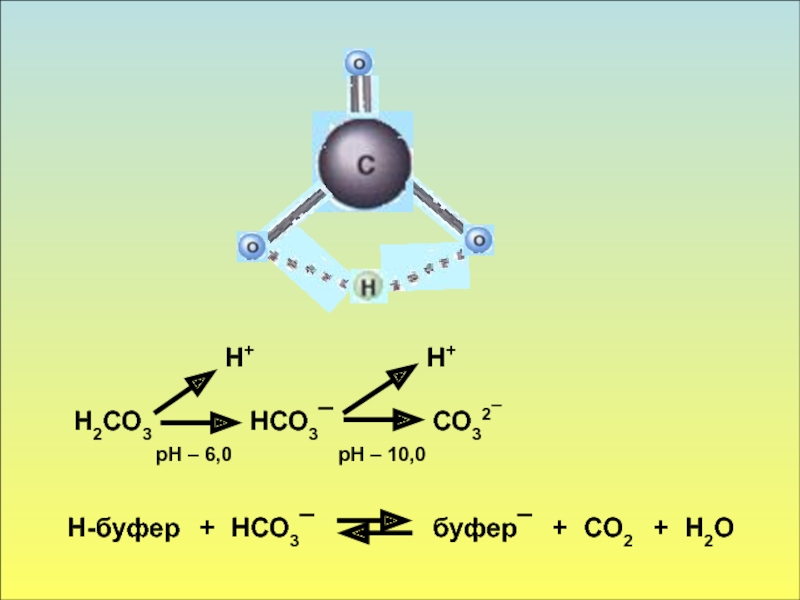
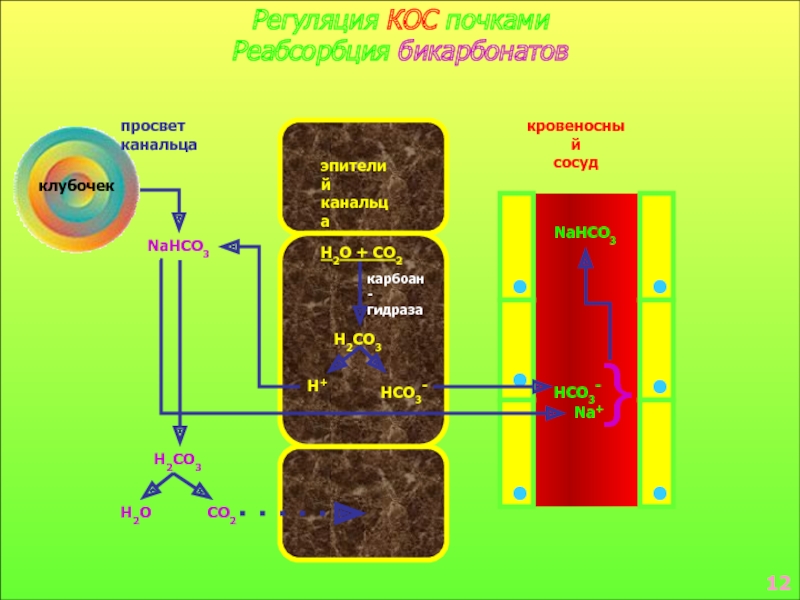
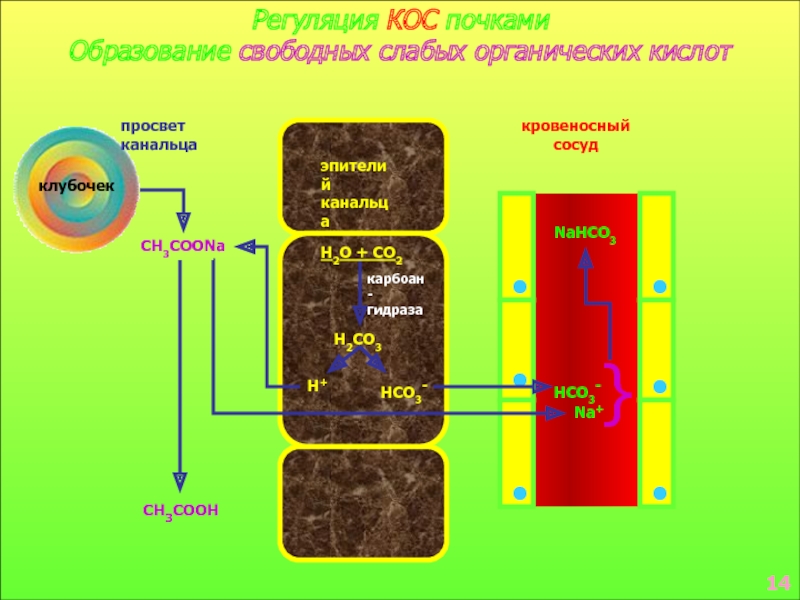
в стабилизации КОС и в транспорте конечных продуктов обмена к выделительным органам решающее значение придается буферным системам
рН = log= — log [H+]






![КОС - относительное постоянство реакции внутренней среды организма, МетаболическийМетаболическийГазовыйГазовый[HCO3][HCO3]АЦИДОЗАЦИДОЗАЛКАЛОЗАЛКАЛОЗ[HCO3][HCO3][H2CO3][H2CO3]Рсо2Рсо2 МетаболическийМетаболическийГазовыйГазовый[HCO3][HCO3]АЦИДОЗАЦИДОЗАЛКАЛОЗАЛКАЛОЗ[HCO3][HCO3][H2CO3][H2CO3]Рсо2Рсо2](/img/thumbs/1bc0fe3925f6724ec5f3d36cd6868d28-800x.jpg)


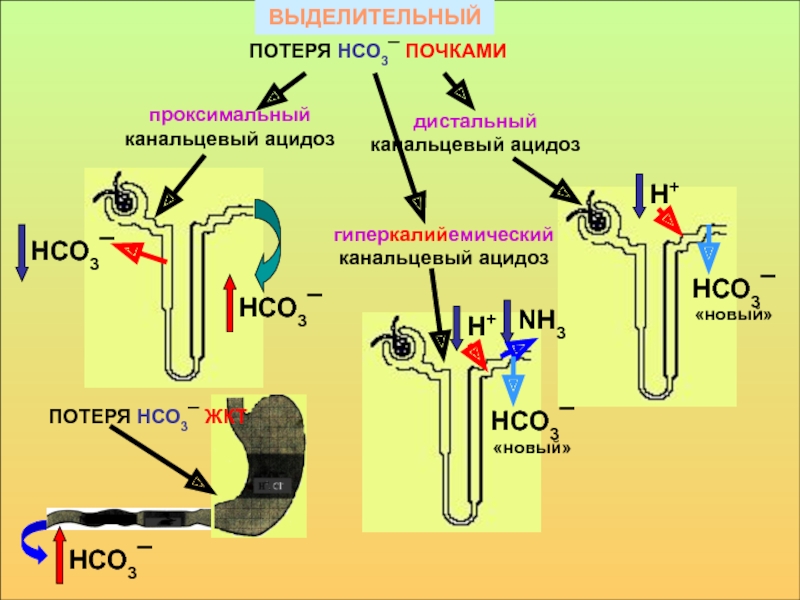
![КОС - относительное постоянство реакции внутренней среды организма, РosmNa+БН+гипоосмолярная жидкость([Na+ + [K+] — [Cl-] + [HCO3-])анионной разницыгиперосмолярная гипогидратациягиперхлоремическийНСО3¯Сl¯К+диссоциация солей РosmNa+БН+гипоосмолярная жидкость([Na+ + [K+] — [Cl-] + [HCO3-])анионной разницыгиперосмолярная гипогидратациягиперхлоремическийНСО3¯Сl¯К+диссоциация солей](/img/thumbs/3c697ae4ad7abaed9b2173d0c118db26-800x.jpg)
![КОС - относительное постоянство реакции внутренней среды организма, Компенсаторные реакции при основных формах нарушения КОСМетаболический ацидоз[НСО3][НСО3]Рсо2Рсо2Рсо2Рсо2[НСО3][НСО3]Респираторный ацидоз«Метаболический» алкалозРеспираторный алкалоз Компенсаторные реакции при основных формах нарушения КОСМетаболический ацидоз[НСО3][НСО3]Рсо2Рсо2Рсо2Рсо2[НСО3][НСО3]Респираторный ацидоз«Метаболический» алкалозРеспираторный алкалоз](/img/thumbs/44f75dc90db1f13010c1bc8f2c3daf60-800x.jpg)