Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Курс Биология опухолевой клетки (201 9 г.) Лекция 7 Способность
Содержание
- 1. Курс Биология опухолевой клетки (201 9 г.) Лекция 7 Способность
- 2. Злокачественные новообразования возникают врезультате неограниченной пролиферации клеточных
- 3. Модификация микроокружения:Деградация белков внеклеточного матрикса и внеклеточных
- 4. Приобретение способности синтезировать и секретировать протеазы обеспечивает:1)
- 5. В регуляции миграции/пролиферации клеток участвуют 3 семейства
- 6. Слайд 6
- 7. Транскрипционные факторы Рецепторы митогенов/мотогеновRas-MAPKПролиферация, подавление апоптозаЛокомоторный фенотипRac/RhoSTAT
- 8. Модификация микроокружения:Деградация белков внеклеточного матрикса Стимуляция ангиогенезаСоздание
- 9. Васкуляризация опухолей (образование кровеносных сосудов) – необходимое
- 10. Роль кровоснабжения при опухолевом ростеМалые опухоли (1–2
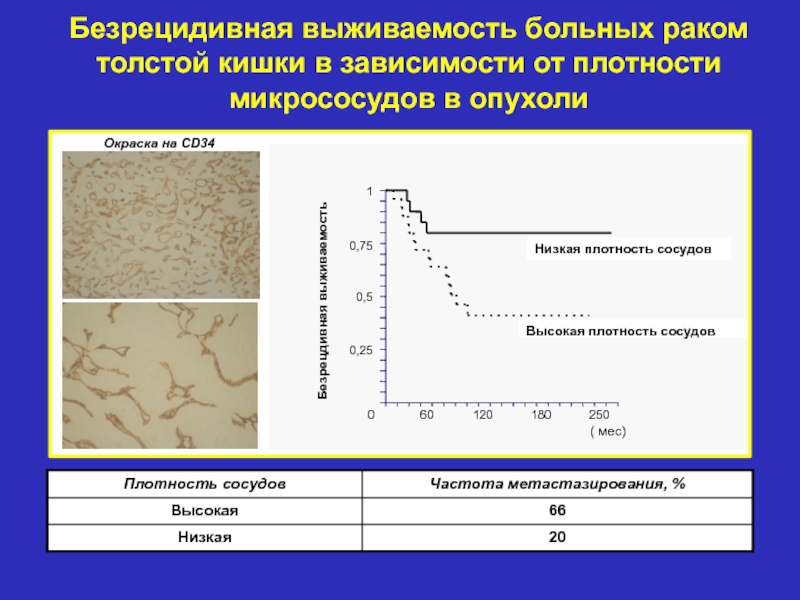
- 11. Безрецидивная выживаемость больных раком толстой кишки в зависимости от плотности микрососудов в опухоли Окраска на CD34
- 12. васкулогенеза - формирования сосудов из стволовых
- 13. Стимуляторы ангиогенеза(VEGF, bFGF, TGFα и др.)Размножение и миграцияэндотелиальных клеток мелких сосудовРегуляция ангиогенеза:Ингибиторы ангиогенеза(эндостатин, ангиостатин,тромбоспондин и др.)
- 14. Notch and VEGF signaling regulate endothelial tip
- 15. Слайд 15
- 16. Гиперэкспрессия VEGF предсказывает прогноз течения колоректального рака
- 17. Альтернативный сплайсинг регулирует образование про- и анти-ангиогенных
- 18. Figure 13.3 The Biology of Cancer (© Garland Science 2007)
- 19. Регуляция ангиогенеза
- 20. HIF-1βHIF-1αHIF-1βHIF-1αHIF-1αНормоксияГипоксияHIF-1 – ключевой регулятор реакций на гипоксиюHIF-1αVHLUbДеградацияПролил-гидроксилазаO2Пролил-гидроксилазаГены-мишениЯдроHIF-1βHIF-1αHREVEGFGLUT1LHD-ANOSEPOАнгиогенезТранспортглюкозыГликолизЭритропоэзОбразованиеоксида азота
- 21. Размножение и миграцияэндотелиальных клеток мелких сосудовГИПОКСИЯHIF-1VEGF
- 22. Keith and Simon. Hypoxia-inducible factors, stem cells,
- 23. Стимуляция ангиогенеза в опухолях:VEGF, bFGF, TGFα и
- 24. Tsp1Tsp1Tsp1эндотелиоцитэндотелиоцитПодавление апоптоза в делящихся эндотелиоцитахРазмножение и миграция эндотелиоцитовОпухолеваяклетка (эпителиальная)CD36ПротеазыПротеазыРазрушение внеклеточногоматриксаАНГИОГЕНЕЗ VEGFHIF-1Ras VEGF-R VEGFVEGFMycH202Воздействие Ras на ангиогенез:CD36
- 25. СосудОпухолевые клеткиСеть PAS/ламинин-позитивных
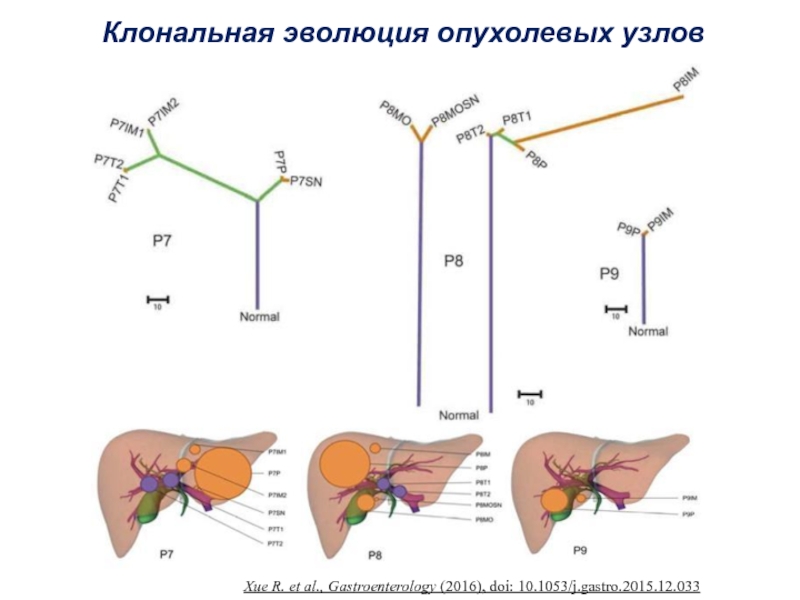
- 26. Деградация белков внеклеточного матрикса Стимуляция ангиогенезаСоздание воспалительного микроокружения: Модификация микроокружения:
- 27. Кровеносный сосудАнгиогенныефакторыРостовыефакторыОпухолевыеклеткиНейтрофилы,макрофаги и др.Активация Ras стимулирует опухолевый рост путем повышения продукции интерлейкина-8RasRafPI3KRacErkJnkAktIKKAP-1NFkBГен IL-8
- 28. Транзиторная активация Src и, вероятно, других онкогенов
- 29. АпоптозNF-kBПро-опухолевые функции NF-κBВоспалениеВыживание, пролиферация, инвазия, мутагенезG0/G1
- 30. Модификация микроокружения:Деградация белков внеклеточного матрикса Стимуляция ангиогенезаСоздание
- 31. Figure 13.15b The Biology of Cancer (© Garland Science 2007)
- 32. Figure 13.20 The Biology of Cancer (© Garland Science 2007)Стимуляция роста опухолей
- 33. Figure 13.22a The Biology of Cancer (©
- 34. Модификация микроокружения:Модификация стромы опухолей конверсия фибробластов в
- 35. МиофибробластыФибробластыTGFβ,NotchПриобретение фибробластами свойств миофибробластовосновано на индукции экспрессии
- 36. PSmad4Гены-мишениЯдроSmad2/3TGFbRIIRIPSmad2/3Smad4PSmad2/3PSmad2/3Smad4AP1,ATF2и др.Akt/PKBMAPK(Erk, Jnk, p38)p15Ink4b, p21Cip1/Waf1c-MYC,
- 37. TGFβПонижение рискавозникновения опухолейЛокомоторный фенотип (ЭМП и др.),секреция
- 38. Модификация микроокружения:Модификация стромальных фибробластов индукция продукции провоспалительных
- 39. Типы клеток микроокружения и их вклад в развитие опухолейHanahan and Coussens, Cancer Cell, 2012
- 40. Взаимодействие тромбоцитов и опухолевых клетокGay & Felding-Habermann, Nature Reviews Cancer , 2011; 11, 123-134
- 41. Tumor-Educated Platelets as Liquid Biopsy in Cancer
- 42. Внеклеточные микрочастицы (extracellular vesicles) – ещё один уровень регуляции взаимоотношений опухоли и микроокружения
- 43. Внеклеточные микрочастицы
- 44. Основные активности экзосом опухолевых клетокSun and Liu,
- 45. Влияние опухолевого микроокружения на эффективность терапииValkenburg et al., Nat Rev Clin Oncol. (2018),15:366–381
- 46. Модификация микроокружения:Деградация белков внеклеточного матрикса Стимуляция ангиогенезаСоздание воспалительного микроокруженияМодификация стромыЗащита от иммунного ответа (лекция 10)
- 47. Метастазирование – образование вторичных очагов опухолевого роста
- 48. Экстравазация может быть связана с образованием тромбапервичнаяопухольлокализованнаяинвазияинтравазациятранспортпо сосудамостановка в микрососудахразличных органовэкстравазацияобразованиемикрометастазовколонизация – образованиемакрометастазов
- 49. Различия во времени метастазирования разных типов опухолей в определенные органы
- 50. В 1889 г. английский врач Stephen Paget
- 51. Генетические изменения и контролируемые ими свойства неопластических клеток, ответственные за метастазирование (свойства «зерна»)
- 52. Особенности тканей отдаленных органов, способствующие метастазированию(свойства «почвы»)Bos
- 53. Ключевой этап метастазирования – образование в нормальных
- 54. сосудпервичнаяопухольцитокиныОбразование и рост метастазав “нише” отдаленного органахемокиныLOXфибробластысшивки
- 55. Секреция цитокина PTHLH определяет метастазирование рака молочной
- 56. Критическая роль секреции LOX (лизил-оксидазы)в формировании преметастатических
- 57. Мобилизуемые клетки костного мозга ответственны как за образование преметастатических ниш, так и за стимуляцию роста метастазов
- 58. генетическигетерогеннаяпервичнаяопухольмикрометастазымакрометастазновые микро- и макрометастазыЭволюция клонов опухолевых клеток при метастазировании2-ая волна
- 59. Клональная эволюция опухолевых узловXue R. et al., Gastroenterology (2016), doi: 10.1053/j.gastro.2015.12.033
- 60. Злокачественный ростИнвазия,метастазированиеИнтенсивное и неограниченное во времени деление
- 61. Курс «Биология опухолевой клетки»(2019 г.)Лекция 8Опухолевый супрессор р53: как один белок контролирует многие аспекты канцерогенезаН.Л. Лазаревич
- 62. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Курс «Биология опухолевой клетки»
(2019 г.)
Лекция 7
Способность неопластических клеток модифицировать микроокружение
Н.Л.
Лазаревич
Слайд 2Злокачественные новообразования возникают в
результате неограниченной пролиферации клеточных клонов, выходящих за
пределы собственной ткани и способных к росту на территориях других
тканей.Инвазивный рост, метастазирование
Нестабильность генома
(мутации и эпигенетические изменения)
Интенсивное и
неограниченное во времени деление клеток
Модификация
микроокружения
(ангиогенез и др.)
Изменения морфологии
клетки, «локомоторный» фенотип
Ускользание от иммунологического надзора
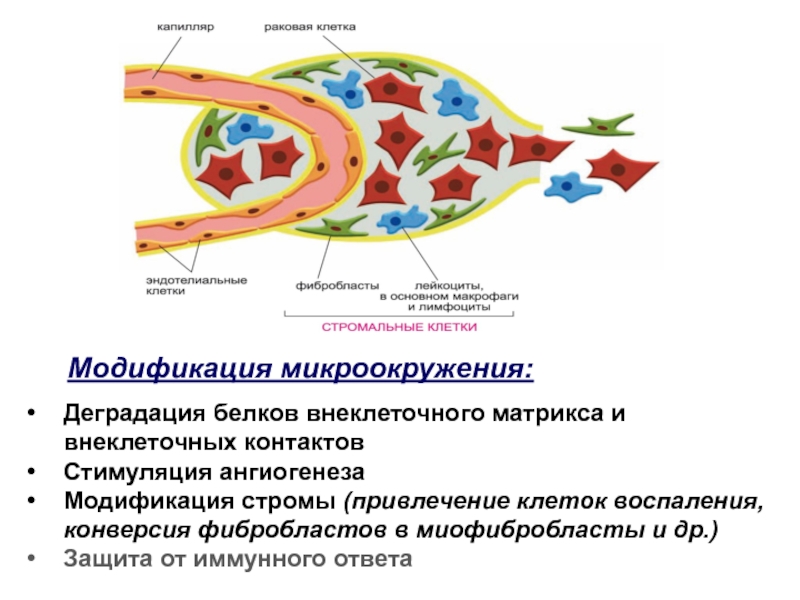
Слайд 3Модификация микроокружения:
Деградация белков внеклеточного матрикса и внеклеточных контактов
Стимуляция ангиогенеза
Модификация
стромы (привлечение клеток воспаления, конверсия фибробластов в миофибробласты и др.)
Защита от иммунного ответа
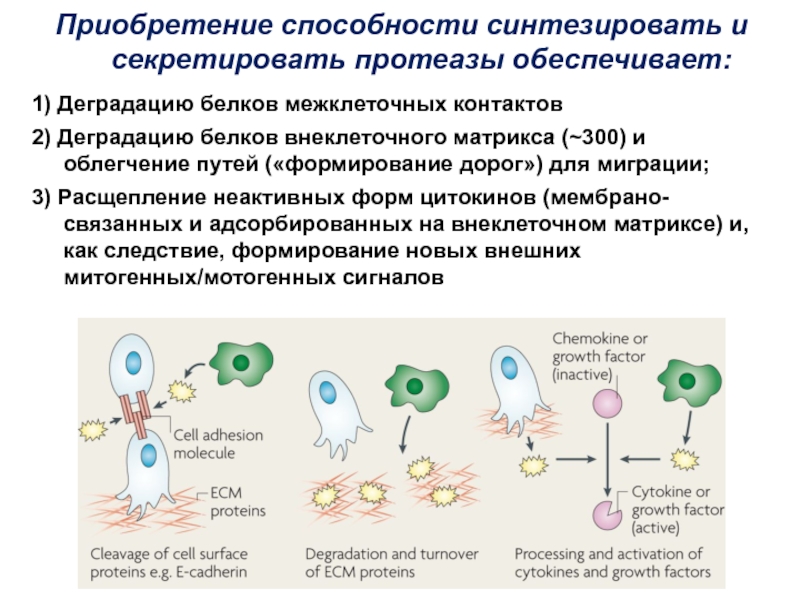
Слайд 4Приобретение способности синтезировать и секретировать протеазы обеспечивает:
1) Деградацию белков межклеточных
контактов
2) Деградацию белков внеклеточного матрикса (~300) и облегчение путей («формирование
дорог») для миграции;3) Расщепление неактивных форм цитокинов (мембрано-связанных и адсорбированных на внеклеточном матриксе) и, как следствие, формирование новых внешних митогенных/мотогенных сигналов
Слайд 5В регуляции миграции/пролиферации клеток участвуют 3 семейства протеаз:
матриксные
металлопротеазы (ММР)
(23 разных секретируемых и мембрано-связанных белка);
активаторы
плазминогена урокиназного типа (uPA); цистеинпротеазы (катепсин B и др.)
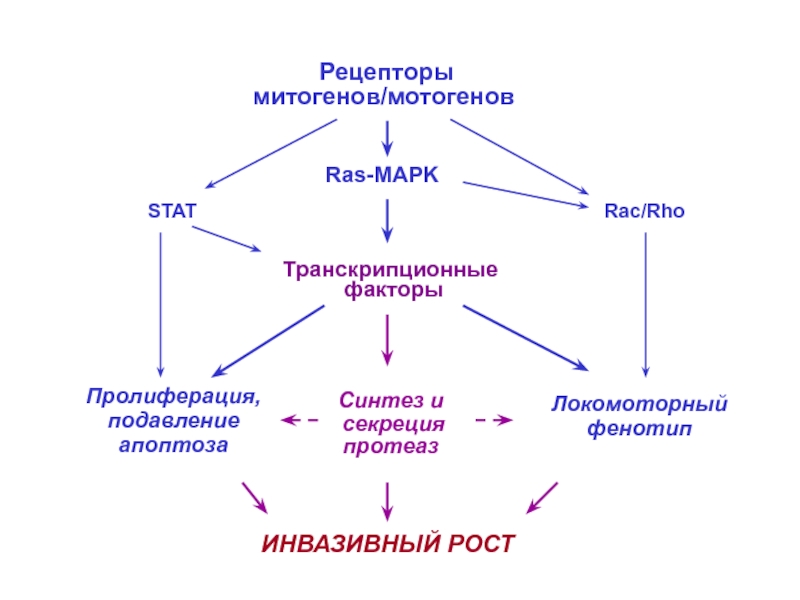
Слайд 7Транскрипционные
факторы
Рецепторы
митогенов/мотогенов
Ras-MAPK
Пролиферация, подавление апоптоза
Локомоторный
фенотип
Rac/Rho
STAT
Слайд 8Модификация микроокружения:
Деградация белков внеклеточного матрикса
Стимуляция ангиогенеза
Создание воспалительного микроокружения
Модификация стромы
Защита
от иммунного ответа путем уничтожения окружающих Fas-экспрессирующих NK/T-клеток (?)
Слайд 9Васкуляризация опухолей (образование кровеносных сосудов) – необходимое условие для дальнейшего
роста опухолевого узелка, достигшего в диаметре 2-4 мм.
Ксенографт опухоли
HCT116Окраска: CD34 + гематоксилин/эозин
Живые опухолевые
клетки
Некротические
опухолевые ткани
Сосуды
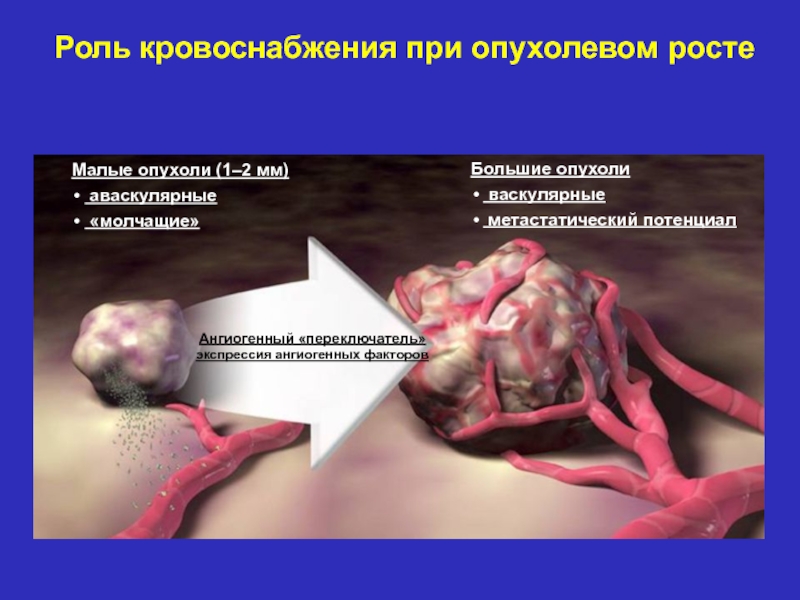
Слайд 10Роль кровоснабжения при опухолевом росте
Малые опухоли (1–2 мм)
аваскулярные
«молчащие»
Большие
опухоли
васкулярные
метастатический потенциал
Ангиогенный «переключатель»
экспрессия ангиогенных факторов
Слайд 11Безрецидивная выживаемость больных раком толстой кишки в зависимости от плотности
микрососудов в опухоли
Окраска на CD34
Слайд 12 васкулогенеза - формирования сосудов из стволовых клеток (гемангиобластов);
ангиогенеза – ветвления уже имеющихся мелких сосудов
Сосуды образуются за счет:
В опухолевых тканях сосуды формируются в основном из эндотелиальных клеток окружающих мелких сосудов, т.е. за счет ангиогенеза.
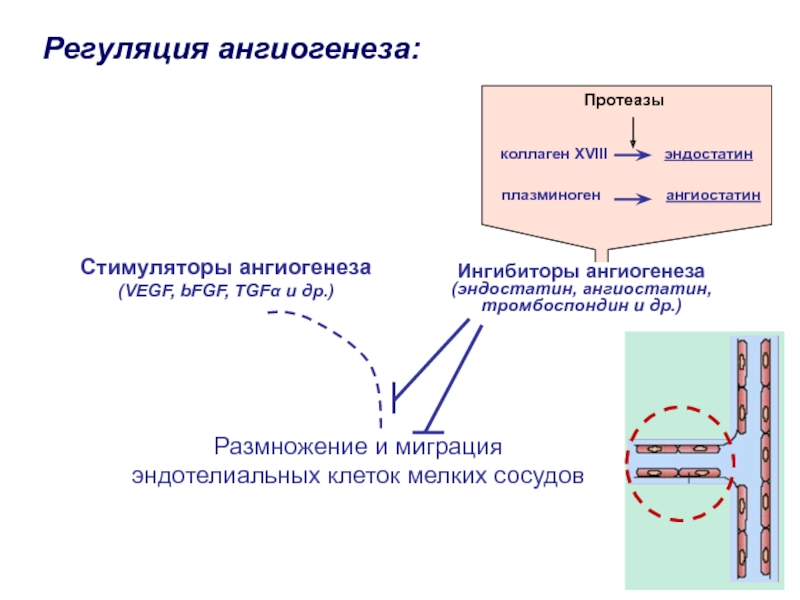
Слайд 13Стимуляторы ангиогенеза
(VEGF, bFGF, TGFα и др.)
Размножение и миграция
эндотелиальных клеток мелких
сосудов
Регуляция ангиогенеза:
Ингибиторы ангиогенеза
(эндостатин, ангиостатин,
тромбоспондин и др.)
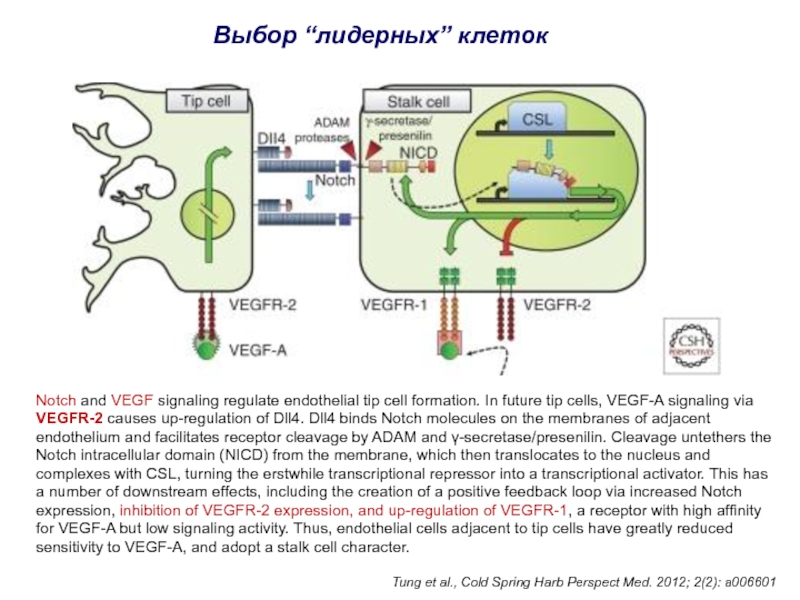
Слайд 14Notch and VEGF signaling regulate endothelial tip cell formation. In
future tip cells, VEGF-A signaling via VEGFR-2 causes up-regulation of
Dll4. Dll4 binds Notch molecules on the membranes of adjacent endothelium and facilitates receptor cleavage by ADAM and γ-secretase/presenilin. Cleavage untethers the Notch intracellular domain (NICD) from the membrane, which then translocates to the nucleus and complexes with CSL, turning the erstwhile transcriptional repressor into a transcriptional activator. This has a number of downstream effects, including the creation of a positive feedback loop via increased Notch expression, inhibition of VEGFR-2 expression, and up-regulation of VEGFR-1, a receptor with high affinity for VEGF-A but low signaling activity. Thus, endothelial cells adjacent to tip cells have greatly reduced sensitivity to VEGF-A, and adopt a stalk cell character.Tung et al., Cold Spring Harb Perspect Med. 2012; 2(2): a006601
Выбор “лидерных” клеток
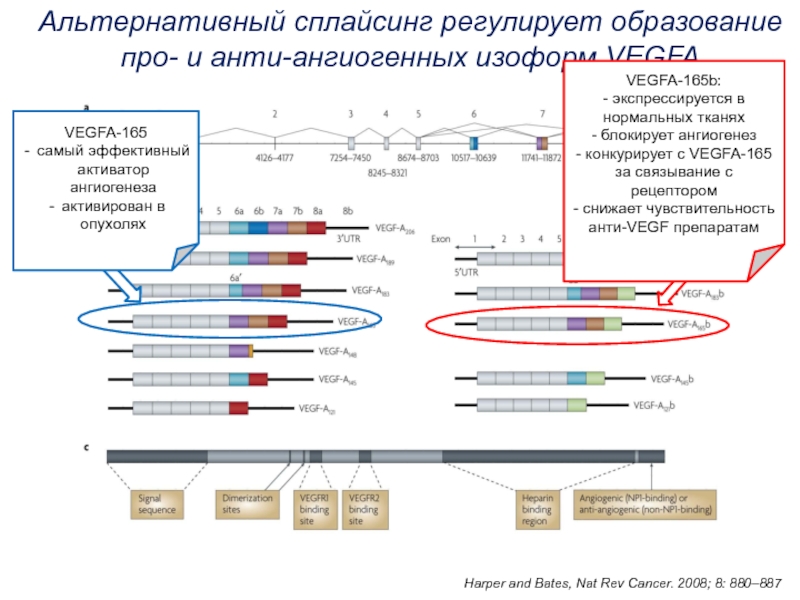
Слайд 17Альтернативный сплайсинг регулирует образование про- и анти-ангиогенных изоформ VEGFA
Harper and
Bates, Nat Rev Cancer. 2008; 8: 880–887
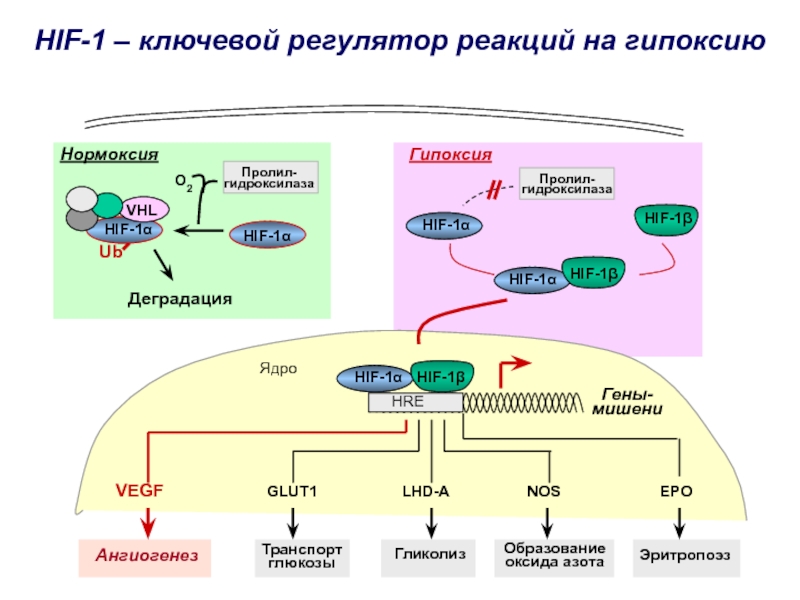
Слайд 20HIF-1β
HIF-1α
HIF-1β
HIF-1α
HIF-1α
Нормоксия
Гипоксия
HIF-1 – ключевой регулятор реакций на гипоксию
HIF-1α
VHL
Ub
Деградация
Пролил-
гидроксилаза
O2
Пролил-
гидроксилаза
Гены-
мишени
Ядро
HIF-1β
HIF-1α
HRE
VEGF
GLUT1
LHD-A
NOS
EPO
Ангиогенез
Транспорт
глюкозы
Гликолиз
Эритропоэз
Образование
оксида азота
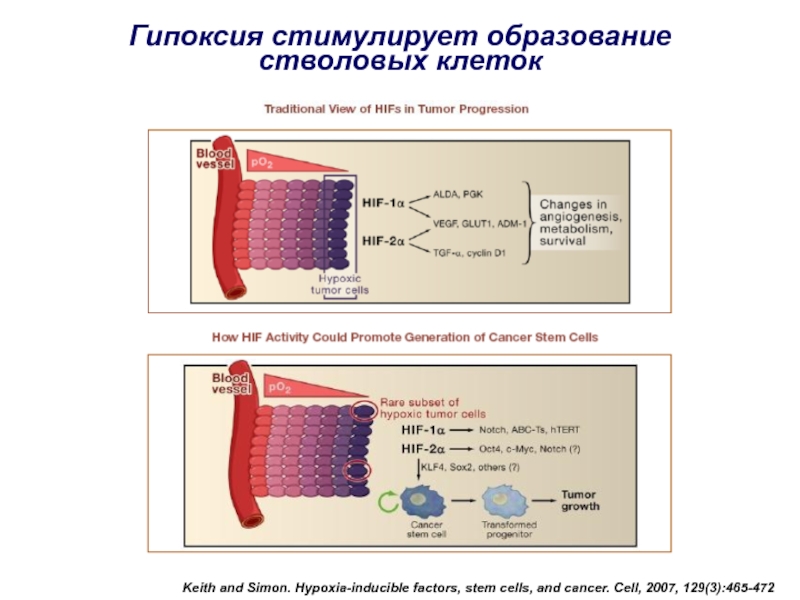
Слайд 22Keith and Simon. Hypoxia-inducible factors, stem cells, and cancer. Cell,
2007, 129(3):465-472
Гипоксия стимулирует образование
стволовых клеток
Слайд 23Стимуляция ангиогенеза в опухолях:
VEGF, bFGF,
TGFα и др.
тромбоспондин, ангиостатин,
эндостатин и
др.
Гипоксия,
умеренное повышение уровня кислородных радикалов,
активация HIF1, инактивация р53,
экспрессия Rasи др.
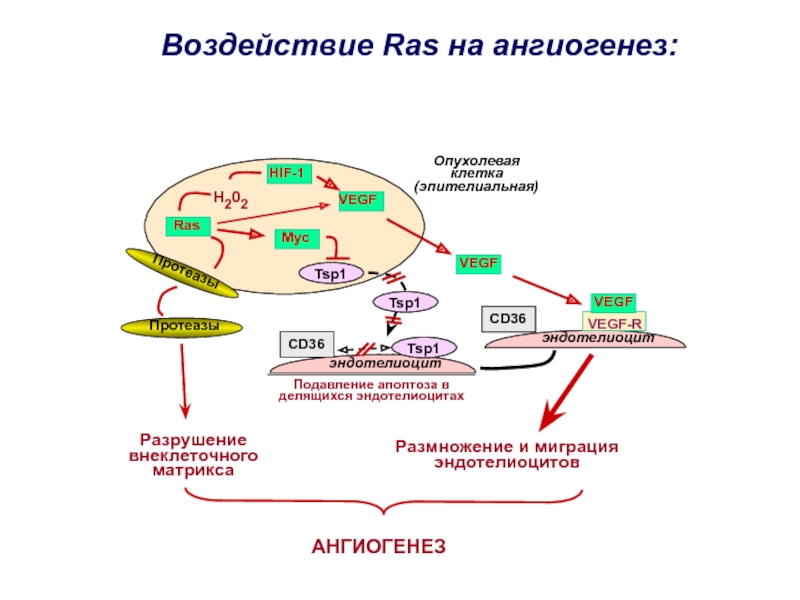
Слайд 24Tsp1
Tsp1
Tsp1
эндотелиоцит
эндотелиоцит
Подавление апоптоза в делящихся эндотелиоцитах
Размножение и миграция эндотелиоцитов
Опухолевая
клетка (эпителиальная)
CD36
Протеазы
Протеазы
Разрушение
внеклеточного
матрикса
АНГИОГЕНЕЗ
VEGF
HIF-1
Ras
VEGF-R
VEGF
VEGF
Myc
H202
Воздействие Ras на ангиогенез:
CD36
Слайд 25Сосуд
Опухолевые
клетки
Сеть PAS/ламинин-позитивных
трубчатых структур
Кровоснабжение
опухолей обеспечивается также васкулогенной
мимикрией – способностью неопластических клеток формировать
сеть каналов,
соединяющихся с кровеносными сосудамиСинтез VE-кадгерина
и др. маркеров
эндотелиальных клеток
Слайд 26Деградация белков внеклеточного матрикса
Стимуляция ангиогенеза
Создание воспалительного микроокружения:
Модификация микроокружения:
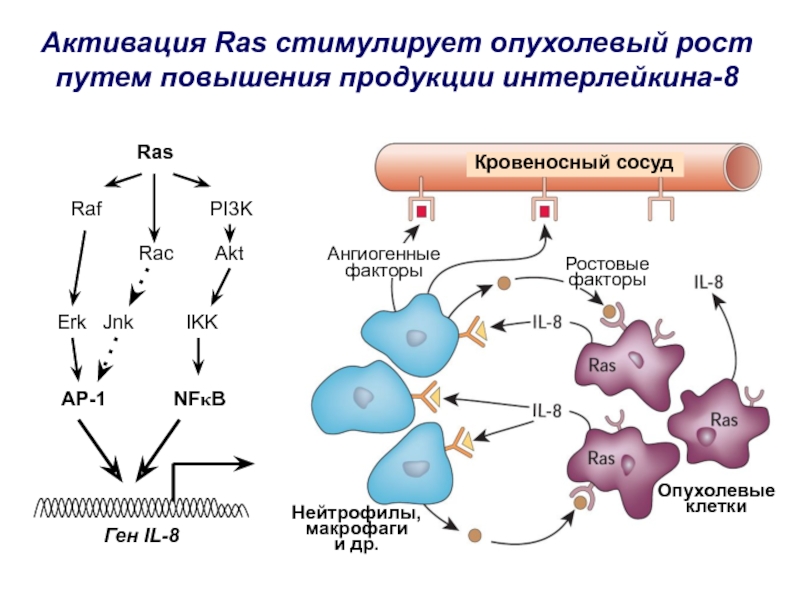
Слайд 27Кровеносный сосуд
Ангиогенные
факторы
Ростовые
факторы
Опухолевые
клетки
Нейтрофилы,
макрофаги
и др.
Активация Ras стимулирует опухолевый рост путем повышения
продукции интерлейкина-8
Ras
Raf
PI3K
Rac
Erk
Jnk
Akt
IKK
AP-1
NFkB
Ген IL-8
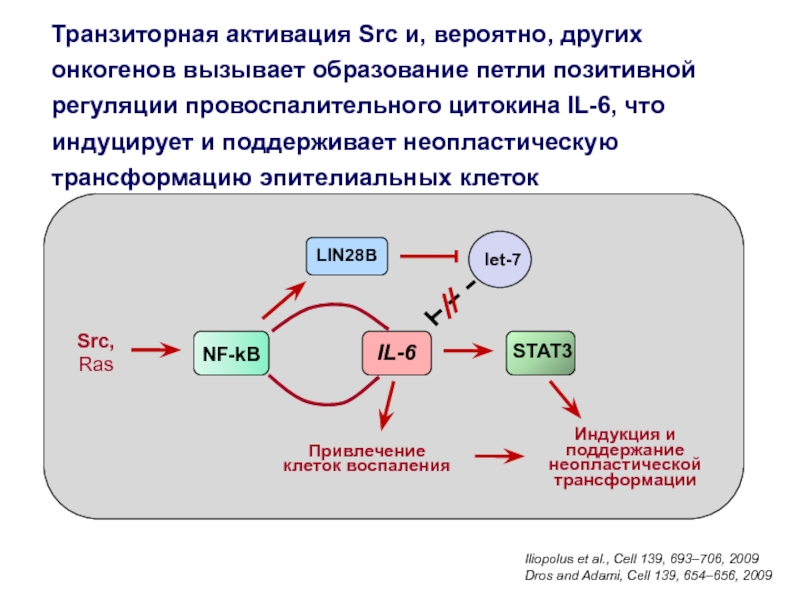
Слайд 28Транзиторная активация Src и, вероятно, других онкогенов вызывает образование петли
позитивной регуляции провоспалительного цитокина IL-6, что индуцирует и поддерживает неопластическую
трансформацию эпителиальных клетокIliopolus et al., Cell 139, 693–706, 2009
Dros and Adami, Cell 139, 654–656, 2009
Src,
Ras
NF-kB
IL-6
LIN28B
let-7
STAT3
Привлечение
клеток воспаления
Индукция и
поддержание
неопластической
трансформации
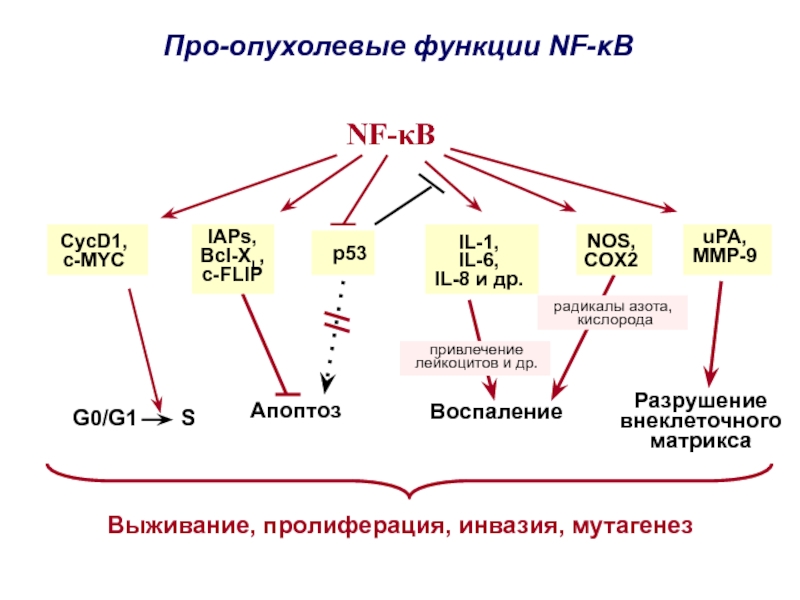
Слайд 29Апоптоз
NF-kB
Про-опухолевые функции NF-κB
Воспаление
Выживание, пролиферация, инвазия, мутагенез
G0/G1 S
радикалы
азота,
кислорода
привлечение
лейкоцитов и др.
р53
CycD1,
c-MYC
NOS,
COX2
IAPs,
Bcl-XL,
c-FLIP
IL-1,
IL-6,
IL-8 и др.
uPA,
MMP-9
Разрушение
внеклеточного
матрикса
Слайд 30Модификация микроокружения:
Деградация белков внеклеточного матрикса
Стимуляция ангиогенеза
Создание воспалительного микроокружения
Модификация стромы
- опухоль-ассоциированные фибробласты (CAFs)
- мезенхимальные стромальные клетки из костного мозга (MSC)Защита от иммунного ответа
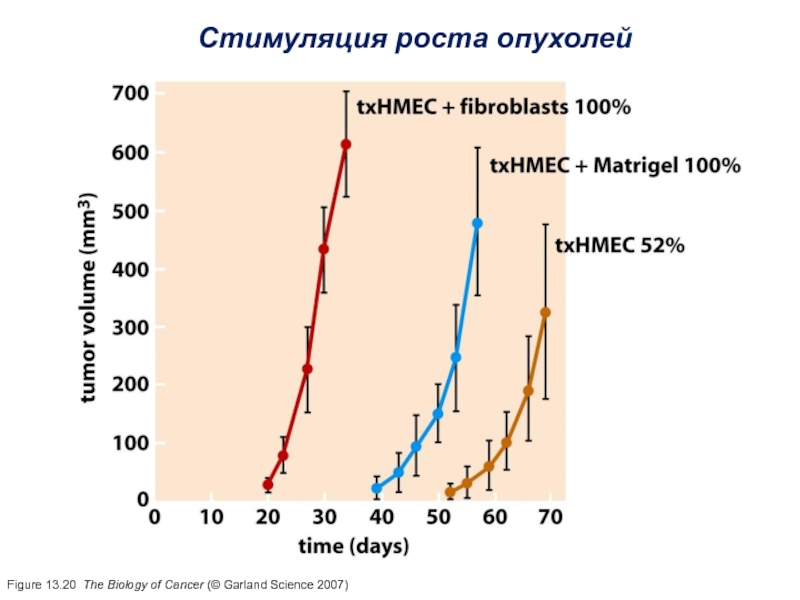
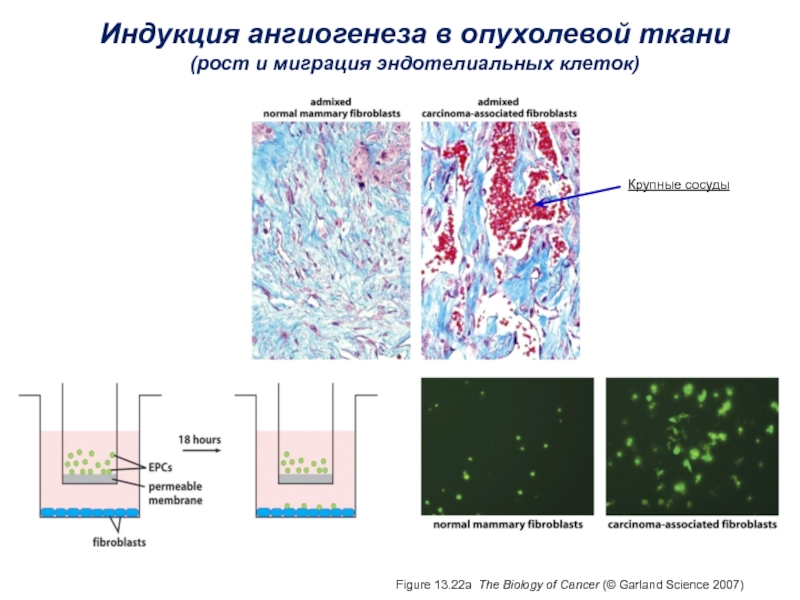
Слайд 33Figure 13.22a The Biology of Cancer (© Garland Science 2007)
Индукция
ангиогенеза в опухолевой ткани
(рост и миграция эндотелиальных клеток)
Крупные сосуды
Слайд 34Модификация микроокружения:
Модификация стромы опухолей
конверсия фибробластов в миофибробласты, (стимуляция пролиферации
и инвазии опухоли)
индукция продукции провоспалительных хемокинов
Привлечение в опухоль из костного мозга мезенхимальных стволовых клеток, секретирующих хемокины (CCL5), увеличивающие способность раковых клеток мигрировать и образовывать метастазы.
Karnoub et. al., Nature, 2007; v.449, pp. 557-563
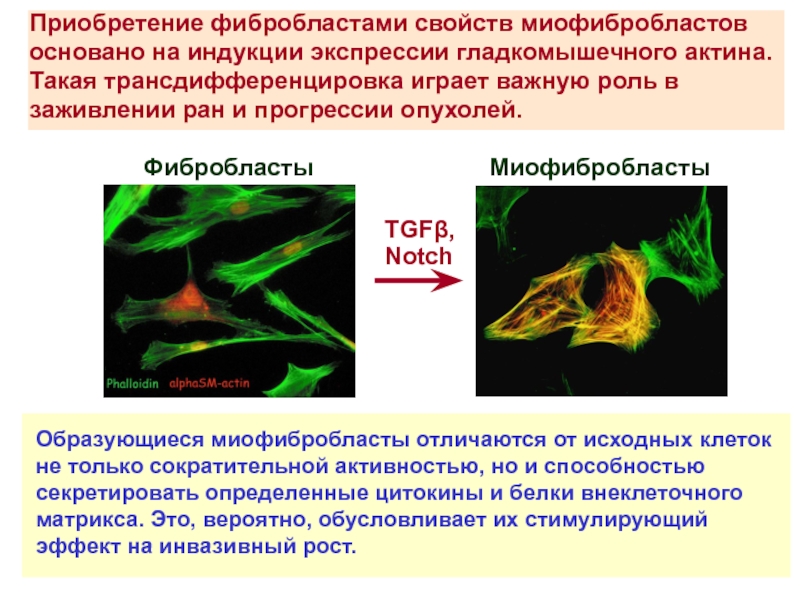
Слайд 35Миофибробласты
Фибробласты
TGFβ,
Notch
Приобретение фибробластами свойств миофибробластов
основано на индукции экспрессии гладкомышечного актина. Такая
трансдифференцировка играет важную роль в заживлении ран и прогрессии опухолей.
Образующиеся
миофибробласты отличаются от исходных клеток не только сократительной активностью, но и способностью секретировать определенные цитокины и белки внеклеточного матрикса. Это, вероятно, обусловливает их стимулирующий эффект на инвазивный рост.Слайд 36P
Smad4
Гены-
мишени
Ядро
Smad2/3
TGFb
RII
RI
P
Smad2/3
Smad4
P
Smad2/3
P
Smad2/3
Smad4
AP1,
ATF2
и др.
Akt/PKB
MAPK
(Erk, Jnk, p38)
p15Ink4b, p21Cip1/Waf1
c-MYC, Id2
и др.
Snail, ( E-кадгерин),
Rho
VEGF, MMP3, MMP9 и
др.TGFb
RII
RI
Слайд 37TGFβ
Понижение риска
возникновения опухолей
Локомоторный фенотип (ЭМП и др.),
секреция металлопротеаз
образование миофибробластов
Подавление
размножения
Massaque. TGFb in cancer. Cell, 2008, 134:215-230
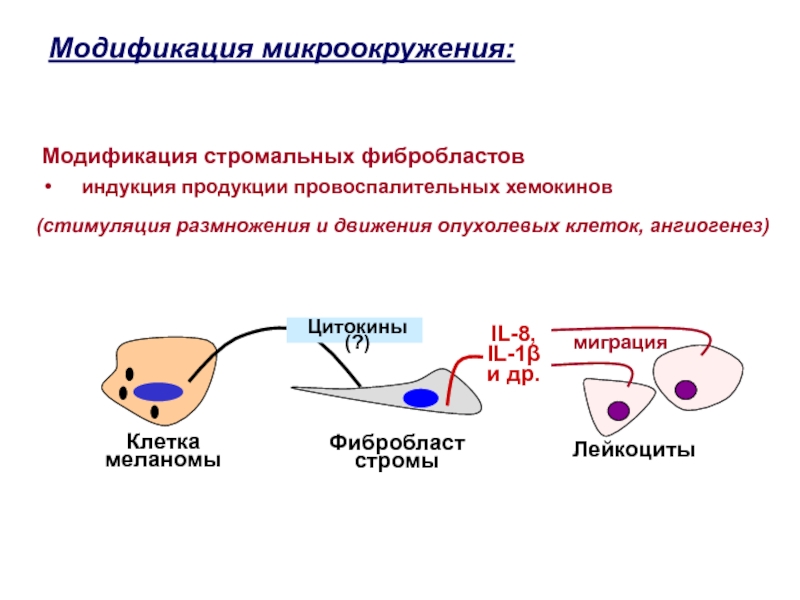
Слайд 38Модификация микроокружения:
Модификация стромальных фибробластов
индукция продукции провоспалительных хемокинов
Клетка
меланомы
Фибробласт
стромы
Лейкоциты
IL-8,
IL-1β и др.
миграция
(стимуляция размножения и движения опухолевых клеток, ангиогенез)
Цитокины
(?)
Слайд 39Типы клеток микроокружения
и их вклад в развитие опухолей
Hanahan and
Coussens, Cancer Cell, 2012
Слайд 40Взаимодействие тромбоцитов и опухолевых клеток
Gay & Felding-Habermann, Nature Reviews Cancer
, 2011; 11, 123-134
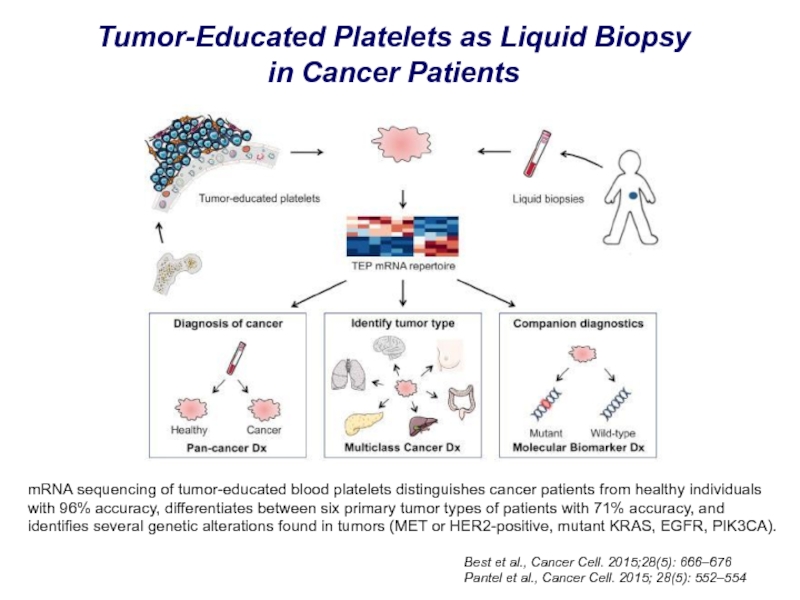
Слайд 41Tumor-Educated Platelets as Liquid Biopsy
in Cancer Patients
mRNA sequencing of tumor-educated
blood platelets distinguishes cancer patients from healthy individuals with 96%
accuracy, differentiates between six primary tumor types of patients with 71% accuracy, and identifies several genetic alterations found in tumors (MET or HER2-positive, mutant KRAS, EGFR, PIK3CA).Best et al., Cancer Cell. 2015;28(5): 666–676
Pantel et al., Cancer Cell. 2015; 28(5): 552–554
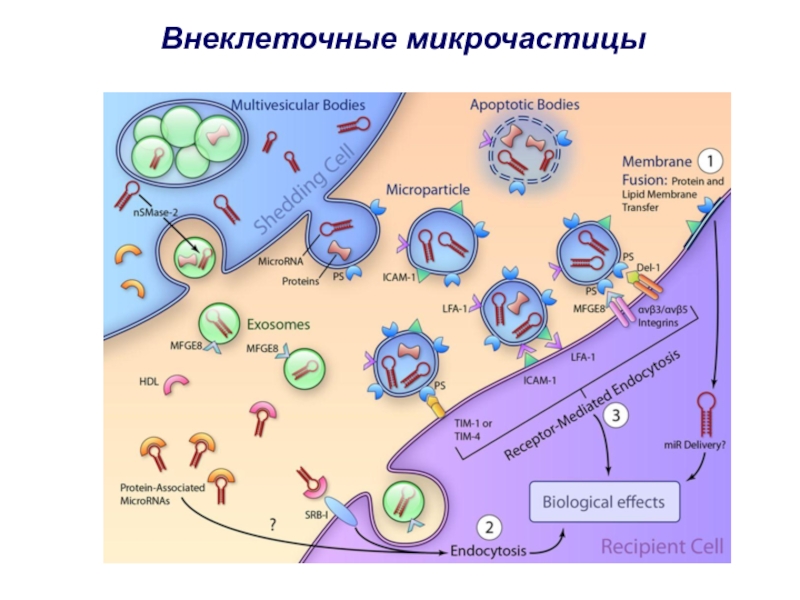
Слайд 42Внеклеточные микрочастицы (extracellular vesicles) – ещё один уровень регуляции взаимоотношений
опухоли и микроокружения
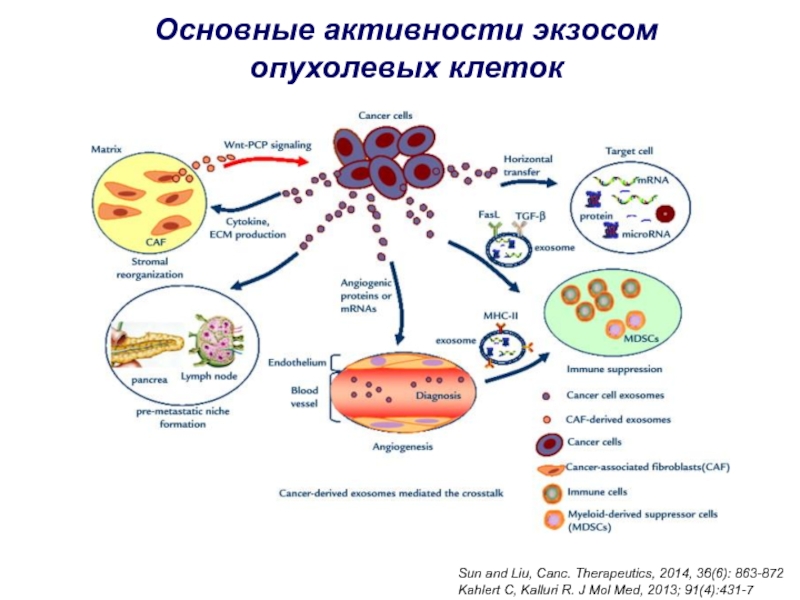
Слайд 44Основные активности экзосом опухолевых клеток
Sun and Liu, Canc. Therapeutics, 2014,
36(6): 863-872
Kahlert C, Kalluri R. J Mol Med, 2013; 91(4):431-7
Слайд 45Влияние опухолевого микроокружения на эффективность терапии
Valkenburg et al., Nat Rev
Clin Oncol. (2018),15:366–381
Слайд 46Модификация микроокружения:
Деградация белков внеклеточного матрикса
Стимуляция ангиогенеза
Создание воспалительного микроокружения
Модификация стромы
Защита
от иммунного ответа (лекция 10)
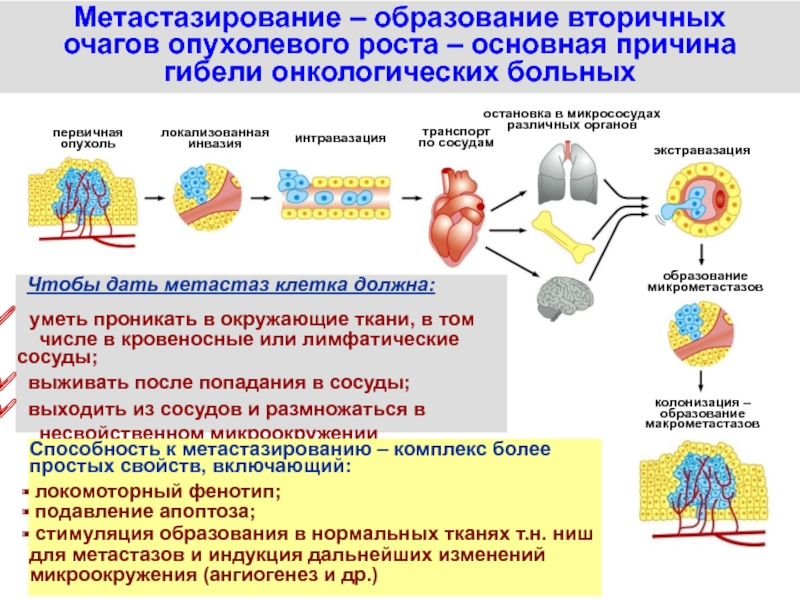
Слайд 47Метастазирование – образование вторичных
очагов опухолевого роста – основная причина
гибели
онкологических больных
Чтобы дать метастаз клетка должна:
уметь проникать в окружающие
ткани, в том числе в кровеносные или лимфатические сосуды;
выживать после попадания в сосуды;
выходить из сосудов и размножаться в
несвойственном микроокружении
первичная
опухоль
локализованная
инвазия
интравазация
транспорт
по сосудам
остановка в микрососудах
различных органов
экстравазация
образование
микрометастазов
колонизация –
образование
макрометастазов
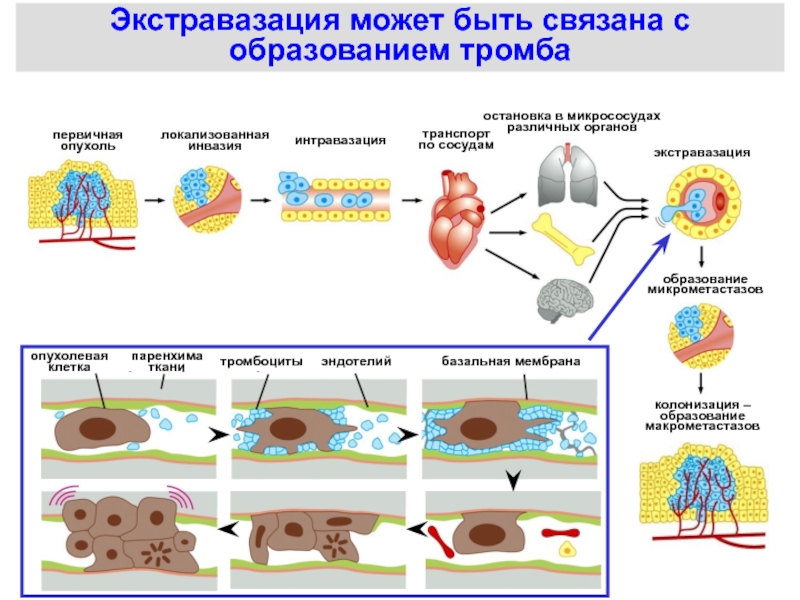
Слайд 48Экстравазация может быть связана с образованием тромба
первичная
опухоль
локализованная
инвазия
интравазация
транспорт
по сосудам
остановка в микрососудах
различных
органов
экстравазация
образование
микрометастазов
колонизация –
образование
макрометастазов
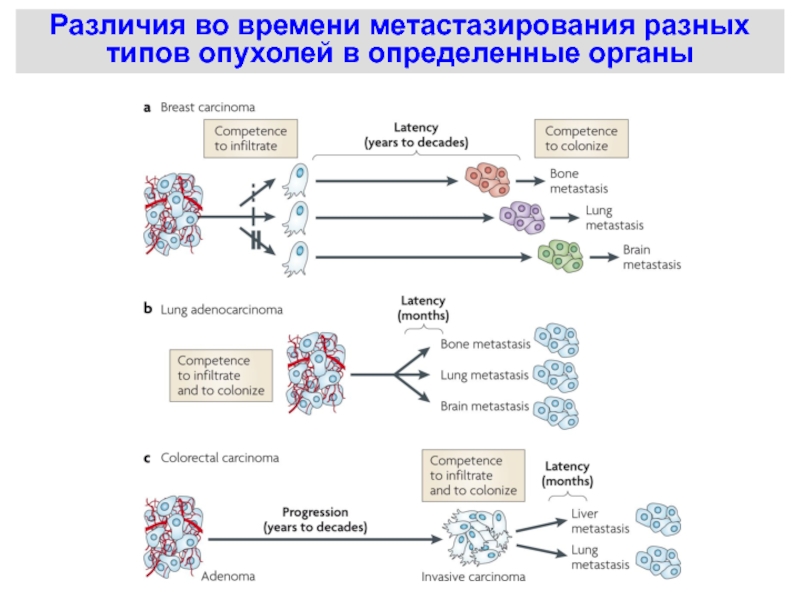
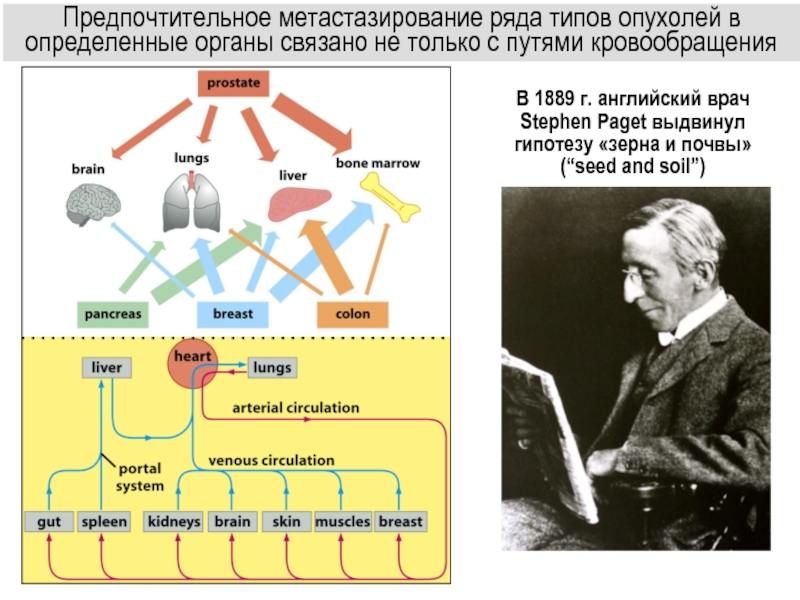
Слайд 50В 1889 г. английский врач Stephen Paget выдвинул гипотезу «зерна
и почвы»
(“seed and soil”)
Предпочтительное метастазирование ряда типов опухолей в определенные
органы связано не только с путями кровообращенияСлайд 51Генетические изменения и контролируемые ими свойства неопластических клеток, ответственные за
метастазирование (свойства «зерна»)
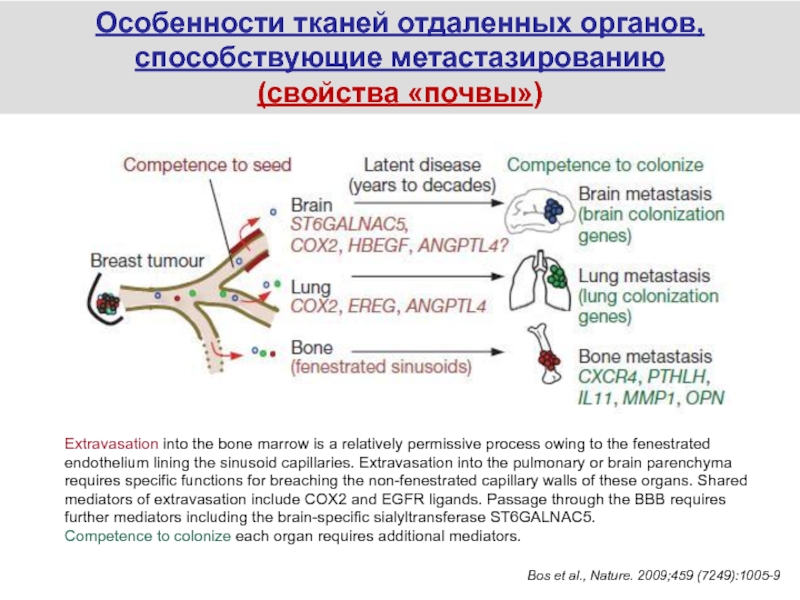
Слайд 52Особенности тканей отдаленных органов, способствующие метастазированию
(свойства «почвы»)
Bos et al., Nature.
2009;459 (7249):1005-9
Extravasation into the bone marrow is a relatively permissive
process owing to the fenestrated endothelium lining the sinusoid capillaries. Extravasation into the pulmonary or brain parenchyma requires specific functions for breaching the non-fenestrated capillary walls of these organs. Shared mediators of extravasation include COX2 and EGFR ligands. Passage through the BBB requires further mediators including the brain-specific sialyltransferase ST6GALNAC5. Competence to colonize each organ requires additional mediators.
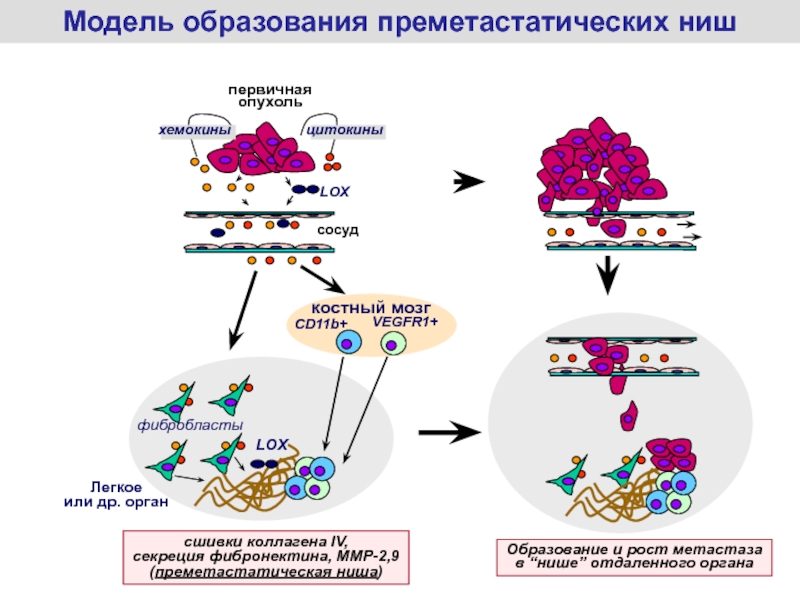
Слайд 53Ключевой этап метастазирования –
образование в нормальных тканях «ниш», привлекающих
опухолевые клетки и стимулирующих их дальнейшее размножение
(Kaplan et al., Nature,
2005, v.438, p.820-827;Hiratsuka et al., Nature Cell Biol., 2006, v. 8, 1369-1375)
Модификация тканей отдаленных органов, способствующих метастазированию
(изменения «почвы»)
Слайд 54сосуд
первичная
опухоль
цитокины
Образование и рост метастаза
в “нише” отдаленного органа
хемокины
LOX
фибробласты
сшивки коллагена IV,
секреция фибронектина,
MMP-2,9
(преметастатическая ниша)
LOX
Легкое
или др. орган
костный мозг
VEGFR1+
CD11b+
Модель образования преметастатических ниш
Слайд 55Секреция цитокина PTHLH определяет метастазирование рака молочной железы в кости
PTHLH
(Parathyroid
Hormone Related Protein)
Эпителий молочной
железы беременных
или клетки опухоли
1) Экспрессия PTHLH
в клетках рака молочной железы человека коррелирует с их метастазированием в кости (белок экспрессируют 50-60% первичных раков, 95-98% метастазов в костях, 10-15% других метастазов); 2) Нейтрализующие антитела к PTHLH ингибируют метастазирование PTHLH-позитивных ксенографтов рака молочной железы человека в кости
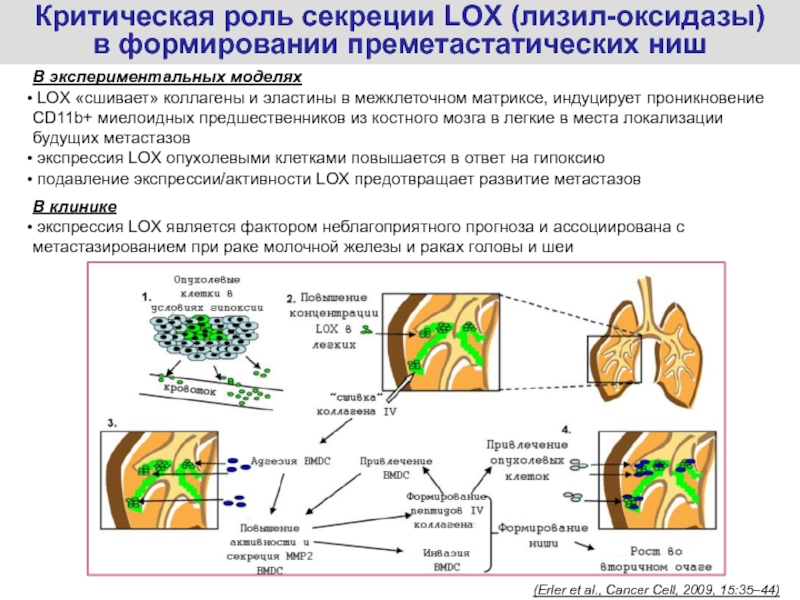
Слайд 56Критическая роль секреции LOX (лизил-оксидазы)
в формировании преметастатических ниш
В экспериментальных
моделях
LOX «сшивает» коллагены и эластины в межклеточном матриксе, индуцирует
проникновение СD11b+ миелоидных предшественников из костного мозга в легкие в места локализации будущих метастазов экспрессия LOX опухолевыми клетками повышается в ответ на гипоксию
подавление экспрессии/активности LOX предотвращает развитие метастазов
В клинике
экспрессия LOX является фактором неблагоприятного прогноза и ассоциирована с метастазированием при раке молочной железы и раках головы и шеи
(Erler et al., Cancer Cell, 2009, 15:35–44)