Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Курс лекций Физико-химические и физические методы аналитической химии
Содержание
- 1. Курс лекций Физико-химические и физические методы аналитической химии
- 2. Характеристическое свойство Аналитическую химию интересуют корреляции в
- 3. Общие представленияРассмотрим в общем виде электрохимическую цепь.
- 4. Общие представления Электрохимическая цепь состоит из двух электродов,
- 5. ПринципДля измерения аналитического сигнала требуется простейшая электрическая
- 6. ПринципВ идеальном случае для более точных измерений
- 7. ОпределенияМетоды анализа, основанные на измерении равновесных электродных
- 8. Принцип Второй общий случай использования электрохимических процессов для
- 9. ПринципПри такой схеме значительно больше вариантов получения
- 10. ПринципМы можем осуществить процесс электролитического выделения веществ
- 11. Потенциометрические методы анализаПотенциометрические методы основаны на измерении
- 12. Типы электродов в потенциометрииЭлектродами первого рода называют
- 13. Типы электродов в потенциометрииПроблема аналитического применения электродов
- 14. Типы электродов в потенциометрииВажнейшим исключением является водородный
- 15. Типы электродов в потенциометрииПоэтому такая система функционирует
- 16. Типы электродов в потенциометрииВторой тип электродов –
- 17. Типы электродов в потенциометрииВ соответствии с приведённым
- 18. Типы электродов в потенциометрииТретий из наиболее распространенных
- 19. Типы электродов в потенциометрииДля понимания принципов функционирования
- 20. Типы электродов в потенциометрииВ камерах 1 и
- 21. Типы электродов в потенциометрииТребование ионной проводимости является
- 22. Типы электродов в потенциометрииЕсли состав раствора во
- 23. Типы электродов в потенциометрииПриготовив несколько растворов с
- 24. Типы электродов в потенциометрииРассмотренную ячейку можно условно
- 25. Электродная функцияУчитывая, что ионоселективные электроды как правило
- 26. Электродная функцияОтклонение от линейности электродной функции в
- 27. Мешающие влиянияМешающее влияние продуктов растворения мембран закономерно
- 28. СелективностьСелективность ИСЭ характеризуется коэффициентами селективности по отношению
- 29. СелективностьCj = constCi - переменнаяKi/j = Ci/CjОпределение
- 30. СелективностьАбсцисса точки пересечения E=f(pi) и E при
- 31. СелективностьСуммарное влияние нескольких мешающих ионов учитывается уравнением,
- 32. СелективностьСнижение селективности, т.е. проявление мешающего влияния посторонних
- 33. Время откликаТретья важнейшая характеристика – время откликаион-селективного
- 34. Время откликаПри переходе от меньших концентраций к
- 35. Материалы мембран электродовОсновные аналитические характеристики ИСЭ, в
- 36. Материалы мембран электродовСовременную аналитическую химию трудно даже
- 37. Материалы мембран электродовКристаллические мембраны подразделяются на моно-
- 38. Материалы мембран электродовТретий тип мембран – жидкие
- 39. Состояние проблемыОчень существенным фактором в развитии ионометрии,
- 40. ТерминыПоследние три десятилетия характеризуются появлением в обиходе
- 41. Условия применимостиОчень неоднозначна оценка роли ионометрии в
- 42. Условия применимостиШирокое распространение метод находит и для
- 43. ТитрованиеВторая схема применения ИСЭ в анализе –
- 44. ТитрованиеВ кислотно-основном в качестве индикаторного обычно используется
- 45. Способы определенияСначала находят грубо объем титранта, необходимогодля
- 46. Преимущества титрованияПреимущества потенциометрического титрования – в возможности исключения субъективных ошибок титрования при нахождении К.Т.Т.
- 47. Особенности при титрованииВ окислительно-восстановительном титровании индикаторный электрод
- 48. Спасибо за внимание! Алексей Леонидович Москвин moskvin-al@rosanalyt.ru
- 49. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Курс лекций «Физико-химические и физические методы аналитической химии». ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Слайд 2Характеристическое свойство
Аналитическую химию интересуют корреляции в
системе: химический состав -
характеристические свойства, чтобы на основе найденных условий проявления последних и
функциональной зависимости величины аналитического сигнала от концентраций или абсолютных количеств определяемых веществ (аналитов): А = f ( C ) создавать методы химического анализа. Аналитическая химия на основании результатов изучения закономерностей проявления веществами характеристических свойств стремится сделать измеряемым химический состав любых объектов материального мира, который мы сейчас не можем измерить.Слайд 3Общие представления
Рассмотрим в общем виде электрохимическую цепь.
При этом под
электродом понимают систему, состоящую из двух или более ионо- и
электронопроводящих фаз, на границах которых происходит переход от электронной проводимости к ионной или наоборот.В техническом смысле под электродом часто понимают только электронопроводящую часть этой системы.
Слайд 4Общие представления
Электрохимическая цепь состоит из двух
электродов, погруженных в раствор электролита.
Каждый электрод характеризуется в этих условиях определенным значением электродного потенциала,
который представляет собой разность потенциалов между электродом и находящимся с ним в контакте раствором электролита. Отсюда появляется первое направление в использовании электрохимических процессов для аналитических целей - установление закономерностей изменения равновесных электродных потенциалов как функции состава электролита. E = f(Ci)Слайд 5Принцип
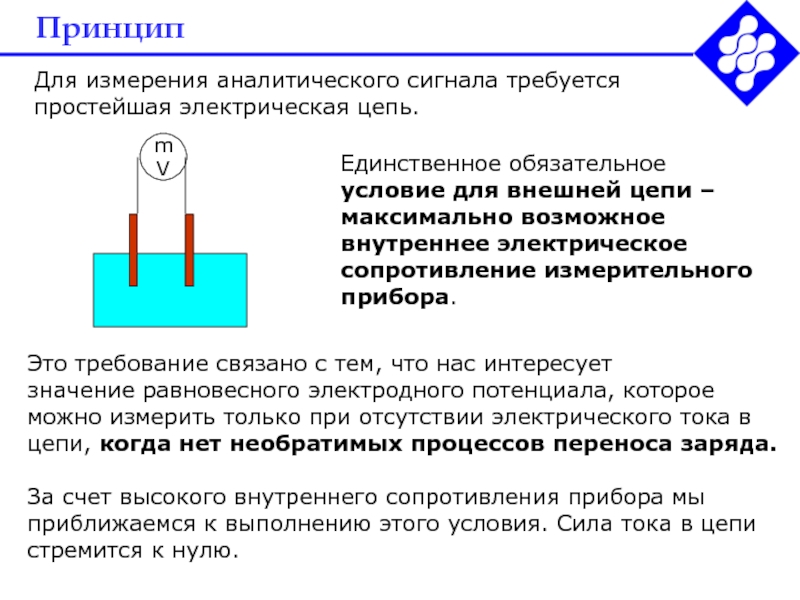
Для измерения аналитического сигнала требуется простейшая электрическая цепь.
Единственное обязательное условие
для внешней цепи – максимально возможное внутреннее электрическое сопротивление измерительного
прибора.Это требование связано с тем, что нас интересует
значение равновесного электродного потенциала, которое можно измерить только при отсутствии электрического тока в цепи, когда нет необратимых процессов переноса заряда.
За счет высокого внутреннего сопротивления прибора мы приближаемся к выполнению этого условия. Сила тока в цепи стремится к нулю.
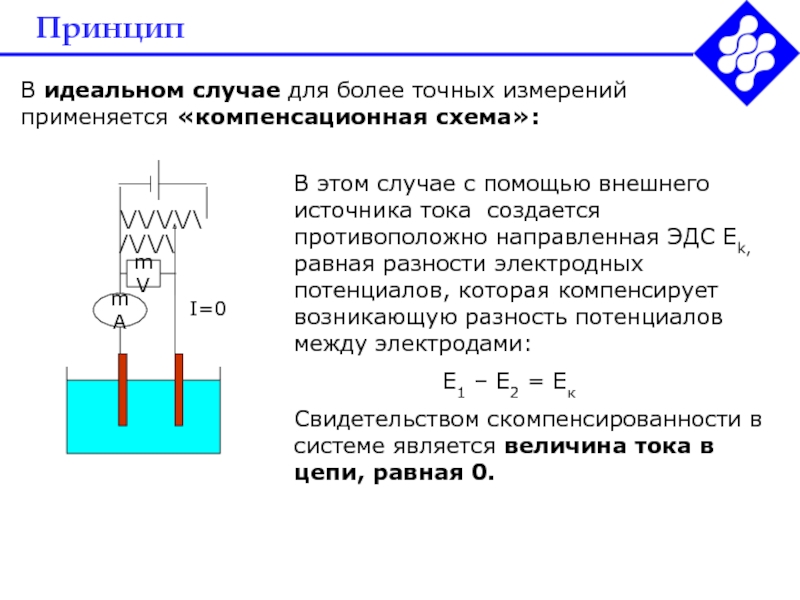
Слайд 6Принцип
В идеальном случае для более точных измерений применяется «компенсационная схема»:
В
этом случае с помощью внешнего источника тока создается противоположно направленная
ЭДС Ek, равная разности электродных потенциалов, которая компенсирует возникающую разность потенциалов между электродами:Е1 – Е2 = Ек
Свидетельством скомпенсированности в системе является величина тока в цепи, равная 0.
Слайд 7Определения
Методы анализа, основанные на измерении равновесных электродных потенциалов при нулевом
токе (i=0), называются равновесными или потенциометрическими. К ним относится потенциометрия (прямая
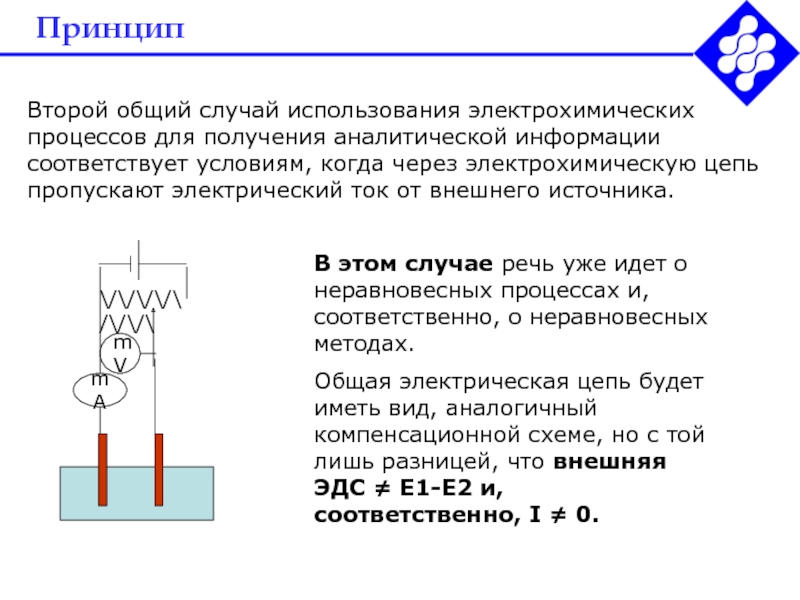
и косвенная).Слайд 8Принцип
Второй общий случай использования электрохимических процессов для получения аналитической информации
соответствует условиям, когда через электрохимическую цепь пропускают электрический ток от
внешнего источника.В этом случае речь уже идет о неравновесных процессах и, соответственно, о неравновесных методах.
Общая электрическая цепь будет иметь вид, аналогичный компенсационной схеме, но с той лишь разницей, что внешняя ЭДС Е1-Е2 и, соответственно, I 0.
Слайд 9Принцип
При такой схеме значительно больше вариантов получения аналитической информации.
Возможно, что
характеристические свойства аналитов не связаны с процессами, протекающими на электродах.
В
этом случае электропроводность раствора является функцией концентрации электролита в растворе:Сi = f()
На этом принципе основаны кондуктометрические электроаналитические методы.
Слайд 10Принцип
Мы можем осуществить процесс электролитического выделения веществ на одном из
электродов и измерить массу выделенного вещества или количество электричества, затраченное
на его выделение. Соответственно возможны методы электрогравиметрии и кулонометрии. Максимальная аналитическая информация может быть получена из зависимостей силы тока в цепи от приложенного внешнего напряжения. В общем случае метод, основанный на измерении I = f (E) называется вольтамперометрией. Вольтамперометрия является неравновесным методом и имеет множество разновидностей.Слайд 11Потенциометрические методы анализа
Потенциометрические методы основаны на измерении
разности потенциалов между
двумя электродами.
В первую очередь, необходимо уточнить, какие электроды интересны с
аналитической точки зрения. Для аналитических целей необходимо, чтобы
потенциал электрода, выступающего в роли индикаторного, имел определенную функциональную связь с концентрацией одного или нескольких видов ионов:
E = f(Ci).
Такой электрод называется индикаторным.
Второй электрод, наоборот, в условиях аналитических измерений должен иметь неизменное значение потенциала, т.е. быть электродом сравнения.
Слайд 12Типы электродов в потенциометрии
Электродами первого рода называют систему из
металла,
погруженного в раствор, содержащий ионы этого металла.
Равновесный потенциал электрода
I-го рода устанавливается при условии существования в системе равновесия:
Ме Men+ + ne
Согласно уравнению Нернста равновесный потенциал такого электрода
E = Eo + (RT/nF) ln a(Men+)
где R – газовая постоянная, Т – температура, F – число Фарадея, a(Men+) – активность ионов металла, Eo – стандартный электродный потенциал, соответствующий случаю, когда a(Men+) = 1.
Слайд 13Типы электродов в потенциометрии
Проблема аналитического применения электродов
1-го рода в
том, что для металлических электродов
практически невозможно обеспечить выполнения основного
условия – установления потенциал-определяющего равновесия.На потенциал электрода влияет множество побочных процессов,
часто замедленных во времени. Например, сольватационное
взаимодействие ионов металла с растворителем или другими веществами, присутствующими в растворе, в наиболее общем случае водных растворов – процессы акватации и гидролиза.
Поэтому электроды первого рода, как правило, не привлекательны ни как индикаторные, ни как электроды сравнения.
Из общего правила есть два исключения: серебряный и водородный электрод.
Слайд 14Типы электродов в потенциометрии
Важнейшим исключением является водородный
электрод, потенциал которого
выбран за точку отсчета по шкале электродных потенциалов.
Водородный электрод представляет
собой тонкостенную платиновую трубку, покрытую снаружи губчатой платиной. Внутри трубки поддерживается давление водорода 101325 Па (1 атм). Известно, что водород имеет высокую растворимость в платине и высокие значения коэффициентов диффузии через нее. Кроме того, платина является катализатором, снимающим активационный барьер в реакции диссоциации молекулы водорода на атомы и их ионизации:
H2 (Pt) 2H+ + 2e
Слайд 15Типы электродов в потенциометрии
Поэтому такая система функционирует как водородный электрод,
потенциал которого
E = Eo + (RT/F) ln a(H+)При a(H+) = 1, Eo – стандартный потенциал, принятый в водородной шкале за 0.
Слайд 16Типы электродов в потенциометрии
Второй тип электродов – электроды второго рода
- представляют собой систему из металла, его труднорастворимой соли и
насыщенного раствора данной соли в растворе хорошо растворимой соли или кислоты, содержащей в избытке анионы этой соли.Классический пример – хлорсеребряный электрод Ag/AgCl.
Потенциал такого электрода зависит от концентрации соответствующего аниона:
E = Eo Ag/Ag+ + (RT/F)ln a(Ag+) =
=Eo Ag/Ag+ + (RT/F)ln ПР(AgCl)/a(Cl-) =
=EoAg/Ag+ + (RT/F)ln ПР(AgCl) – (RT/F)lna(Cl-) =
=Eo - (RT/F)ln a(Cl-)
Слайд 17Типы электродов в потенциометрии
В соответствии с приведённым уравнением при
постоянстве
концентрации в растворе аниона обеспечивается постоянное значение электродного потенциала.
Поэтому
электроды II-го рода наиболее привлекательны в качестве электродов сравнения. Например, Ag/AgCl или Hg/Hg2Cl2 помещённые в насыщенный раствор KCl.Но известны примеры применения электродов 2-го рода и в качестве индикаторных для определения концентрации хлорид-ионов.
Слайд 18Типы электродов в потенциометрии
Третий из наиболее распространенных типов электродов –
мембранные.
Иногда понятие мембранные электроды отождествляется с понятием ионоселективные электроды.
Само название ионоселективные говорит о том, что мы подходим к самому интересному для аналитической химии типу электродов.
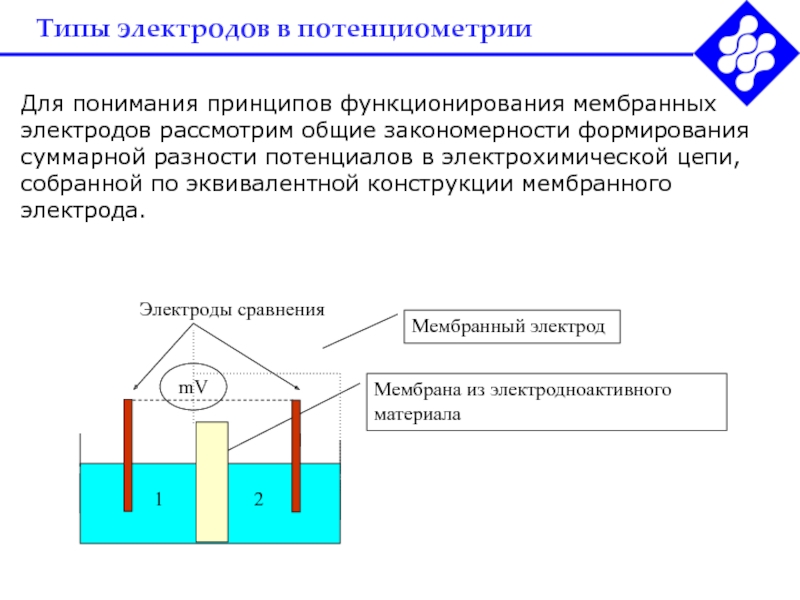
Слайд 19Типы электродов в потенциометрии
Для понимания принципов функционирования мембранных электродов рассмотрим
общие закономерности формирования суммарной разности потенциалов в электрохимической цепи, собранной
по эквивалентной конструкции мембранногоэлектрода.
Слайд 20Типы электродов в потенциометрии
В камерах 1 и 2 находятся растворы
с различными активностями потенциалопределяющих ионов.
Электродноактивный материал – это вещество, обладающее
ионной проводимостью, на границе раздела которого с раствором потенциалопределяющих ионов возникает скачок потенциала, функционально связанный с активностью, а, следовательно и с концентрацией потенциалопределяющих ионов: EM1 = f(ai)
Величина возникающего потенциала связана с активностью потенциалопределяющих ионов с той же Нернстовской зависимостью:
EM1 = Eo + (RT/nF) ln ai (1)
Слайд 21Типы электродов в потенциометрии
Требование ионной проводимости является
обязательным условием функционирования
мембранного электрода.
Если материал является диэлектриком, мы просто не сможем
измерить разность потенциалов в такой ячейке. Если материал будет иметь электронную проводимость – это приведет к невоспроизводимым скачкам потенциала при переходе от электронной к ионной проводимости.
Общая разность потенциалов подобной ячейки
Еяч = ЕЭ.С.1 – ЕМ1 + ЕМ2 – ЕЭ.С.2 (2)
Слайд 22Типы электродов в потенциометрии
Если состав раствора во 2-ой камере ячейки
зафиксирован, а в первую камеру мы будем помещать растворы с
переменной концентрацией потенциалопределяющих ионов, то в приведённом для Еяч уравнении переменной величиной будет только ЕМ1. Подставив в (2) ЕМ1 из равенства (1), получим следующее выражение:
Еяч= (ЕЭ.С.1 + ЕМ2 – ЕЭ.С.2 - ЕоМ1) – (RT/nF)lnai =
const – (RT/nF)lnai
Здесь const – суммарная величина постоянных составляющих.
Слайд 23Типы электродов в потенциометрии
Приготовив несколько растворов с известными
активностями, а
в случае разбавленных растворов с концентрациями i-вещества, можно построить градуировочный
график.С помощью этого градуировочного графика можно определить концентрацию i-го вещества в растворе.
Слайд 24Типы электродов в потенциометрии
Рассмотренную ячейку можно условно разделить на две
половины по границе мембраны со стороны раствора 1.
Ее правая
часть, в которую входит электрод сравнения, раствор с постоянной концентрацией потенциалопределяющего вещества и мембрана из электродноактивного материала, и называется мембранным электродом.Емэ = const – (RT/nF)ln ai = const – (0,059/n)lg ai
Главными характеристиками ионоселективных электродов являются:
область (диапазон) линейности электродной функции,
селективность,
время отклика.
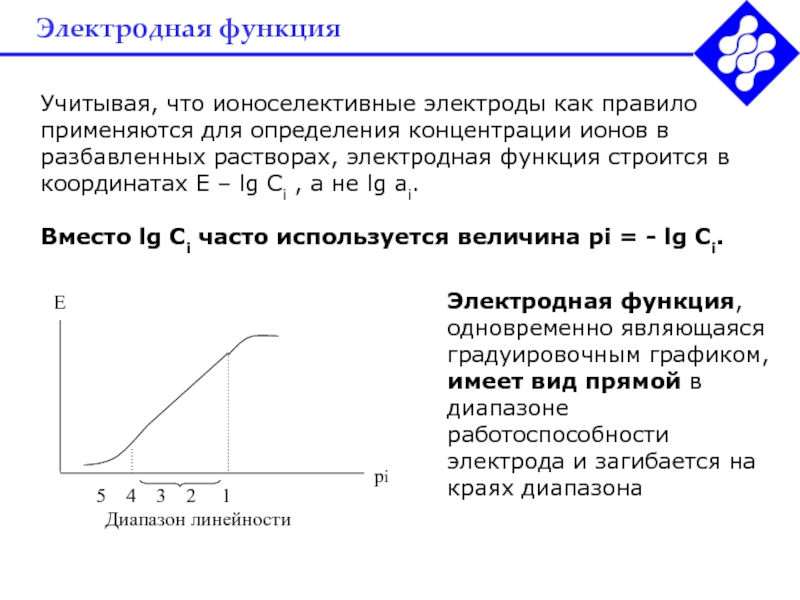
Слайд 25Электродная функция
Учитывая, что ионоселективные электроды как правило применяются для определения
концентрации ионов в разбавленных растворах, электродная функция строится в координатах
E – lg Ci , а не lg ai.Вместо lg Ci часто используется величина рi = - lg Ci.
Электродная функция, одновременно являющаяся градуировочным графиком, имеет вид прямой в диапазоне работоспособности электрода и загибается на краях диапазона
Слайд 26Электродная функция
Отклонение от линейности электродной функции в
области малых концентраций
чаще всего связано с растворением электродноактивного вещества мембраны, в результате
чего в прилегающем к мембране слое раствора создается концентрация потенциалопределяющего иона, соизмеримая с измеряемой.По мере уменьшения концентрации соответствующих ионов в растворе влияние растворения мембраны проявляется все заметнее и потенциал электрода приходит к значению, соответствующему этой концентрации потенциалопределяющих ионов.
Приведенная электродная функция соответствует хлоридселективному электроду с мембраной на основе AgCl. Как известно, ПРAgCl=1,8.10 –10.
Слайд 27Мешающие влияния
Мешающее влияние продуктов растворения
мембран закономерно начинает проявляться в
диапазоне концентраций от 10-5 до 10-4 Моль/л.
Основная причина отклонения электродной
функции от линейности в области высоких концентраций – существенное расхождение концентрации и активности ионов. Но могут проявляться и более сложные процессы.
Например, для хлоридселективных электродов – увеличение растворимости AgCl в концентрированных растворах хлоридов за счёт образования растворимых хлоридных комплексов [AgCl2]-.
Слайд 28Селективность
Селективность ИСЭ характеризуется коэффициентами
селективности по отношению к ионам, которые
могут оказывать влияние на величину равновесного электродного потенциала.
Коэффициент селективности
равен отношению концентраций потенциалопределяющего и мешающего ионов, которым соответствует одинаковое значение электродного потенциала:Ki/j = Ci/Cj при условии Ei = Ej
где Ei – значение электродного потенциала в области линейности электродной функции, при концентрации потенциалопределяющего иона Сi; Ej – значение электродного потенциала, определяемого присутствием мешающего иона с концентрацией Cj.
Слайд 29Селективность
Cj = const
Ci - переменная
Ki/j = Ci/Cj
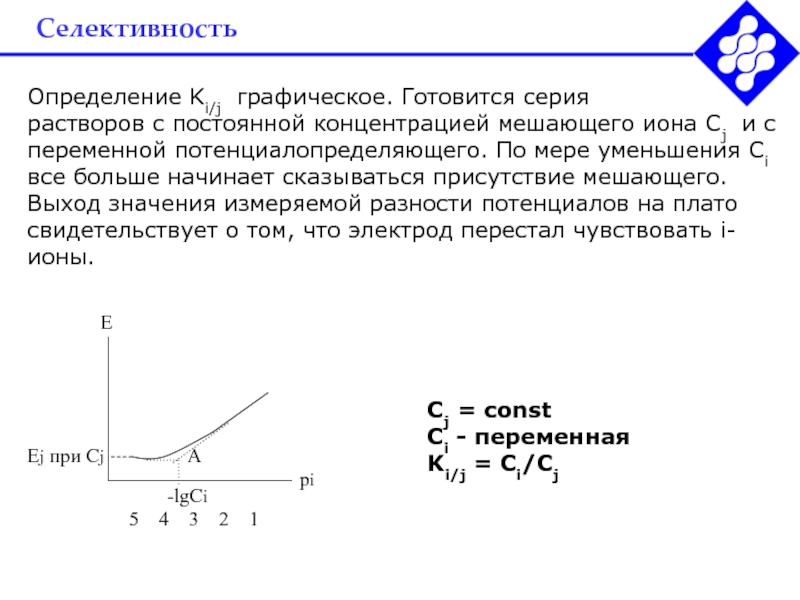
Определение Ki/j графическое. Готовится
серия
растворов с постоянной концентрацией мешающего иона Cj и с
переменной потенциалопределяющего. По мере уменьшения Ci все больше начинает сказываться присутствие мешающего. Выход значения измеряемой разности потенциалов на плато свидетельствует о том, что электрод перестал чувствовать i-ионы.Слайд 30Селективность
Абсцисса точки пересечения E=f(pi) и E при Cj
соответствует pi
= -lgCi.
Отсюда находится Ci и соответствующее значение
коэффициента селективности
Ki/j = Ci/Cj, так как величина Cj известна из условий эксперимента.Если Ki/j < 1, то электрод более селективен к i-ионам и наоборот, при Ki/j >1 электрод сильнее реагирует на присутствие мешающего иона.
Примером может служить присутствие бромидов и иодидов при определении хлоридов с помощью хлоридселективного электрода.
Слайд 31Селективность
Суммарное влияние нескольких мешающих ионов учитывается уравнением, предложенным Б.П.Никольским:
Емэ =
const – (0,059/n)lg [ai + Ki/jajni/nj + Ki/lalni/nl + …]
Это
уравнение справедливо, если мешающее влияние связано с конкуренцией ионов при установлении ионных равновесий между мембраной и раствором.Слайд 32Селективность
Снижение селективности, т.е. проявление мешающего
влияния посторонних ионов далеко не
всегда связано с ионообменными процессами между поверхностью мембраны и раствором,
как в случае взаимного влияния галогенид-ионов.Очень часто на ионное равновесие потенциалопределяющего иона влияют процессы комплексообразования в растворе. Например, на ионную функцию фторид-селективного электрода оказывает сильное влияние присутствие ионов Fe(III) и Al(III), образующих прочные комплексы с фторид-ионами.
На электродные функции электродов, селективных к двухзарядным катионам Cu II, Cd II, Pb II и т.п. оказывают влияние любые ионы, способные к комплексообразованию с ними.
Слайд 33Время отклика
Третья важнейшая характеристика – время отклика
ион-селективного электрода, которое характеризует
время, необходимое для достижения электродом постоянного значения потенциала после скачкообразного
изменения концентрации.Величина tоткл зависит как от индивидуальных характеристик электродов, так и от условий измерения. Чем больше концентрационный скачок, тем больше время отклика.
Слайд 34Время отклика
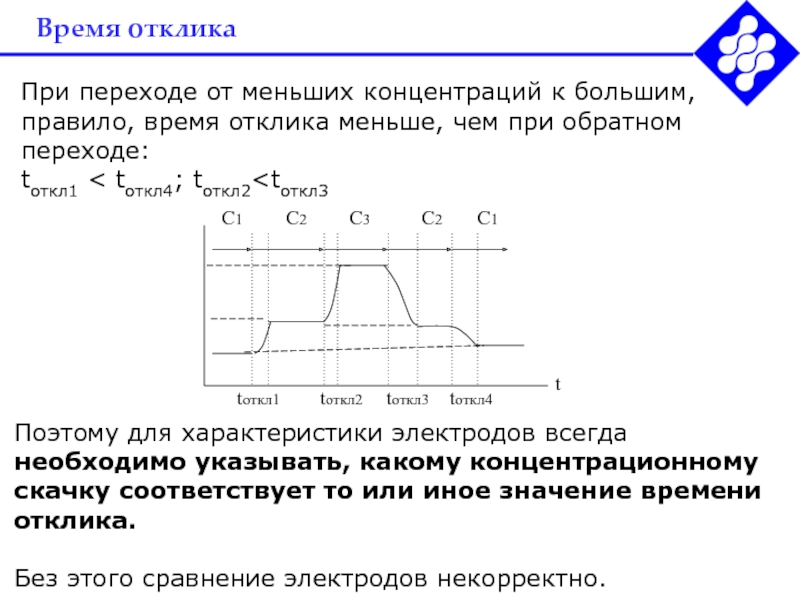
При переходе от меньших концентраций к большим, как правило,
время отклика меньше, чем при обратном переходе:
tоткл1 < tоткл4;
tоткл2Поэтому для характеристики электродов всегда необходимо указывать, какому концентрационному скачку соответствует то или иное значение времени отклика.
Без этого сравнение электродов некорректно.
Слайд 35Материалы мембран электродов
Основные аналитические характеристики ИСЭ,
в первую очередь, определяются
свойствами веществ, из которых изготовлены мембраны.
В зависимости от фазового состояния
электродноактивных веществ различают три основных типа мембран, применяемых в ионоселективных электродах: кристаллические, стеклянные и жидкие.Первым и до сих пор самым важным типом мембран электродов являются стеклянные электроды, мембраны которых изготовлены из силикатных стекол. Все силикатные стекла могут рассматриваться как соли полимерных кремниевых кислот. Они обладают уникальной селективностью к ионам гидроксония.
Ни один другой электрод не имеет даже близкой по широте диапазона области линейности электродной функции: почти 14 порядков изменений активности ионов водорода.
Слайд 36Материалы мембран электродов
Современную аналитическую химию трудно даже себе представить без
рН-метрии с помощью стеклянных электродов.
Путем модифицирования состава стекла удалось решить
проблемы создания электродов, селективных к ионам натрия.По диапазону линейности электродной функции и селективности они существенно уступают рН-электродам и всегда более селективны к ионам водорода, по сравнению с
потенциалопределяющими ионами натрия.
Главной проблемой для стеклянных электродов является создание стекол с высокой ионной проводимостью.
Одновременно продолжается поиск состава стекол, селективных к другим ионам. Ряд оригинальных решений найден, в частности, при использовании в качестве электродноактивных материалов халькогенидных стекол.
Слайд 37Материалы мембран электродов
Кристаллические мембраны подразделяются на моно- и поликристаллические, а
последние, в свою очередь, на гомогенные и гетерогенные.
При одном и
том же химическом составе различия между модификациями кристаллических электродов проявляются, в первую очередь, по такой аналитической характеристике электродов, как время отклика. Иногда в незначительной степени могут проявляться различия в величине концентрации потенциал-определяющего иона, соответствующей нижней границе области линейности электродной функции, связанной с различной растворимостью материала мембраны, т.к. монокристаллические мембраны всегда менее растворимы, чем поликристаллические.
Возможности выбора материала мембран этого класса достаточно ограничены и в значительной степени исчерпаны. Наиболее удачные решения с помощью кристаллических мембран найдены для ионометрического определения галогенид-ионов: F-, Cl-, Br-, I- и S2-
Слайд 38Материалы мембран электродов
Третий тип мембран – жидкие или пластифицированные.
Поскольку
создать измерительную ячейку со слоем свободной жидкости в качестве мембраны
достаточно сложно, обычно жидким электродноактивным материалом пропитывается подложка из набухающего в этой жидкости полимера. Отсюда название – пластифицированные мембраны. Мембраны этого типа существенно менее удобны для практического использования. Жидкостям, например, свойственно испаряться.Поэтому время жизни пластифицированных мембран существенно меньше, чем твердотельных. Но есть и одно важное преимущество – значительно большее число вариантов выбора материалов, отвечающих критериям селективности и ионной проводимости.
В частности, на основе пластифицированных мембран решаются такие актуальные проблемы, как определение нитратов, ионов аммония, калия и кальция.
Слайд 39Состояние проблемы
Очень существенным фактором в развитии ионометрии, впрочем, как и
большинства аналитических методов, является уровень технологических и технических решений.
К
настоящему времени разработано множество конструкций ИСЭ, рассчитанных на их использование в обычных схемах рутинного анализа и для решения специфических аналитических проблем, таких как анализ в потоке и анализ биологических объектов, включая измерения in situ непосредственно в биологических жидкостях живых организмов. Изменение конструкций и миниатюризация не влияют на общие принципы метода.
Появились некоторые терминологические проблемы.
Слайд 40Термины
Последние три десятилетия характеризуются появлением
в обиходе аналитиков нового термина
– химические сенсоры.
Я бы определил химический сенсор как преобразователь
информации об изменении химического состава анализируемой среды в электрический сигнал. Общепринятого толкования этого термина не существует. Приблизительный смысл – миниатюрное средство прямого измерения концентрации химических веществ в жидких и газовых средах. Принципы измерения могут быть любыми.
ИСЭ хорошо укладываются в смысловое содержание этого термина. Поэтому в последние годы наметилась тенденция рассматривать ИСЭ, как один из вариантов химических сенсоров. От нового термина содержание не изменилось.
Слайд 41Условия применимости
Очень неоднозначна оценка роли ионометрии в
химическом анализе. Дилетанты
обычно преувеличивают возможности метода, аналитики-практики преуменьшают.
Объективно можно утверждать, что
ионометрия – идеальный метод для непрерывного анализа в потоке контролируемой среды, когда необходимо наблюдать за изменением концентрации априорно известного аналита. Это может быть и экологический мониторинг, и непрерывный контроль технологических процессов. Мы с некоторым отставанием от реального времени получаем информацию об изменении концентрации того или иного компонента в объекте анализа.
В лабораторной практике безоговорочно признанным является метод рН-метрии.
Слайд 42Условия применимости
Широкое распространение метод находит и для определения отдельных анионов:
F-, Cl-, Br-, I-, S2-.
Сложнее обстоит дело с определением
ионов тяжелых металлов. Потенциал любого ИСЭ является функцией концентрации потенциалопределяющих ионов в растворе. Поэтому любой химический процесс, в результате которого происходит сдвиг ионных равновесий, будет влиять на величину аналитического сигнала. Только в идеальных условиях (кислый раствор, отсутствие комплексообразователей) тяжелые металлы присутствуют в растворе в форме соответствующих катионов: Cu2+, Cd2+, Pb2+ и т.д.
В реальных водных средах, таких как природные и сточные воды, происходят процессы гидролиза и комплексообразования с неорганическими и органическими лигандами.
Слайд 43Титрование
Вторая схема применения ИСЭ в анализе – потенциометрическое титрование, в
котором зависимость равновесного потенциала индикаторного электрода от состава раствора используется
для нахождения конечной точки титрования.Потенциометрическое титрование может быть:
кислотно-основным,
окислительно-восстановительным,
комплексонометрическим,
осадительным.
Слайд 44Титрование
В кислотно-основном в качестве индикаторного обычно
используется стеклянный рН-электрод. Преимущество
перед прямой потенциометрией: вместо суммарной концентрации Н+-ионов можно определить концентрации
индивидуальных кислот с различными константами диссоциации.Слайд 45Способы определения
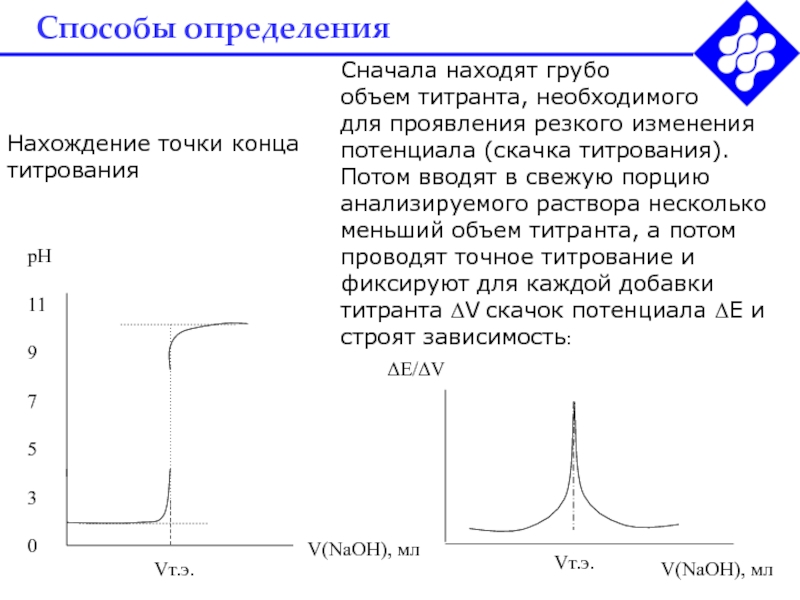
Сначала находят грубо
объем титранта, необходимого
для проявления резкого изменения
потенциала (скачка титрования). Потом вводят в свежую порцию анализируемого раствора
несколько меньший объем титранта, а потом проводят точное титрование и фиксируют для каждой добавки титранта V скачок потенциала Е и строят зависимость:Нахождение точки конца титрования
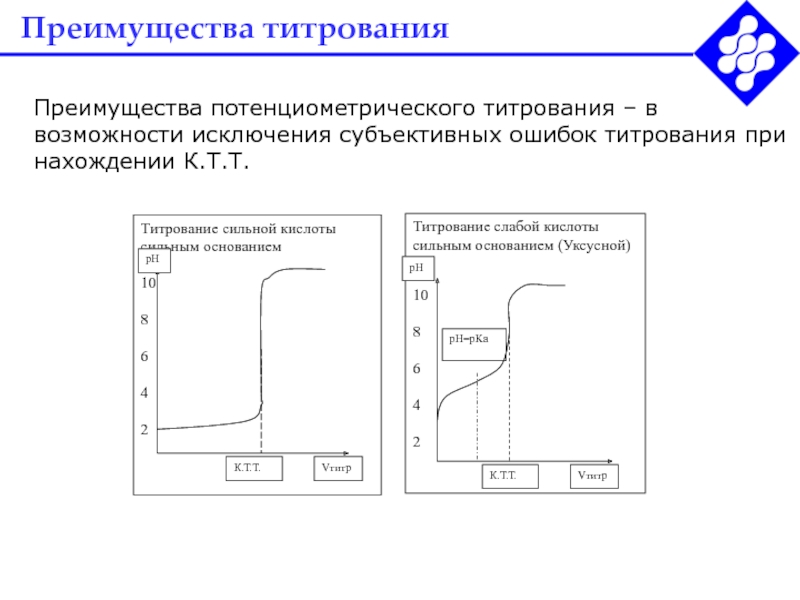
Слайд 46Преимущества титрования
Преимущества потенциометрического титрования – в возможности исключения субъективных ошибок
титрования при нахождении К.Т.Т.
Слайд 47Особенности при титровании
В окислительно-восстановительном титровании индикаторный электрод – мет. Pt
(инертный металлический электрод – переносчик электронов от восстановленной формы к
окисленной).В осадительном (сравнительно редко применяемый вариант) металлический Ag-электрод при титровании Cl-—ионов ионами Ag+.