Квантование как задача о собственных значениях. Первое сообщение.
E. Schredinger. Ann.
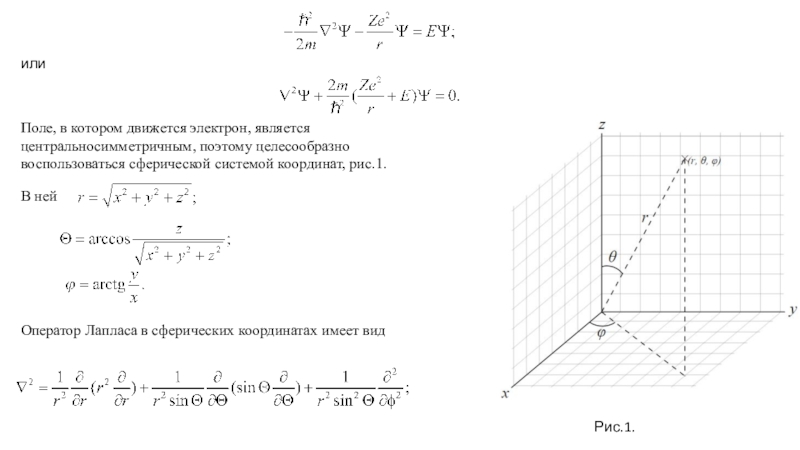
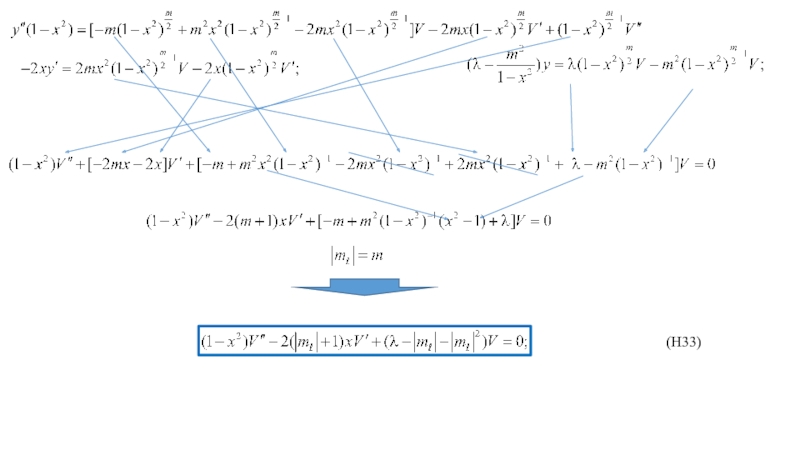
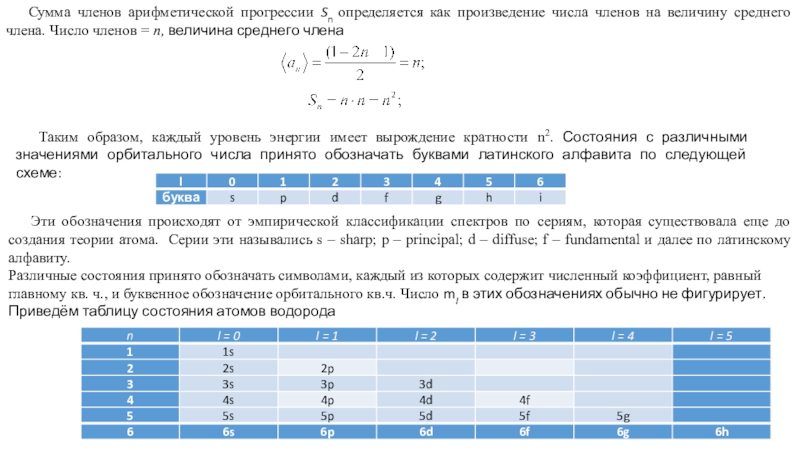
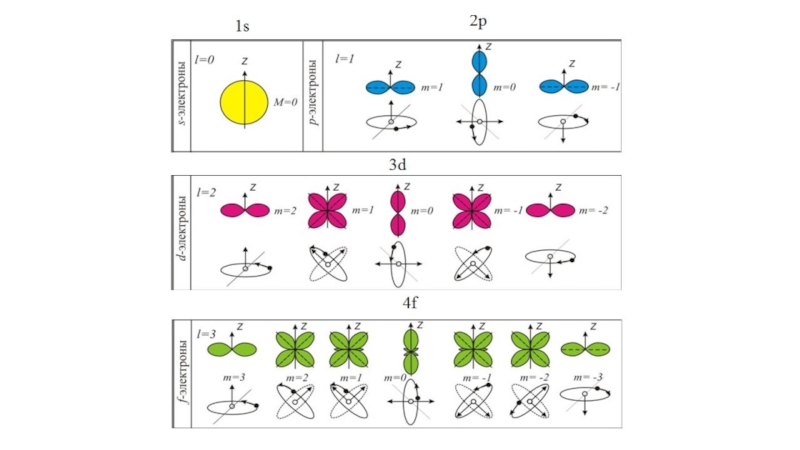
Phisik, 1926, 79,489. Квантование как задача о собственных значениях. Второе сообщение*.Из многочисленных работ, вышедших из под пера Эрвина Шредингера, выделяются две, ссылки на которые приведены выше, в которых он сформулировал основные положения, как он говорил, волновой механики, получил волновое уравнение – уравнение Шредингера, и применил их в частности к решению задачи на отыскание стационарных уровней энергии в атоме водорода и распределении плотности вероятности для электрона в этих состояниях.
В этих же работах именно он сформулировал стандартные условия, о которых мы уже говорили ранее при решении задачи о движении частицы в потенциальной яме с бесконечно высокими стенками: именно, требования конечности и непрерывности волновой функции вместе с её первой производной, а также условие нормировки волновых функций.
Сам он писал: «В этом сообщении я собираюсь показать, на простейшем примере нерелятивистского свободного атома водорода, что обычные правила квантования могут быть заменены другими положениями, в которых уже не вводится каких-либо целых чисел. Целочисленность при этом получается единственным образом сама по себе подобно тому как сама по себе получается целочисленность числа узлов при рассмотрении колеблющейся струны. Это новое представление может быть обобщено, и я думаю, что оно тесно связано с истинной природой квантования».