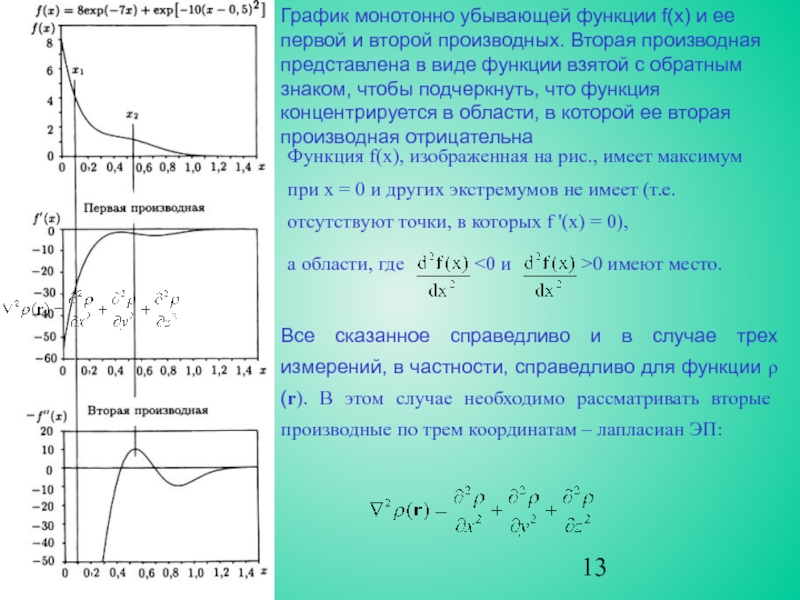
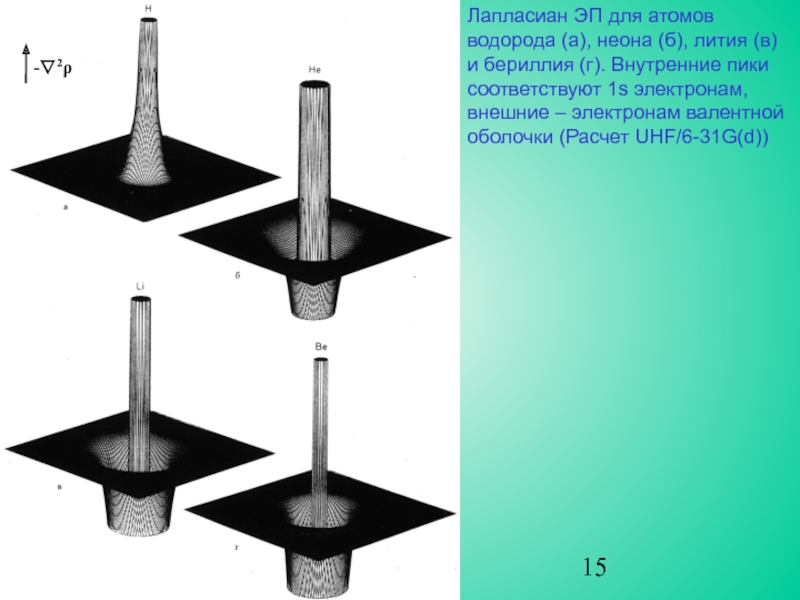
случае кривизна ρ(r) вдоль радиального направления от ядра положительна, как
и f(x) в точке x1 на рис. 10. Однако, две компоненты кривизны, перпендикулярные радиальной линии, отрицательны. Таким образом, функция ∇2ρ(r) будет принимать разные знаки по мере удаления от ядра, явно проявляя электронные оболочки атома.
Для каждой квантовой оболочки наблюдается пара областей (одна отрицательная и одна положительная) с внутренней областью, представляющей собой максимум концентрации электронов. Поскольку ЭП концентрируется при ∇2ρ<0, локальный максимум −∇2ρ будет соответствовать максимуму концентрации ЭП, а локальный минимум −∇2ρ указывает на локальное разрежение ЭП.
∇2ρ - удобная функция для анализа строения электронных оболочек атомов.
Лапласиан ЭП определяет концентрацию электронов на валентной оболочке. Она разделена на внутреннюю область, в которой ∇2ρ<0 и внешнюю, в которой ∇2ρ>0. Часть оболочки, внутри которой ∇2ρ<0, носит название области концентрации заряда валентной оболочки (КЗВО). При образовании химической связи валентная оболочка искажается, приводя к появлению максимумов, соответствующих числу и относительному расположению электронных пар, отвечающих предсказаниям модели Льюиса и модели отталкивания электронных пар валентной оболочки Гиллеспи.


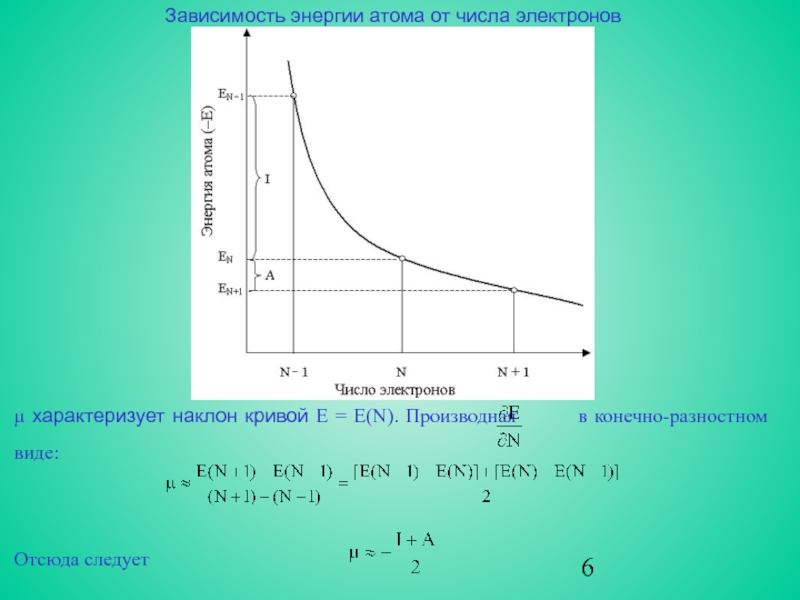
![Квантово-химическая трактовка решений одноэлектронных уравнений Приравнивая нулю дифференциал функционала электронной энергии d{E[ρ] – μN[ρ(r)]}Vяд = const Приравнивая нулю дифференциал функционала электронной энергии d{E[ρ] – μN[ρ(r)]}Vяд = const = 0,(N = ∫ ρ(r) dv),](/img/thumbs/d5b4bbf1cc82f2266650f2a629b36549-800x.jpg)