Слайд 2СООТНОШЕНИЕ НЕОПРЕДЕЛЁННОСТЕЙ ГЕЙЗЕНБЕРГА
Микрочастица (микрообъект) не может иметь одновре-менно и определённую
координату ( ), и определё-нную соответствующую
проекцию импульса ( ), причем неопределённости этих величин удовлетво-ряют условиям:
Произведение неопределённостей координаты и соот-ветствующей ей проекции импульса не может быть меньше величины порядка .
Слайд 3Неспособность одновременно точно определить коорди-нату и соответствующую ей составляющую импульса,
не связана с несовершенством методов измерения
или приборов, а является следствием
специфики мик-рообъектов, отражающей особенности их объективных свойств, а именно двойственной корпускулярно-волно-вой природы. Соотношение неопределённостей полу-чено при одновременном использовании классических характеристиках движения частицы (координаты, им-пульса) и наличия у неё волновых свойств.
В классической механике принимается, что измерение координаты и импульса может быть определено с лю-бой точностью, и соотношение неопределённостей является квантовым ограничением применимости классической механики к микрообъектам.
Слайд 4ВОЛНОВАЯ ФУНКЦИЯ И ЕЁ СТАТИСТИЧЕСКИЙ СМЫСЛ
Слайд 5Экспериментальное подтверждение идеи де-Бройля об универсальности корпускулярно-волнового дуализма и ограниченности
применения классической механики привели к созданию КВАНТОВОЙ МЕХАНИКИ описыва-ющей законы
движения и взаимодействия микрочас-тиц, с учетом их волновых свойств. При этом возникли новые проблемы, в частности проблема физической природы волн де-Бройля. Можно ли волны де-Бройля считать волнами вероятности, то есть считать что вероятность обнаружения микрочастиц в различных точках пространства меняется по волновому закону? НЕЛЬЗЯ!!! Такое толкование волн де-Бройля неверно, потому что тогда вероятность обнаружить частицу в не-которых точках пространства будет отрицательной, что не имеет смысла.
Слайд 6Что бы устранить эти трудности немецкий физик М. Борн (1882-1970)
в 1926 г. Предположил что по волновому закону изменяется НЕ
сама вероятность, а величина называемая амплитудой вероятности или волновой функцией .
Амплитуда вероятности может быть комплексной, и ве-роятность пропорциональна квадрату её модуля. Таким образом, описание состояния микрообъекта с помощью волновой функции имеет статистический, вероятностный характер: квадрат мо-дуля волновой функции (квадрат модуля амплитуды волн де-Бройля) определяет вероятность нахождения частицы в момент времени t в области с координата-ми и , и , и .
Слайд 7Состояние микрочастицы в квантовой механике описы-вается с помощью волновой функции,
которая является основным носителем информации об волновых и кор-пускулярных свойствах
микрочастиц. Вероятность на-хождения частицы в элементе объемом равна:
Квадрат модуля волновой функции: имеет смысл плотности вероятности, то есть определяет ве-роятность нахождения частицы в единичном объеме в окрестности точки с координатами .
То есть физический смысл имеет не сама функция, а ква-драт её модуля , которым задаётся интенсивность волн де-Бройля.
Слайд 8Вероятность найти частицу в момент времени в конеч-ном
объеме равна:
Так как
определяется как вероятность, необходимо волновую функцию нормировать так. Что бы вероят-ность достоверного события обращалась в единицу,ес-ли за объем принять бесконечный объем всего прос-транства. Это означает, что при данном условии части-ца находится где то в пространстве.
Значит, условие нормировки вероятностей , где данный интеграл вычисляется по всему бесконеч-ному пространству, то есть координатам от до .
Таким образом данное условие говорит об объективном существовании частицы в пространстве и времени.
Слайд 9Что бы волновая функция являлась объективной харак-теристикой состояния микрочастицы, она
должна удо-влетворять ряду ограничивающих условий:
Быть конечной (не больше единицы)
Быть однозначной
(вероятность не может быть неоднозначной величиной)
Быть непрерывной (вероятность не может изменяться скачком)
Волновая функция удовлетворяет принципу суперпози-ции: если система может находиться в различных сос-тояниях, описываемых волновыми функциями , то она может так же находиться в состоя-нии описываемым линейной комбинацией этих функций:
Слайд 10 – произвольные комплексные числа
Сложение волновых функций (амплитуд вероятностей), а не
вероятностей (определяемых квадратами модулей волновых функций принципиально отличают кванто-вую теорию
от классической статистической теории, в которой для независимых событий справедлива теоре-ма сложения вероятностей.
Волновая функция, являясь основной характеристикой состояния микрообъектов, позволяет в квантовой ме-ханике вычислять средние значения физических вели-чин, характеризующих данный микрообъект. Например , среднее расстояние электрона от ядра атома определяют по формуле:
Слайд 12Уравнением движения в квантовой механике, описываю-щим движение микрочастиц в различных
силовых по-лях, должно быть уравнение, из которого бы вытекали наблюдаемые
на опыте волновые свойства частиц. Ос-новное уравнение должно быть уравнением относи-тельно волновой функции , так как именно она (а точнее её квадрат ). Определяет вероятность пребывания частицы в момент времени в объеме , то есть в области с координатами , и .так как искомое уравнение должно учитывать волновые свойства частиц, то оно должно быть волно-вым уравнением.
Основное уравнение нерелятивистской механики сфор-мулировано в 1926 г. Э. Шредингером. Оно не выводится, а постулируется.
Слайд 13ОБЩЕЕ УРАВНЕНИЕ ШРЕДИНГЕРА
(УРАВНЕНИЕ ШРЕДИНГЕРА ЗАВИСЯЩЕЕ ОТ ВРЕМЕНИ)
Где:
Джс – постоянная Планка
– масса частицы
– оператор Лапласа
– потенциальная энергия частицы в силовом поле в котором совершается движение
– искомая волновая функция частицы
Слайд 14Уравнение Шредингера справедливо для любой частицы (со спином (собственным неуничтожимым
механичес-ким моментом импульса, не связанным с движением частицы в пространстве)равным
0)движущейся с ма-лой ( по сравнению со скоростью света) скоростью Оно дополняется условиями накладываемыми на вол-новую функцию:
Волновая функция должна быть конечной, однознач-ной и непрерывной.
Производные должны быть непреры-вны.
Функция должна быть интегрируема.
Слайд 15УПРОШЕННОЕ УРАВНЕНИЕ ШРЕДИНГЕРА
(УРАВНЕНИЕ ШРЕДИНГЕРА ДЛЯ СТАЦИОНАРНЫХ СОСТОЯНИЙ )
Для многих
физических явлений уравнение Шредингера можно упростить, исключив из него зависимость
от времени, иными словами найдя уравнение Шрединге-ра для стационарных состояний – состояний с фиксиро-ванными значениями энергии.
Это возможно, если силовое поле в котором частица дви-жется стационарно, то есть –не зависит явно от времени и имеет смысл потенциальной энер-гии. В этом случае уравнение Шредингера может быть представлено в виде произведения двух функций, одна из которых есть функция только координат, другая
Слайд 16 только времени, причем зависимость от времени выра-жается как:
Так что:
– полная энергия частицы, постоянная в случае стационарного поля.
В
более общей форме уравнение имеет вид:
После проведения ряда преобразований уравнение будет иметь вид:
Слайд 18При движении свободной частицы (
) её полная энергия совпадает с кинетической. Для свободной час-тицы
двигающейся вдоль оси х уравнение Шредингера для стационарных состояний будет иметь вид:
Частным решением этого уравнения является функция:
Где , , с собственным значением энер-гии .
Функция представляет со-бой плоскую монохроматическую волну де-Бройля (здесь и ).
Слайд 19Зависимость энергии от импульса
обы-чная для нерелятивистских частиц , значит энергия свободной частицы может принимать любые значения и её энергетический спектр является непрерывным. Таким образом свободная квантовая частица описыва-ется плоской монохроматической волной де-Бройля. Этому соответствует не зависящая от времени плот-ность вероятности обнаружения частицы в данной точке пространства.
Значит все положения свободной частицы в пространстве считаются равновероятными.
Слайд 20ЧАСТИЦА В ОДНОМЕРНОЙ ПРЯМОУГОЛЬНОЙ «ПОТЕНЦИАЛЬНОЙ ЯМЕ» С БЕСКОНЕЧНО ВЫСОКИМИ СТЕНКАМИ
Слайд 21Уравнение Шредингера
ха- рактеризующее микрочастицы может быть применено к частице в одномерной «потенциальной яме» с беско-нечно высокими стенками. Такая «яма» описывается потенциальной энергией вида( если частица движется вдоль оси х):
Где – ширина ямы, а энергия отсчитывается от её дна.
Уравнение Шредингера для стационарных состояний в случае одномерной задачи записывается в виде:
Слайд 22По условию задачи (бесконечно высокие стенки) частица не проникает за
пределы ямы, и вероятность её обна-ружения (а значит и волновая
функция) за пределами ямы равна нулю. На границах ямы ( при и ) непрерывная волновая функция тоже должна обра-щаться в нуль, а значит граничные условия в этом слу-чае имеют вид
В пределах ямы уравнение Шредингера сводится к уравнению:
или иначе
Где:
Слайд 23Общее решение данного дифференциального уравнения:
Так как
то ,
а значит
Условие выполняется только при где – целое число, то есть необходимо что бы выполнялось равенство , а значит:
Стационарное уравнение Шредингера описывающее движение частицы в «потенциальной яме», с беско-нечно высокими « стенками» удовлетворяется только при собственных значениях энергии зависящих от целого числа .
Слайд 24Энергия частицы в «потенциальной» яме с бесконеч-но
высокими «стенками» принимает лишь определён-ные дискретные значения или квантуется. Квантован-ные
значения энергии называются уровнями энер-гии, а число определяющее энергетические уровни частицы, называется главным квантовым числом.
Микрочастица в «потенциальной яме» с бесконечно вы-сокими «стенками» может находиться только на опре-делённом энергетическом уровне ,или, иначе гово-ря, частица находится в квантовом состоянии .
Слайд 25Подставив в уравнение волновой функции ,
значе-ние найдем собственные функции:
Постоянную интегрирования А найдём из
условия нор-мировки:
То есть:
Проинтегрировав получим , а собственные функ-ции будут иметь вид:
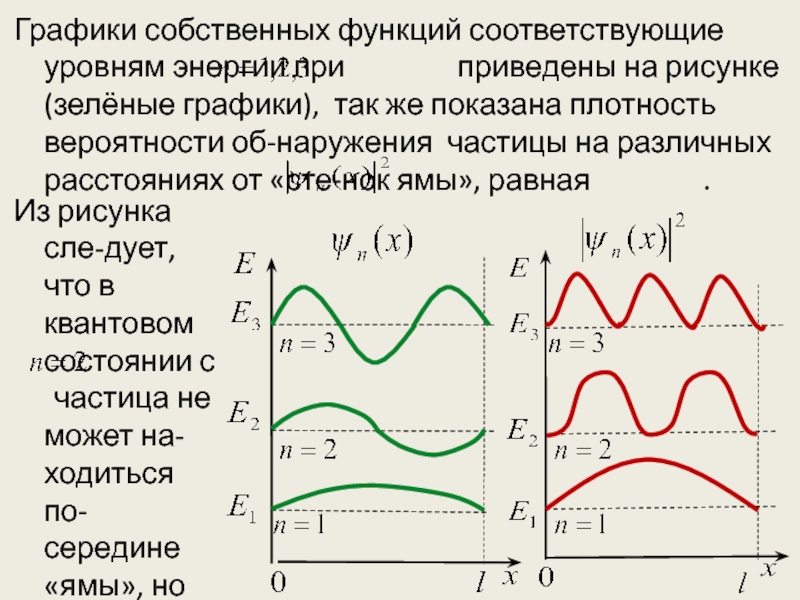
Слайд 26Графики собственных функций соответствующие уровням энергии при
приведены на рисунке(зелёные графики), так же
показана плотность вероятности об-наружения частицы на различных расстояниях от «сте-нок ямы», равная .
Из рисунка сле-дует, что в квантовом состоянии с частица не может на-ходиться по-середине «ямы», но одинакого
Слайд 27 часто может быть в левой и правой частях. Такое пове-дение
показывает, что представление о траекториях частицы в квантовой механике несостоятельны.
Энергетический
интервал между соседними уровнями:
Для электрона, при размере «ямы» (для свобод-ных электронов в металле) , то есть энергетические уровни расположены столь тесно, что спектр практически можно считать непрерывным, если же размеры «ямы» сопоставимы с атомными то, для электрона , то есть получается явно дискретное значение (линейчатый спектр). Применение уравнения Шредингера к частице
Слайд 28 в «потенциальной яме» с бесконечно высокими «стен-ками» приводит к квантованным
значениям энергии, в то время как классическая механика никаких ограниче-ний
на энергию этой частицы не накладывает.
Частица в «потенциальной яме» не может иметь энергию меньшую чем , это не случайно и зависит от сложения неопределённостей.
Неопределённость координаты частицы в «яме» равна . Тогда импульс не может (по соотношению нео-пределённостей ) иметь точное, в данном случае нулевое значение. Неопределенность импульса . Такому разбросу значений импульса соответст-вует кинетическая энергия . Все остальные уровни имеют энергию превышающую это минимальное значение.
Слайд 29При больших квантовых числах ( )
, то есть со-седние уровни расположены тесно: тем теснее, чем боль-ше . Если очень велико, то можно говорить о практи-чески непрерывной последовательности уровней и харак-терная особенность квантовых процессов – дискретность, сглаживается это частный случай ПРИНЦИПА СООТВЕТ-СТВИЯ БОРА, по которому: законы квантовой механики должны, при больших значениях квантовых чисел пере-ходить в законы классической механики.
ОБЩАЯ ТРАКТОВКА ЗАКОНА СООТВЕТСТВИЯ БОРА:
Всякая новая теория, более общая, являющаяся развитием классической, не отвергает её полностью, а включает в себя классическую теорию, указывая границы её приме-нения, и в определённых случаях новая теория переходит в старую.
Слайд 30ЭЛЕМЕНТЫ СОВРЕМЕННОЙ ФИЗИКИ АТОМОВ И МОЛЕКУЛ
Слайд 31АТОМ ВОДОРОДА В КВАНТОВОЙ МЕХАНИКЕ
Слайд 32Решение задачи об энергетичес-ких уровнях электрона для ато-ма водорода (а
так же водоро-доподобных систем), сводится к задаче о движении электрона
в кулоновском поле ядра.
Потенциальная энергия взаимодействия электрона с яд-ром, обладающим зарядом (для водорода ):
Где – расстояние между электроном и ядром.
Функция графически изображена на графике красной кривой. неограниченно убывающая (возрастаю-щая по модулю) , с уменьшением (при приближении электрона к ядру).
Слайд 33Состояние электрона в атоме водорода описывается вол-новой функцией
удовлетворяющему стационарному уравнению Шредингера:
Где:
– масса электрона
– полная
энергия электрона в атоме
Так как поле, в котором движется электрон, является це-нтрально симметричным, то для решения данного уравнения используют сферическую систему коорди-нат . Не вдаваясь в математическое решение этой задачи, ограничимся рассмотрением важнейших результатов, которые из него следуют, выявив его физический смысл.
Слайд 341.ЭНЕРГИЯ
Подобные уравнения имеют решения удовлетворяющие требованиям однозначности, конечности и непрерыв-ности
волновой функции только при собственных значениях энергии:
То
есть для дискретного набо-
ра отрицательных значений
энергии.
Решение уравнения Шредингера для атома водорода приводит к появлению дискретных энергетических уровней (Е₁, E₂, E₃ и т.д.). Самый нижний уровень Е₁ от-вечающий минимально возможной энергии – ОСНОВ-НОЙ, остальные (Еn>>Е₁ n=2,3,…) ВОЗБУЖДЕННЫЕ.
Слайд 35При движение электрона является связанным – он
находится внутри гиперболической «потенциальной ямы». По мере роста главного квантового
числа n энер-гетические уровни располагаются теснее и при . При движение электрона является свобод-ным, область непрерывного спектра (заштрихова-на) соответствует ионизированному атому.
Энергия ионизации атома водорода:
Выражение для совпадает с формулой полученной Бором для энергии атома водорода. Однако, если Бору пришлось вводить дополнительные гипотезы (посту-латы), то в квантовой механике дискретные значения энергии, являясь следствием самой теории, вытекают непосредственно из уравнения Шредингера.
Слайд 362. КВАНТОВЫЕ ЧИСЛА
В квантовой механике указывалось, что уравнению Шре-дингера удовлетворяют
собственные функции определяемые тремя квантовыми числами: главным , орбитальным
и магнитным .
Главное квантовое число – определяет энергетичес-кие уровни электрона в атоме и может принимать лю-бые целочисленные значения .
Из решения уравнения Шредингера вытекает момент импульса (механический орбитальный момент) элект-рона квантуется, то есть не может быть произвольным, а принимает дискретные значения:
Слайд 37Орбитальное квантовое число – определяет момент импульса электрона
в атоме, при заданном значении принимает значения
то есть всего зна-чений.
Магнитное квантовое число – определяет проекцию момента импульса электрона на заданное направле-ние, причем вектор момента импульса электрона в атоме может иметь в пространстве ориентаций. При заданном значении может принимать значения то есть значений.
Наличие должно привести в магнитном поле к расще-плению уровня с главным квантовым числом на подуровней. Соответственно в спектре атома должно наблюдаться расщепление спектральных линий. (эффект Зеемана).
Слайд 38Хотя энергия электрона и зависит только от главного ква-нтового числа
, но каждому собственному значению
(кроме ) соответствуют несколько собственных функций отличающихся значениями и . Значит, атом может иметь одно и то же значение энергии на-ходясь в нескольких различных состояниях.
Так при данном орбитальное квантовое число может изменяться от 0 до , и каждому значению соот-ветствует различных состояний , то число раз-личных состояний, соответствующих данному равно
Слайд 39Квантовые числа и их значения являются следствием ре-шений уравнения Шредингера
и условий однозначнос-ти, непрерывности и конечности налагаемых на волно-вую функцию
. Кроме того, так как при движении электрона в атоме существенны волновые свойства электрона, квантовая механика отказывается от клас-сического представления о электронных орбитах. Сог-ласно квантовой механике каждому энергетическому состоянию соответствует волновая функция, квадрат модуля которой определяет вероятность обнаружения электрона в единице объема.
Вероятность обнаружения электрона в различных частях атома различна. Электрон при своем движении как бы «размазан» по всему объему, образуя электронное об-лако, плотность (густота) которого характеризует веро-
Слайд 40 ятность нахождения электрона в различных точках объ-ема атома. Квантовые числа
и характеризуют раз-мер и форму электронного облака, а
квантовое число характеризует ориентацию электронного облака в про-странстве.
В атомной физике, по аналогии со спектроскопией, состо-яние электрона, характеризующееся квантовыми чис-лами называют s-состоянием (электрон в этом сос-тоянии называется s-электрон). При – р-состоянием при – d-состоянием, при – f-состоянием,и т.д.
Значение главного квантового числа указывается перед условным обозначением орбитального квантового числа. Например, электроны в состояниях с и обозначаются соответственно символами 2s и 2p.
Слайд 413.СПЕКТР
Квантовые числа позволяют более полно
описать спектр испускания (поглощения) атома водорода полученный в теории Бора.
В
квантовой механике вводятся правила отбора, ограни-чивающие число возможных переходов в атоме, свя-занных с испусканием и поглощением света. Теоретически доказано, что для дипольного излучения электрона движущегося в центрально-симметричном поле ядра могут осуществляться только такие переходы для которых:
Изменение орбитального квантового числа удов-летворяет условию .
Изменение магнитного квантового числа удовлет-воряет условию .
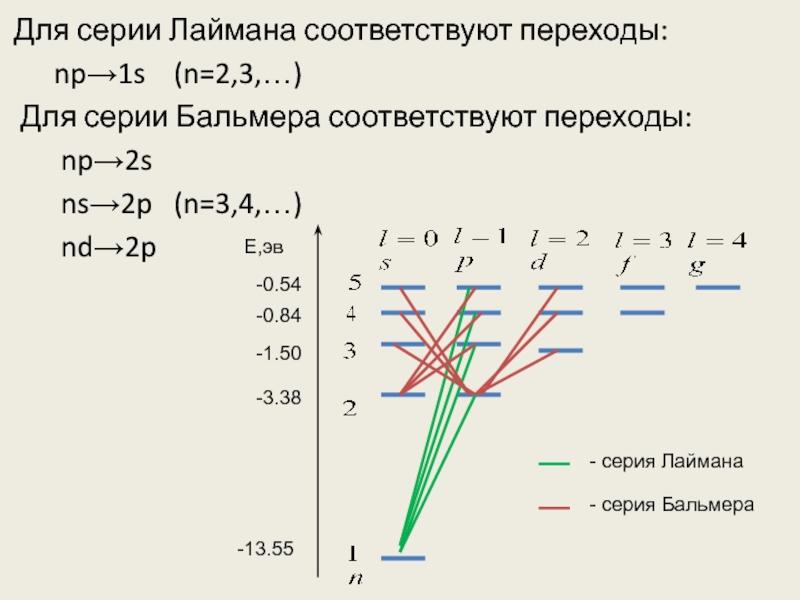
Слайд 42Для серии Лаймана соответствуют переходы:
np→1s (n=2,3,…)
Для серии
Бальмера соответствуют переходы:
np→2s
ns→2p (n=3,4,…)
nd→2p
Слайд 43 Переход электронов из основного состояния в возбуж-денное обусловлен увеличением
энергии атома и мо-жет проходить только при сообщении атому энергии
извне, например за счет поглощения атомом фотона. Так как поглощающий атом находится обычно в воз-
бужденном состоянии, то спектр атома водорода дол-жен состоять из линий соответствующих переходам 1s→np (n=2, 3, …), что находится в полном согласии с опытом.
Возможны иногда и слабые «запрещенные» линии. Нап-ример переход при , но их вероятность ничтожна по сравнению с правильными.
Слайд 44СПИН ЭЛЕКТРОНА
СПИНОВОЕ КВАНТОВОЕ ЧИСЛО
Слайд 45Опыты показали, что узкий пучок атомов водорода, заве-домо находящихся в
s-состоянии, в неоднородном ма-гнитном поле расщепляется на два пучка. В
этом сос-тоянии момент импульса электрона равен нулю. Магнитный момент атома, связанный с орбитальным движением электрона пропорционален механическо-му моменту, поэтому он равен нулю, и магнитное поле не должно оказывать влияние на движение атомов во-дорода в основном состоянии, то есть расщепления быть не должно.
– орбитальный механический момент электрона
Однако в дальнейшем, при применении спектральныхм приборов с большей разрешающей способностью бы-ло доказано,что спектральные линии атомов водорода
Слайд 46 обнаруживают тонкую структуру (являются дуплетами) даже в отсутствие магнитного поля.
Для
объяснения тонкой структуры спектральных линий было предположено что:
Электрон обладает собственным
неуничтожимым меха-ническим моментом импульса , не связанным с дви-жением электрона в пространстве – СПИНОМ.
СПИН электрона (или другой микрочастицы) – квантовая величина, у неё НЕТ классического аналога,это внут-реннее неотъемлимое свойство электрона, подобное его заряду и массе.
Если электрону приписывается собственный механичес-кий момент импульса (спин) , то ему соответствует собственный магнитный момент
Слайд 47По общим выводам квантовой механики спин квантуется по закону:
Где:
– спиновое квантовое число
По аналогии с орбитальным моментом импульса,
проек-ция может принимать значений. Так как в опы-тах Штерна и Герлаха наблюдались только две ориен-тации, то . Проекция спина на направ-ление внешнего магнитного поля, являясь квантовой величиной, определяется выражением
Где:
– магнитное спиновое число. Которое может иметь только 2 значения:
Слайд 48Таким образом микрочастицы необходимо охарактери-зовать дополнительной внутренней степенью свобо-ды. И
для полного описания состояния электрона в атоме наряду с главным,
орбитальным и магнитным квантовыми числами необходимо задавать ещё и маг-нитное спиновое квантовое число.
Слайд 49ПРИНЦИП НЕРАЗЛИЧИМОСТИ ТОЖДЕСТВЕННЫХ ЧАСТИЦ
Слайд 50Если перейти от рассмотрения одной микрочастицы (эле-ктрона) к многоэлектронным системам,
то проявляют-ся особые свойства НЕ ИМЕЮЩИЕ АНАЛОГОВ в класси-ческой физике.
Пусть квантово-механическая система состоит из одинаковых частиц , (например электронов), имеющих одинаковые характеристики (спин, массу, электрический заряд и другие внутренние характерис-тики (например квантовые числа)) . Такие частицы назы-аются тождественными.
Существует фундаментальный механизм квантовой меха-ники – ПРИНЦИП НЕРАЗЛИЧИМОСТИ ТОЖДЕСТВЕННЫХ ЧАСТИЦ: невозможно экспериментально различить тождественные частицы.
Слайд 51В классической механике даже одинаковые частицы мо-жно различить, например по
положению в пространст-ве или импульсам, можно проследить за траекторией каждой
частицы, и классическая механика систем сос-тоящих из одинаковых частиц не отличается от механи-ки систем состоящих из различных частиц.
В квантовой механике из соотношения неопределеннос-тей вытекает, что для микрочастиц вообще непримени-мо понятие траектории; состояние микрочастицы опи-сывается волновой функцией, позволяющей опреде-лить лишь вероятность нахождения микрочастицы в той или иной точке пространства. Если же волновые функции двух тождественных частиц в пространстве перекрываются, то можно лишь говорить о вероятнос-ти нахождения в данной области одной из тождествен-
Слайд 52 ных частиц. Таким образом в квантовой механике тожде-ственные частицы полностью
теряют свою индивидуаль-ность и становятся неразличимыми.
Принцип неразличимости вводится в квантовую
механику как новый принцип являющийся фундаментальным.
Принцип неразличимости можно записать в виде:
– совокупность пространственных и спиновых коор-динат первой и второй частиц.
Принцип неразличимости тождественных частиц ведёт к определённому свойству симметрии волновой функции. Если при перемене частиц местами волновая функция не меняет знака, то она симметричная , если же меняет, то она антисимметричная.
Слайд 53Симметрия или антисимметрия определяется спином час-тиц. Частицы с полуцелым спином
(электроны, протоны, нейтроны) описываются антисимметричными волновы-ми функциями и подчиняются статистике
Ферми-Дирака. Эти частицы называются фермионами.
Частицы с нулевым или целочисленным спином (фотоны, π-мезоны) описываются симметричными волновыми функциями и подчиняются статистике Бозе-Эйнштейна, они называются бозонами.
Сложные частицы (например атомные ядра), состоящие из нечетного числа фермионов, являются фермионами (сум-марный спин полуцелый), а из четного числа – бозонами (суммарный спин – целый ).
Зависимость характера симметрии волновых функций сис-темы тождественных частиц от спина частиц обоснована В. Паули.(1900-1958).
Слайд 54ПРИНЦИП ПАУЛИ. РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ В АТОМЕ ПО СОСТОЯНИЯМ
Слайд 55Если тождественные частицы имеют одинаковые квантовые числа, то их волновая
функция симметрична относительно перестановки частиц. Значит, два одинаковых фермиона, входяхих
в одну систему не могут находится в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметрична.
Обобщая опытные данные, Паули сформулировал принцип:
Системы фермионов встречаются в природе только в состо-яниях описываемых антисимметричными волновыми функциями. (квантово-механическая формулировка принципа Паули).
Существует более простая формулировка принципа Паули:
В системе одинаковых фермионов любые два из них не мо-гут одновременно находиться в одном и том же состоянии (число однотипных бозонов в одном и том же состоянии не ограничено).
Слайд 56Состояние электрона в атоме однозначно определяется набором четырёх квантовых чисел:
Главного
Орбитального
Магнитного
Магнитного спинового
Распределение электронов в атоме подчиняется принци-пу Паули:
в одном и том же атоме не может быть более одного электрона с одинаковым набором четырёх квантовых чисел то есть:
Где – число электронов находящихся в кван-товом состоянии, описываемом набором четырёх квантовых чисел, и принцип Паули утверждает, что два
Слайд 57 электрона, связанные в одном и том же атоме, разли-чаются значениями
по крайней мере одного квантово-го числа.
Данному соответствует
различных состояний, отли-чающихся значениями и . Квантовое число при-нимает два значения, значит число электронов нахо-дящихся в состояниях определяемых данным главным квантовым числом:
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число на-зывают – электронной оболочкой.
В каждой из электронных оболочек электроны распреде-
Слайд 58 ляются по подоболочкам соответствующих данному . Так как орбитальное
квантовое число принимает зна-чения от 0 до
, число подоболочек равно порядко-вому номеру оболочки . Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами, максимальное число электронов в подоболочке с данным равно .
Слайд 59ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
Слайд 60Принцип Паули, лежащий в основе систематики заполне-ния электронных состояний в
атомах, позволяет объяс-нить ПЕРИОДИЧЕСКУЮ СИСТЕМУ Д. И. МЕНДЕЛЕЕВА (1869) –
фундаментальный закон природы.
Д. И. Менделеев ввёл понятие порядкового номера хи-мического элемента Z , равному числу протонов в ядре и общему числу электронов в электронной оболочке атома. Расположив химические элементы по мере воз-растания порядковых номеров, он получил периодич-ность в изменении химических свойств элементов.
Так как химические и некоторые физические свойства элементов объясняются внешними (валентными) элек- тронами в атомах, то периодичность свойств химичес-ких элементов должна быть связана с периодичностью расположения электронов в атомах. Будем считать что
Слайд 61 каждый следующий элемент образован из предыдуще-го прибавлением к ядру одного
протона, и электрона в электронную оболочку. Взаимодействием электронов пренебрегаем. Рассмотрим
атомы химических элемен-тов в основном состоянии.
Для водорода Н единственный электрон находится в состоянии 1s, характеризуемом квантовыми числами: (ориентация спина произвольна).
Оба электрона атома гелия Нe находятся в состоянии 1s, но с антипараллельной организацией спина. Элект-ронная конфигурация записывается как 1s² (2-1s элект-рона). На гелии заканчивается заполнение К-оболочки, что соответствует завершению I периода Периоди-ческой системы Менделеева.
Слайд 62Третий электрон атома лития Li (Z=3), согласно принци-пу Паули уже
не может разместиться в целиком запол-неной К-оболочке и занимает наинизшее
энергетиче-ское состояние с (L-оболочка), то есть 2s состоя-ние. Электронная конфигурация для атома лития 1s²2s. Атомом лития открывается второй период периоди-ческой системы Менделеева. Четвертым электроном бериллия Ве (Z=4) заканчивается заполнение оболочки 2s и так далее…
Таким образом, открытая Менделеевым периодичность в химических свойствах элементов объясняется повто-ряемостью в структуре внешних оболочек у атомов родственных элементов.