Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекции: ЭНЗИМОЛОГИЯ
Содержание
- 1. Лекции: ЭНЗИМОЛОГИЯ
- 2. ЛЕКЦИЯ № 3КЛИНИЧЕСКАЯ ЭНЗИМОЛОГИЯ, или ИСПОЛЬЗОВАНИЕ ФЕРМЕНТОВ В МЕДИЦИНЕ
- 3. Актуальность темыШирокое использование ферментов в медицинской практике
- 4. План лекцииПрименение ферментов как реагентов в диагностике
- 5. Цель лекцииЗнать:пути использования ферментов в медицинской практике
- 6. Ферменты как реагентыПРИМЕРЫ:Глюкозооксидаза грибов (аэробная дегидрогеназа )
- 7. Ферменты как реагентыОпределение лактата в крови для
- 8. Ферменты как реагентыРестриктазы бактерий (специфические эндонуклеазы) используются
- 9. ЭнзимотерапияПрименение ферментов (гидролазы)в качестве лекарственных препаратов Заместительная
- 10. ЭнзимотерапияКомплексная терапия – применение ферментов в качестве
- 11. Энзимотерапияколлагеназа (преп. коллализин)- рассасывание спаек и рубцов
- 12. Энзимотерапиятрипсин, химотрипсин – лечение гнойно-некротических ран, эмфиземы
- 13. Энзимотерапияаспарагиназа, глутаминаза – лечение лейкозовЛейкозные клетки не
- 14. Трудности энзимотерапиинестабильность ферментовантигенные свойстватрудности доставки к пораженным
- 15. Иммобилизованные ферментыИммобилизация (лат. immobilis – неподвижный) –
- 16. Использование иммобилизованных ферментов: примерыИммобилизация протеолитических ферментов на
- 17. ЭнзимодиагностикаПостановка диагноза на основе определения активности ферментов
- 18. Секреторные ферментысинтезируются в печени«работают» в крови (субстрат
- 19. Экскреторные ферментысинтезируются в экзокринных железах«работают» в полости
- 20. Внутриклеточные ферменты:цитоплазматические: лактатдегидрогеназа (ЛДГ), аланин (аспартат)
- 21. «Требования» к ферментам энзимодиагностикиОрганоспецифичность (тканеспецифичность) фермента
- 22. ИзоферментыМножественные формы одного олигомерного фермента (имеющего IV
- 23. Пример изоферментовТип катализируемой реакции: перенос фосфатной группы с АТФ на гексозы
- 24. Изоформы в диагностике заболеванийЛактатдегидрогеназа (ЛДГ)пируват + NADH+Н+
- 25. Слайд 25
- 26. Лактатдегидрогеназа 1 и 2 – сердечные изоформыСпецифичность
- 27. Изоформы в диагностике заболеванийКреатинкиназа (КК)креатин + АТФ
- 28. КК-ММ (скелетная мышца) – диагностика повреждений скелетных
- 29. Почему важно определять изоферментный состав, а не
- 30. Основные ферменты энзимодиагностики патологии сердца, сопровождающейся цитолизом
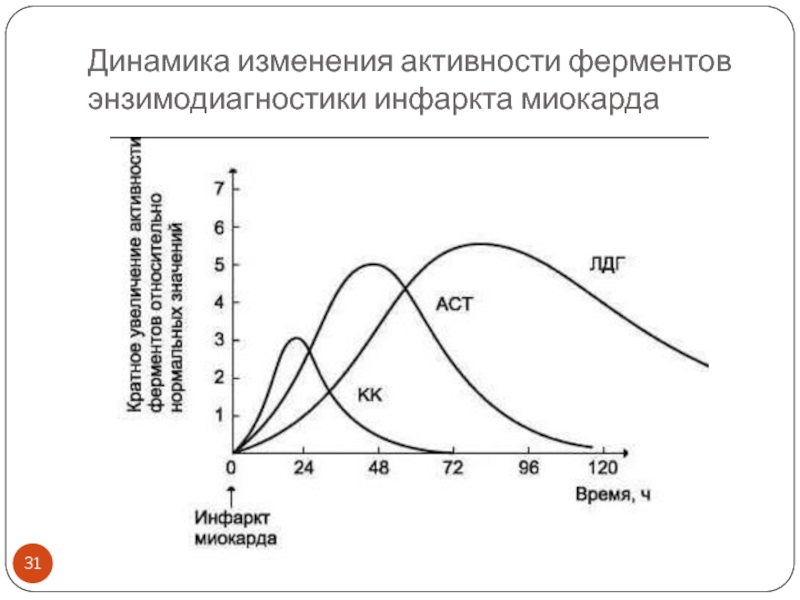
- 31. Динамика изменения активности ферментов энзимодиагностики инфаркта миокарда
- 32. Динамика изменения активности АСТ и АЛТ при инфаркте миокарда
- 33. Основные ферменты энзимодиагностики патологии печениВоспаление, цитолиз, некроз
- 34. Динамика изменения активности АЛТ и АСТ при вирусном гепатите
- 35. Основные ферменты энзимодиагностики патологии печениСиндром холестазаПовышается активность
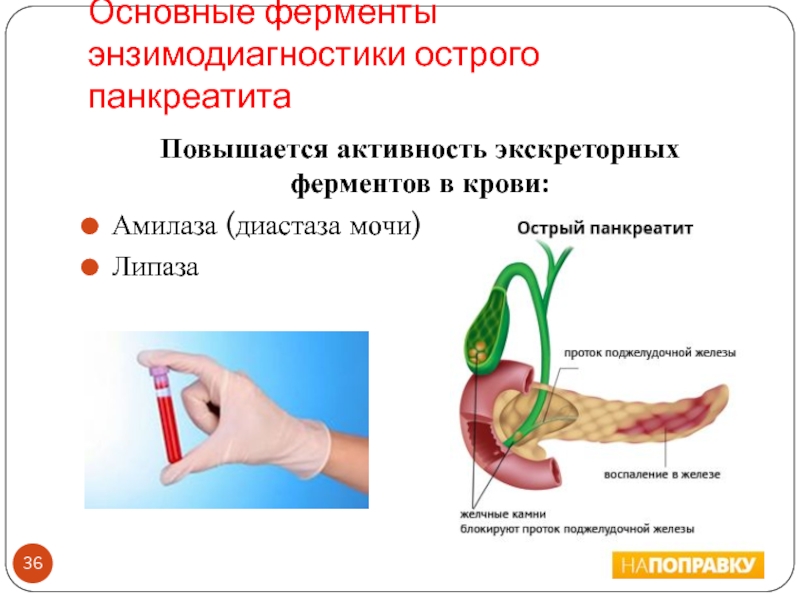
- 36. Основные ферменты энзимодиагностики острого панкреатитаПовышается активность экскреторных ферментов в крови:Амилаза (диастаза мочи) Липаза
- 37. Дополнительные вопросы клинической энзимологииИспользование ингибиторов ферментов в качестве лекарственных препаратовЭнзимопатии
- 38. Использование ингибиторов ферментовИнгибиторы протеаз в терапии острых панкреатитов (контрикал, трасилол, пантрипин и др.)
- 39. Использование ингибиторов ферментовИнгибиторы протеаз в терапии HCV
- 40. Использование ингибиторов ферментовИнгибиторы ангиотензин-превращающего фермента – лечение
- 41. ЭнзимопатииПатологические процессы, основанные на нарушении ферментативного катализа
- 42. Задание № 1 для самостоятельной работыВ
- 43. Задание № 2 для самостоятельной работы Используя интернет-ресурсы, заполните таблицу «Ферменты энзимодиагностики» и определите класс фермента
- 44. ВОПРОСЫ ДЛЯ РАЗМЫШЛЕНИЯПочему активность аминотрансфераз у детей
- 45. ЗаключениеФерменты используются в диагностике заболеваний как специфические
- 46. ЛитератураБиохимия: учебник для вузов / ред. Е.
- 47. Скачать презентанцию
ЛЕКЦИЯ № 3КЛИНИЧЕСКАЯ ЭНЗИМОЛОГИЯ, или ИСПОЛЬЗОВАНИЕ ФЕРМЕНТОВ В МЕДИЦИНЕ
Слайды и текст этой презентации
Слайд 1
Дисциплина: биохимия (Б1.Б.15)
Специальность: педиатрия (31.05.02)
НГМУ, кафедра медицинской химии
Д.б.н., доцент Суменкова
Дина Валерьевна
Слайд 3Актуальность темы
Широкое использование ферментов в медицинской практике – диагностике и
терапии, - диктует необходимость изучения клинических аспектов энзимологии
Слайд 4План лекции
Применение ферментов как реагентов в диагностике заболеваний
Применение ферментов в
качестве лекарственных препаратов (энзимотерапия)
Исследование активности ферментов для диагностики заболеваний (энзимодиагностика)
Дополнительные
вопросы клинической энзимологии:Использование ингибиторов ферментов в качестве лекарственных препаратов
Энзимопатии
Слайд 5Цель лекции
Знать:
пути использования ферментов в медицинской практике (примеры)
ферменты, используемые
в энзимодиагностике, и сущность катализируемых ими химических реакций
На основе полученных
знаний формируется умение трактовать данные энзимологических исследований сыворотки крови детей и подростков(биохимический анализ крови)Слайд 6Ферменты как реагенты
ПРИМЕРЫ:
Глюкозооксидаза грибов (аэробная дегидрогеназа ) – FAD-содержащий специфический
фермент для определения глюкозы в моче и крови
Используется в глюкозооксидазных
биосенсорахβ-D-глюкоза + O2 → глюконолактон + Н2О2
Н2О2 в присутствии ионов меди окисляет фенолфталин до фенолфталеина (красный цвет при рН>7, интенсивность окраски пропорциональна концентрации перекиси и глюкозы)
Слайд 7Ферменты как реагенты
Определение лактата в крови для оценки тяжести шока,
гипоксических состояний, сахарного диабета с помощью
лактатоксидазы и пероксидазы
Лактат + O2
→ пируват + Н2О2Н2О2 + 4-аминоантипирин + фенол → окрашенный комплекс
(интенсивность окраски пропорциональна содержанию лактата)
Слайд 8Ферменты как реагенты
Рестриктазы бактерий (специфические эндонуклеазы) используются для исследования генома,
например, в пренатальном скрининге наследственных заболеваний
Taq-полимераза термофилов (Thermus aquaticus)
необходима для проведения ПЦР-анализа в диагностике наследственных и инфекционных заболеваний, определении родства, судебной медицинеСлайд 9Энзимотерапия
Применение ферментов (гидролазы)
в качестве лекарственных препаратов Заместительная терапия – использование
ферментов в случае их недостаточности
ПРИМЕРЫ:
лечение желудочно-кишечных заболеваний, связанных с недостаточностью
секреции пищеварительных соковПрепараты панкреатических ферментов трипсина, амилазы, липазы: энзистал, мезим форте, фестал, панкреатин, пензитал
Слайд 10Энзимотерапия
Комплексная терапия – применение ферментов в качестве дополнительного терапевтического средства
ПРИМЕРЫ:
фитогидролазы:
бромелаин, папаин (широкая субстратная специфичность, широкий диапазон рН)– пищеварение, косметология,
рассасывание тромбов, активация иммунитета, удаление «сшивок» между биополимерамиСлайд 11Энзимотерапия
коллагеназа (преп. коллализин)- рассасывание спаек и рубцов (фиброзных процессов) после
ожогов и операций
гиалуронидаза (преп. лидаза)- лечение фиброзных процессов, увеличение проницаемости
тканей для анестетиковСлайд 12Энзимотерапия
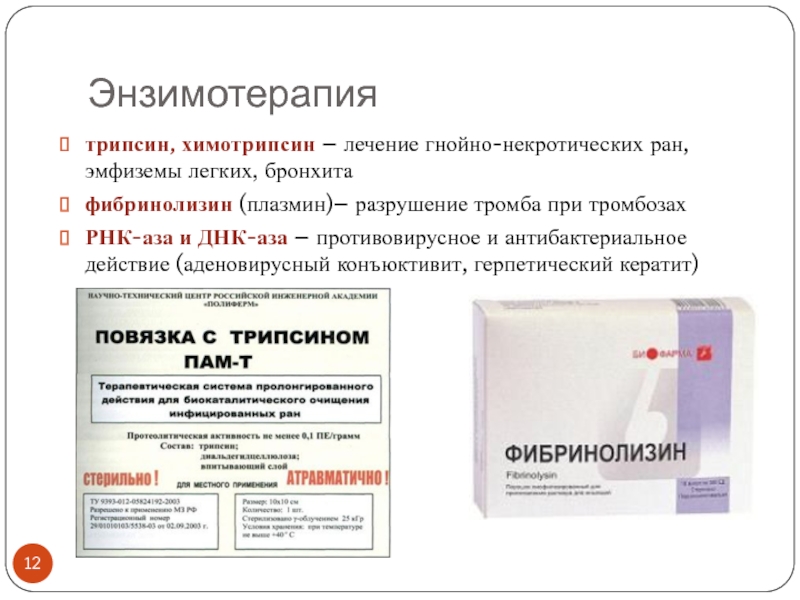
трипсин, химотрипсин – лечение гнойно-некротических ран, эмфиземы легких, бронхита
фибринолизин (плазмин)–
разрушение тромба при тромбозах
РНК-аза и ДНК-аза – противовирусное и антибактериальное
действие (аденовирусный конъюктивит, герпетический кератит)Слайд 13Энзимотерапия
аспарагиназа, глутаминаза – лечение лейкозов
Лейкозные клетки не способны синтезировать асн
и глн – аминокислоты, содержащие амидные группы, поэтому получают их
из крови. Гидролитическое дезаминирвание данных аминокислот с образованием аспартата и глутамата ограничивает опухолевые клетки в незаменимых для них аминокислотах, что и приводит к нарушению роста опухолиСлайд 14Трудности энзимотерапии
нестабильность ферментов
антигенные свойства
трудности доставки к пораженным органам
ПРИМЕР: действие фибринолизина
не является строго специфичным (только для белка фибрина – основы
тромба), он может повреждать факторы свертывания крови, вызывая геморрагический диатезПути решения проблем
Направленный транспорт ферментов
Использование иммобилизованных ферментов
Слайд 15Иммобилизованные ферменты
Иммобилизация (лат. immobilis – неподвижный) – связывание молекул ферментов
с носителем
Преимущества: устойчивость, нерастворимость в воде, пролонгированное действие, возможность многократного
использованияНоситель: полимер (целлюлоза, сефароза, агароза, полиакриламид)
Способы иммобилизации:
образование ковалентных и нековалентных связей с носителем
полимеризация носителя в присутствии фермента
инкапсулирование (например, включение в липосому)
Слайд 16Использование иммобилизованных ферментов: примеры
Иммобилизация протеолитических ферментов на целлюлозе: повязки, тампоны
для обработки и лечения ран (см. слайд 12, повязка с
трипсином на диальдегидцеллюлозе)Иммобилизация ферментов на колонках для экстракорпоральной перфузии крови типа «искусственная почка», «искусственная печень»
Слайд 17Энзимодиагностика
Постановка диагноза на основе определения активности ферментов в биологических жидкостях
человека
Используются ферменты, которые по месту «работы» делят на 3 группы:
СЕКРЕТОРНЫЕ
ЭКСКРЕТОРНЫЕ
ВНУТРИКЛЕТОЧНЫЕ
Слайд 18Секреторные ферменты
синтезируются в печени
«работают» в крови (субстрат фермента находится в
крови)
активность в крови выше, чем в ткани
Характеризуют белок-синтезирующую функцию печени:
снижение активности свидетельствует о патологии печени, на фоне которой нарушается синтез белковПРИМЕРЫ:
псевдохолинэстераза (ПХЭ)
проферменты свертывающей системы крови (факторы свертывания крови)
Слайд 19Экскреторные ферменты
синтезируются в экзокринных железах
«работают» в полости органов
активность в крови
незначительная и обусловлена диффузией фермента
Активность в крови повышается при
остром воспалении железы и, как следствие, затруднении оттока секрета в полость органаПРИМЕРЫ:
щелочная фосфатаза печени (маркер синдрома холестаза, например, при желчнокаменной болезни)
амилаза и липаза поджелудочной железы (маркеры острого панкреатита)
Слайд 20 Внутриклеточные ферменты:
цитоплазматические: лактатдегидрогеназа (ЛДГ), аланин (аспартат) аминотрансфераза (АЛТ, АСТ),
креатинкиназа (КК)
митохондриальные: АСТ
лизосомные: кислая фосфатаза
Активность в ткани высокая
Активность в крови
незначительная и является следствием нормально идущих процессов разрушения клеток (например, эритроцитов), повышенной проницаемости мембран в детском возрасте, выполнения тяжелой физической работы (повышение активности креатинкиназы)Значительное повышение активности в крови – признак патологии (воспаление, цитолиз, некроз)
Незначительное повышение в крови цитозольных ферментов свидетельствует о воспалительном процессе, их резкое повышение – о цитолизе
Повышение в крови митохондриальных или ядерных ферментов – результат некроза
Слайд 21 «Требования» к ферментам энзимодиагностики
Органоспецифичность (тканеспецифичность) фермента или его изоформ:
преимущественная или абсолютная локализация в определенных органах
ПРИМЕРЫ:
панкреатическая липаза
печеночная гистидаза и
аргиназаЛДГ1 и ЛДГ2 кардиомиоцитов
неспецифические ферменты АЛТ и АСТ присутствуют во многих органах, но основным источником повышения их активности в крови являются патологии печени и сердца
Количество высвобождаемого в кровь фермента должно быть пропорционально степени повреждения ткани и достаточно для определения его активности
Стабильная активность ферментов в течение достаточно длительного времени (сутки)
Слайд 22Изоферменты
Множественные формы одного олигомерного фермента (имеющего IV структуру), обусловленные различными
комбинациями разных по структуре субъединиц
катализируют одну и ту же реакцию
Различия
изоформфизико-химические свойства (так как разная I структура, М.м., заряд)
органоспецифичность
субстратная специфичность
активность
способы регуляции, чувствительность к ингибиторам и активаторам
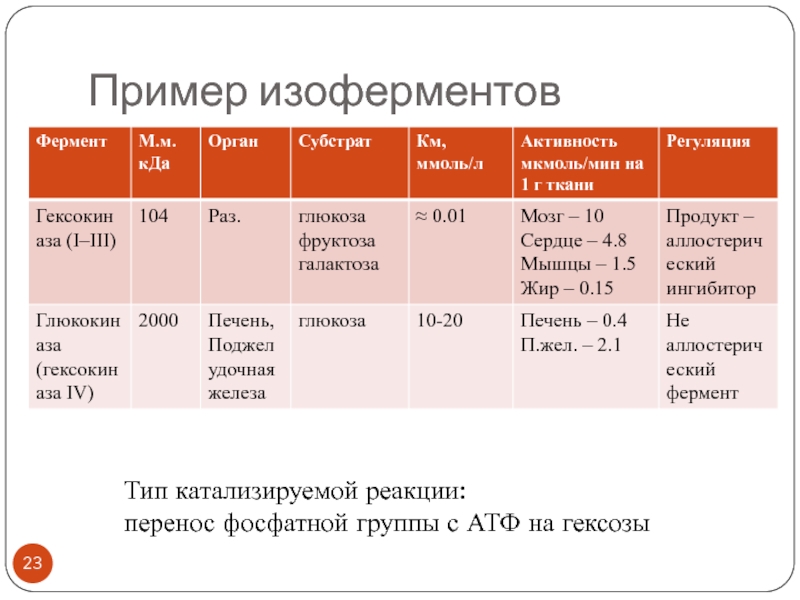
Слайд 24Изоформы в диагностике заболеваний
Лактатдегидрогеназа (ЛДГ)
пируват + NADH+Н+ ↔ лактат +
NAD+
Охарактеризуйте положение фермента в классификаторе!
Внутриклеточный фермент
Диагностика патологии сердца, печени, мышц
Олигомерный
белок: 4 субъединицы двух типовМ (англ. muscle – мышца)
Н (англ. heart – сердце)
Назовите возможные комбинации субъединиц, образующие 5 изоформ, и предположите органы их преимущественной локализации!
Слайд 26Лактатдегидрогеназа 1 и 2 – сердечные изоформы
Специфичность ЛДГ 1 и
2 выше к лактату, чем к пирувату, т.е. данные изоформы
катализируют реакцию «лактат → пируват» при поступлении лактата из крови, где его постоянным источником являются эритроциты. Таким образом лактат используется кардиомиоцитами как источник энергии (АТФ образуется при дальнейшем катаболизме пирувата).Реакция «пируват → лактат» протекает при анаэробном гликолизе. Так как в кардиомиоцитах гликолиз преимущественно аэробный, активность ЛДГ других изоформ невысокая.
Определение активности ЛДГ 1 и 2 используют в диагностике инфаркта миокарда на более поздних сроках после болевого приступа (через 2-3 суток), а также в динамике восстановления: чем быстрее нормализуется активность фермента, тем лучше.
Слайд 27Изоформы в диагностике заболеваний
Креатинкиназа (КК)
креатин + АТФ ↔ креатинфосфат +
АДФ
Охарактеризуйте положение фермента в классификаторе!
Креатинфосфат – энергетический субстрат в мышечной
и нервной тканяхВнутриклеточный фермент
Олигомерный белок: димер из субъединиц 2-х типов
М (англ. muscle – мышца)
В (англ. brain – мозг)
Назовите возможные комбинации субъединиц, образующие 3 изоформы и предположите орган их преимущественной локализации!
Слайд 28КК-ММ (скелетная мышца) – диагностика повреждений скелетных мышц
КК-МВ (сердечная мышца)
– диагностика инфаркта миокарда
КК-ВВ (головной мозг) – не проникает через
гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах (не имеет диагностического значения)Слайд 29Почему важно определять изоферментный состав, а не просто суммарную активность
фермента?
Суммарная активность фермента не предоставляет информации о локализации патологического процесса.
Так, например, суммарная активность ЛДГ может быть повышена при патологиях различных органов.
А в некоторых случаях суммарная активность фермента не предоставляет информации даже о наличии патологического процесса. ПРИМЕР: болезнь Тея-Сакса (ганглиозидоз)
Причина: нарушение синтеза α-субъединиц гексозоаминидазы → снижение активности изоформы А
Изоформа А (2α2β)
Изоформа В (4β)
Суммарная активность фермента при данной патологии оказывается нормальной (за счет компенсаторного повышения синтеза субъединицы β и, как следствие, повышенной концентрации изоформы В)
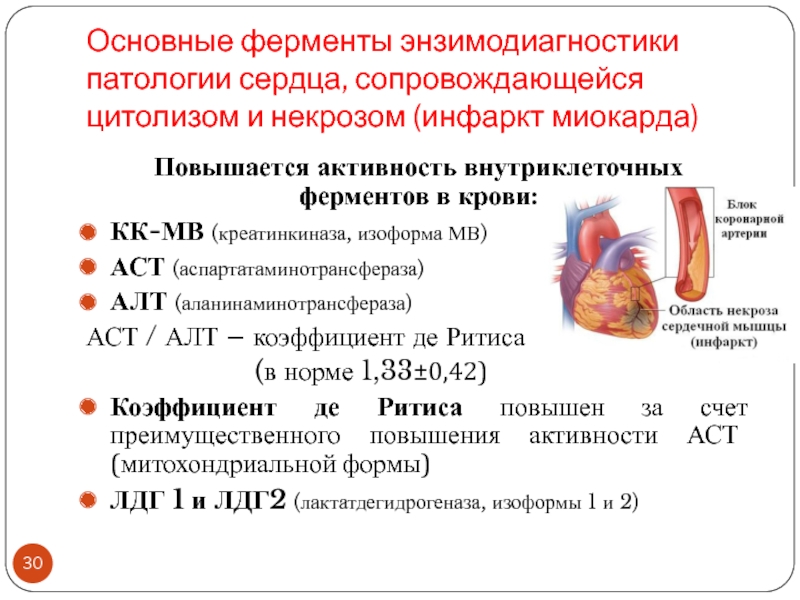
Слайд 30Основные ферменты энзимодиагностики патологии сердца, сопровождающейся цитолизом и некрозом (инфаркт
миокарда)
Повышается активность внутриклеточных ферментов в крови:
КК-МВ (креатинкиназа, изоформа МВ)
АСТ (аспартатаминотрансфераза)
АЛТ
(аланинаминотрансфераза)АСТ / АЛТ – коэффициент де Ритиса
(в норме 1,33±0,42)
Коэффициент де Ритиса повышен за счет преимущественного повышения активности АСТ (митохондриальной формы)
ЛДГ 1 и ЛДГ2 (лактатдегидрогеназа, изоформы 1 и 2)
Слайд 33Основные ферменты энзимодиагностики патологии печени
Воспаление, цитолиз, некроз (гепатит, цирроз)
Повышается активность
внутриклеточных ферментов в крови:
АЛТ, АСТ
Коэффициент де Ритиса при вирусном гепатите
< 1 за счет преимущественного повышения цитозольного АЛТ вследствие цитолиза при сохранении целостности внутриклеточных органоидов Коэффициент де Ритиса при циррозе ≈ 1 на фоне высокой активности обоих ферментов за счет «выхода» АСТ из разрушенных митохондрий
ЛДГ 4, ЛДГ 5
Слайд 35Основные ферменты энзимодиагностики патологии печени
Синдром холестаза
Повышается активность экскреторного фермента печени
в крови – ЩФ (печеночной изоформы щелочной фофатазы – гидролазы
фосфоэфирных связей)Повышается активность ГГТ, или ГГТП (гамма-глутамил трансферазы, или транспептидазы) – фермента цитоплазматической мембраны клеток различных органов, участвующего в транспорте аминокислот в клетку. Причина повышения активности ГГТ при холестазе – отщепление фермента от ЦПМ под действием желчных кислот.
ГГТ является также маркёром алкогольной болезни печени.
Слайд 36Основные ферменты энзимодиагностики острого панкреатита
Повышается активность экскреторных ферментов в крови:
Амилаза
(диастаза мочи)
Липаза
Слайд 37Дополнительные вопросы клинической энзимологии
Использование ингибиторов ферментов в качестве лекарственных препаратов
Энзимопатии
Слайд 38Использование ингибиторов ферментов
Ингибиторы протеаз в терапии острых панкреатитов (контрикал, трасилол,
пантрипин и др.)
Слайд 39Использование ингибиторов ферментов
Ингибиторы протеаз в терапии HCV инфекции - новый
класс препаратов для лечения гепатита С
Действие препаратов направлено непосредственно на
вирус гепатита: они подавляют или блокируют ключевые внутриклеточные этапы размножения вирусаВ настоящее время одобрено использование препаратов: симепревир (Россия), телапревир (Incivek) и боцепревир (Victrelis) (США, страны ЕС). Их применение в составе комбинированной терапии существенно повышает эффективность лечения пациентов.
Слайд 40Использование ингибиторов ферментов
Ингибиторы ангиотензин-превращающего фермента – лечение гипертонии (берлиприл, вазолонг
и др.)
Ингибиторы ксантиноксидазы – лечение падагры (аллопуринол)
Ингибиторы ферментов синтеза нуклеотидов
и нуклеиновых кислот – лечение бактериальных, вирусных инфекций, онкологических заболеваний, напримерингибиторы обратной транскриптазы – лечение ВИЧ-инфекции
Слайд 41Энзимопатии
Патологические процессы, основанные на нарушении ферментативного катализа по причине мутации
генов ферментов или нарушения экспрессии (синтеза фермента)
первичные (наследственные)
нарушается образование конечного
продуктаПРИМЕР: Альбинизм
нарушение синтеза меланина из-за дефекта тирозиназы
накапливаются токсические метаболиты
ПРИМЕР: Фенилкетонурия
снижение образование тирозина из фенилаланина из-за недостатка фенилаланингидроксилазы приводит к накоплению фенилпирувата и фенилацетата → токсическое действие на мозг
нарушение транспорта тир в мозг → снижение синтеза дофамина, норадреналина
вторичные (приобретенные)
Слайд 42Задание № 1
для самостоятельной работы
В современной клинической лабораторной диагностике
широко используется метод иммуноферментного анализа (ИФА). Используя интернет-ресурсы, изучите информацию
о данном методе и составьте конспект по вопросам:1. Принцип метода ИФА.
2. Роль ферментов как реагентов в ИФА-диагностике.
3. Значение ИФА в диагностике заболеваний.
Слайд 43Задание № 2 для самостоятельной работы Используя интернет-ресурсы, заполните таблицу «Ферменты
энзимодиагностики» и определите класс фермента
Слайд 44ВОПРОСЫ ДЛЯ РАЗМЫШЛЕНИЯ
Почему активность аминотрансфераз у детей раннего возраста выше,
чем у взрослых?
Почему активность псевдохолинэстеразы у детей раннего возраста ниже,
чем у взрослых?Почему активность щелочной фосфатазы костной ткани у детей, выше чем у взрослых?
Слайд 45Заключение
Ферменты используются в диагностике заболеваний как специфические реагенты
Препараты ферментов используются
в заместительной и комплексной терапии
Определение активности ферментов – важный
этап диагностики заболеваний, а также контроля эффективности проводимой терапииВ основе многих наследственных заболеваний лежит нарушение ферментативного катализа
Слайд 46Литература
Биохимия: учебник для вузов / ред. Е. С. Северин. -
М.: ГЭОТАР-Медиа, 2014. -768 с.
Биологическая химия с упражнениями и
задачами: учебник / ред. С.Е. Северин. – М.: ГЭОТАР-Медиа, 2013. -624 с. (С. 99-103) Биологическая химия: учебник для студентов медицинских вузов / А.Я. Николаев. – М.: Мед. информ. агенство, 2007. – 568 с.
Клиническая биохимия: электронное учебное издание / Новосиб. гос.мед.ун-т; сост. И. В. Пикалов [и др.]. - Новосибирск: Центр очно-заочного образования ГОУ ВПО НГМУ Росздрава, 2008