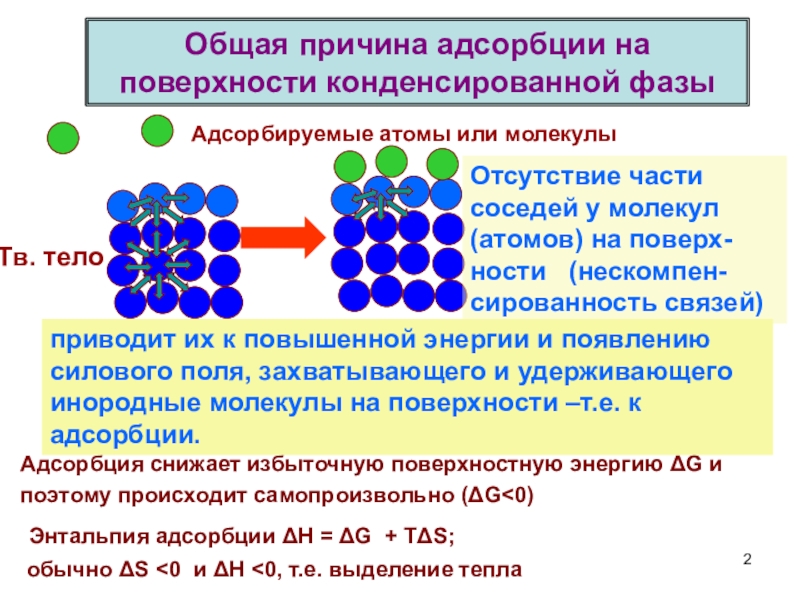
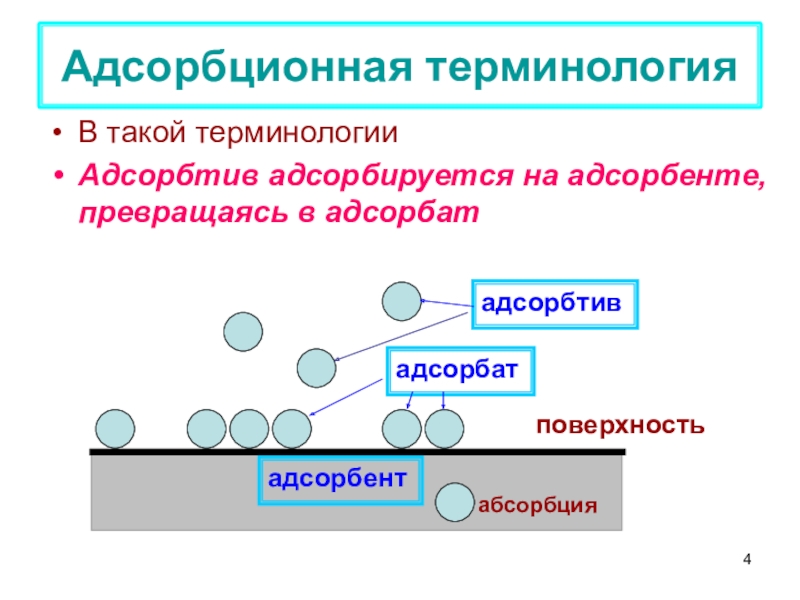
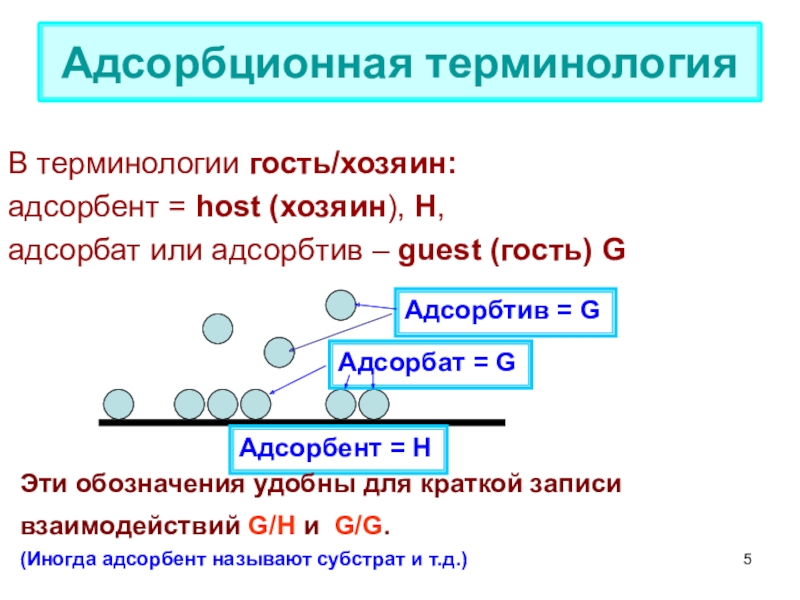
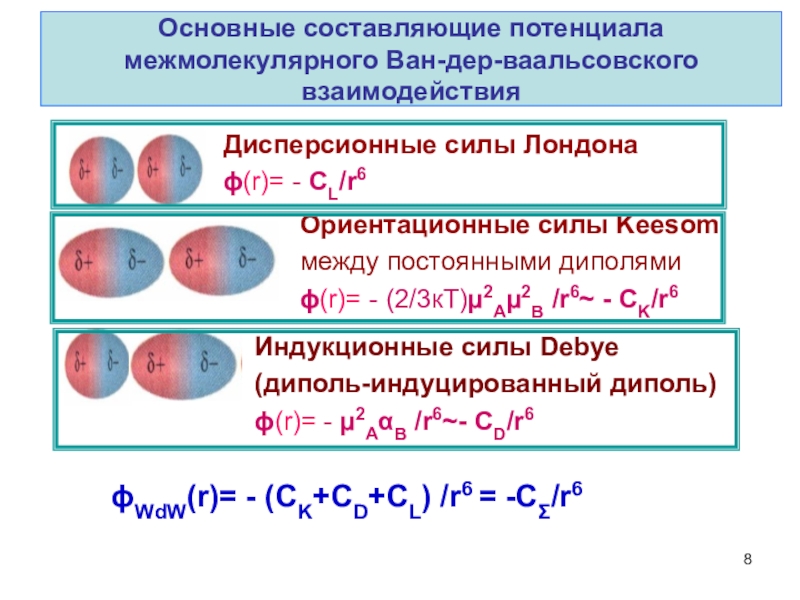
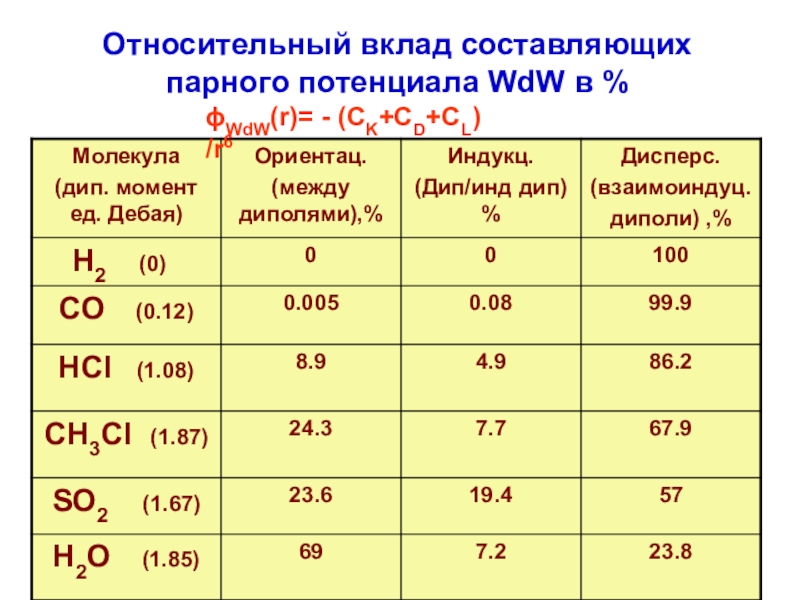
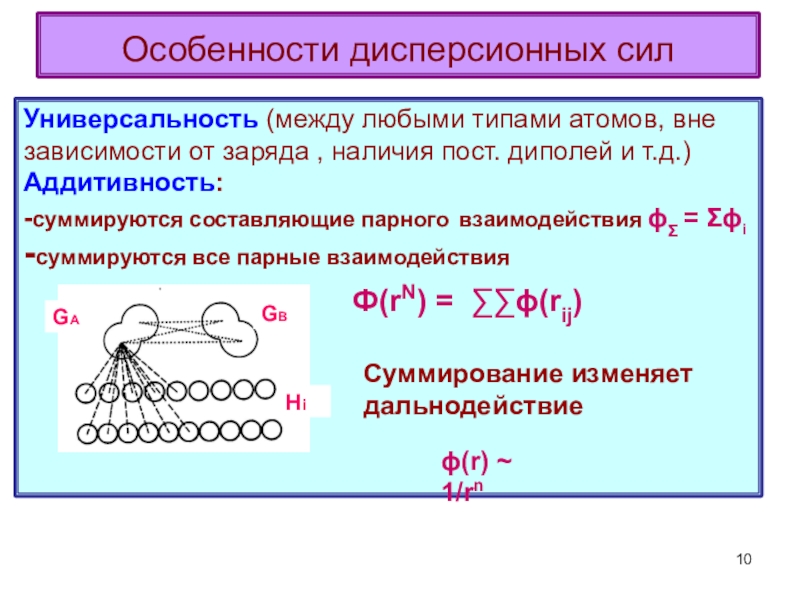
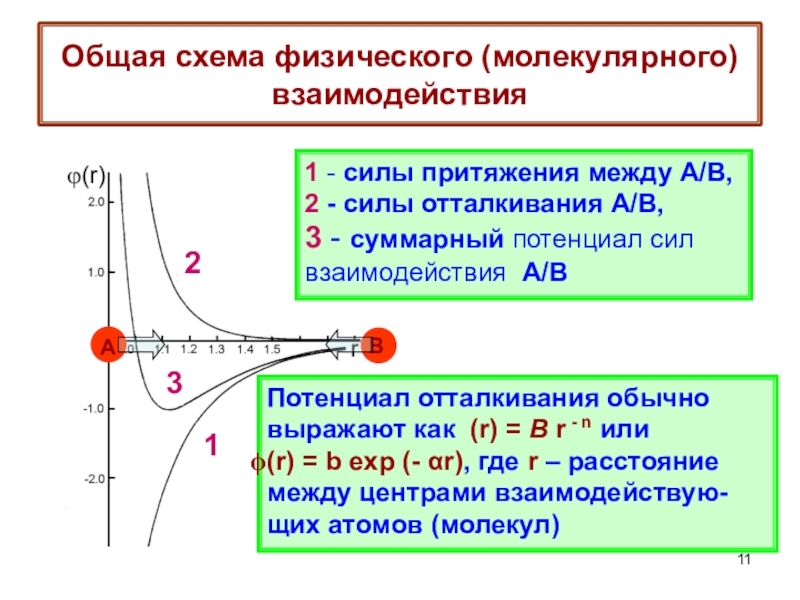
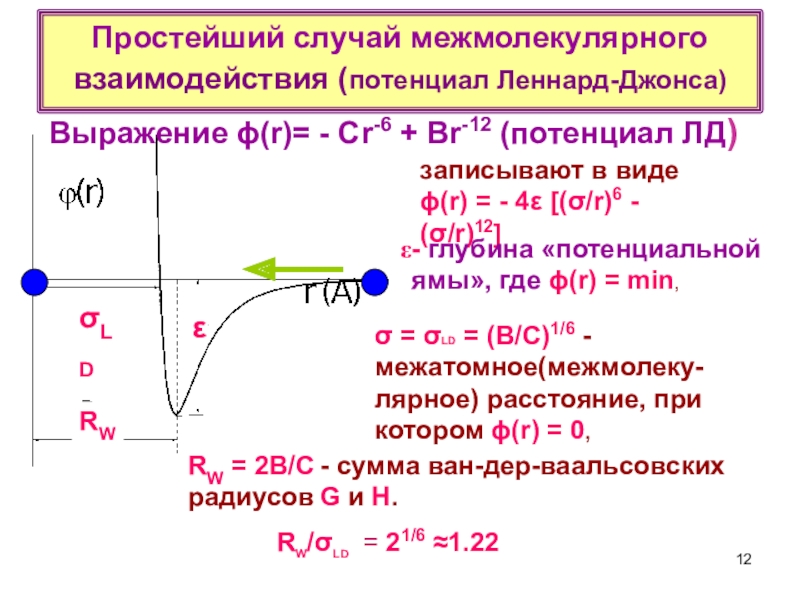
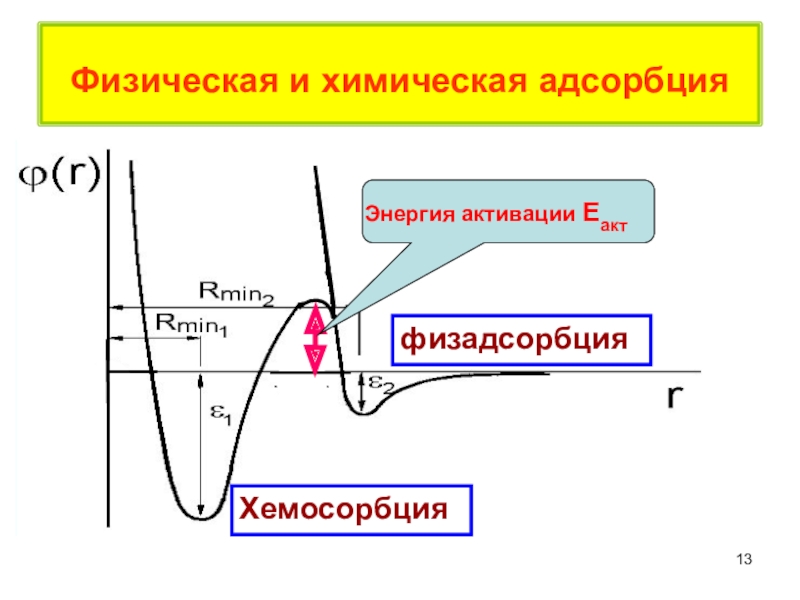
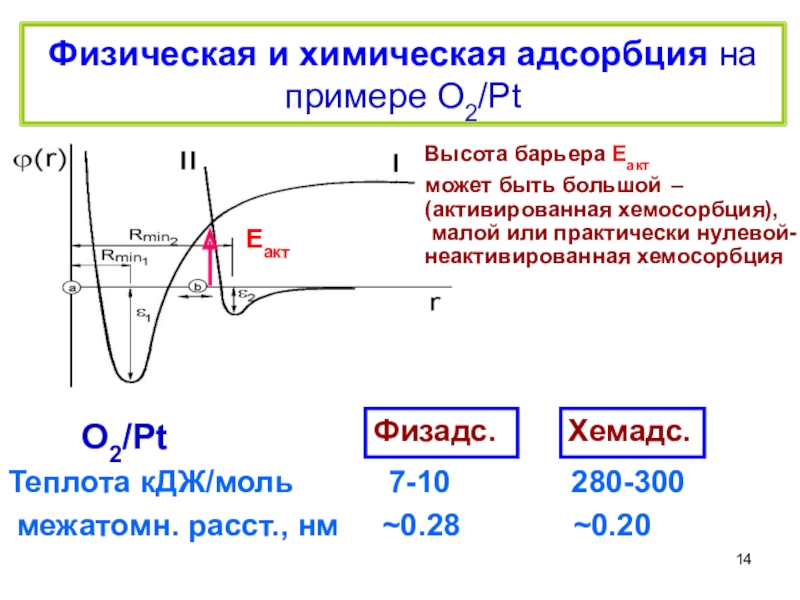
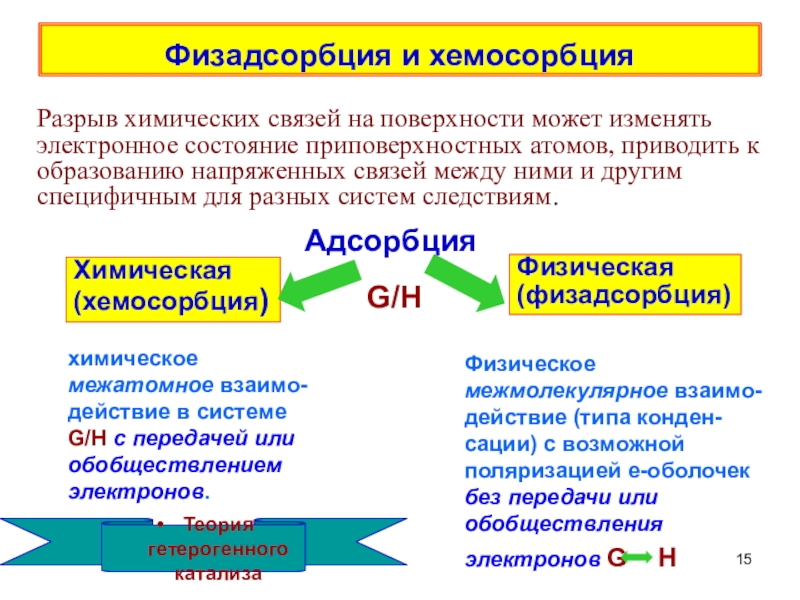
терминология,
-типы физико-химических межмолекулярных взаимодействий,
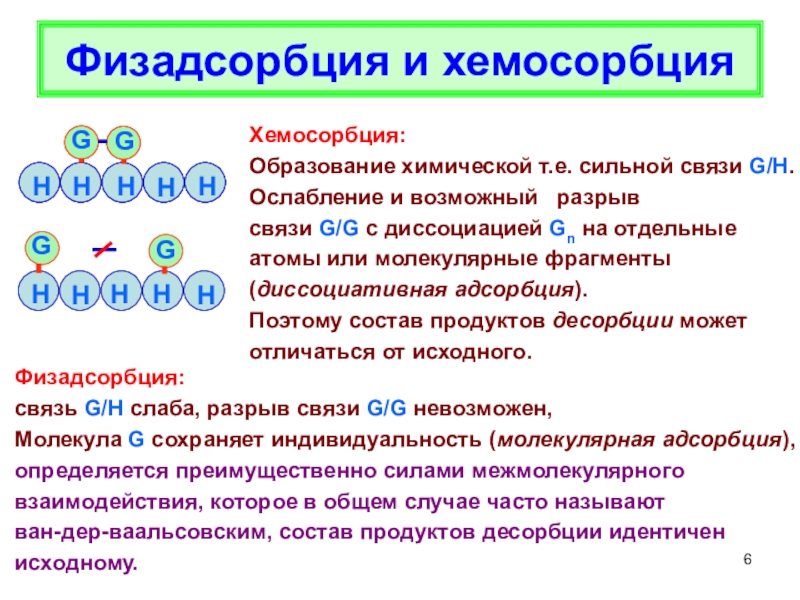
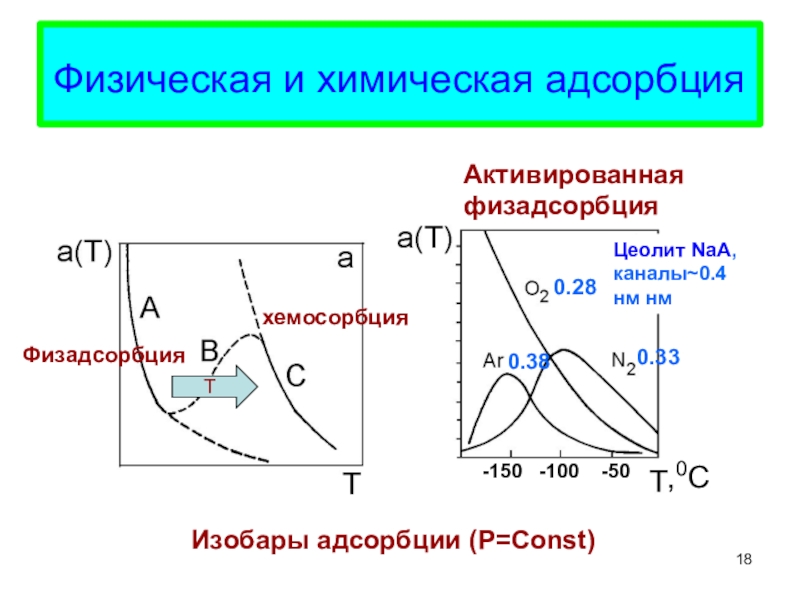
главные различия между физической и
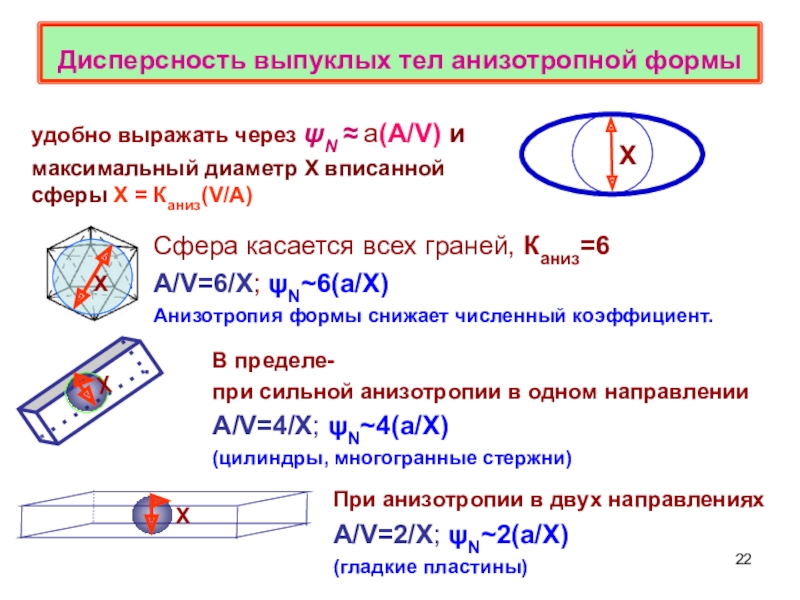
химической адсорбцией,определения дисперсности,
роль текстуры в катализе.