Слайд 1Лекция 11
Иммобилизированные ферменты
Слайд 2Инженерная энзимология
Базовая технология – иммобилизация ферментов
Слайд 3История
1916 год Гриффин Е, Нельсон Дж. провели адсорбцию, прикрепив
инвертазу на активированный уголь
1939 г. Пфанмюллер Дж., Шлейх Г. получили
первый патент на иммобилизацию ферментов, прикрепив протеолитические ферменты на древесные опилки
1951 г. Кембелл прикрепил фермент на целлюлозу
1953г. Грубхофер Н., Шлейт Д. нанесли на нерастворимый носитель пепсин, амилазу, РНКазу
1969 г. в Японии налажено производство L-аминокислот.
1970 г. Вайсман Дж., Сесс Дж. применили липосомы
1971 г. состоялась 1-я конференция по инженерной энзимологии в США, где был узаконен термин иммобилизованные ферменты.
1973 г. запуск промышленных установок для производства глюкозо - фруктозных сиропов
Слайд 4Базовая технология
Иммобилизация – это ограничение подвижности молекул ферментов, их конформационных
перестроек. Этот процесс основан на физ.-хим. принципах позволяющих закрепить структуру
фермента так, чтобы активных центр его молекулы был активен длительное время
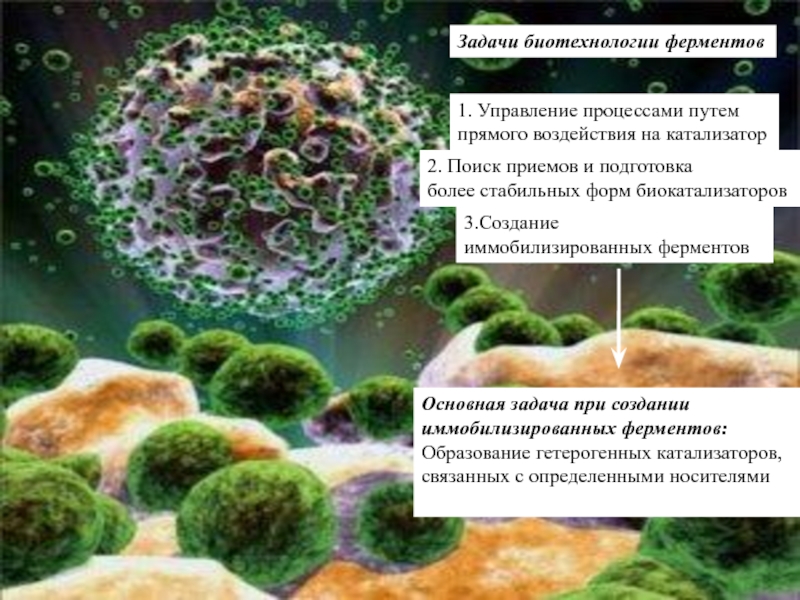
Слайд 5Задачи биотехнологии ферментов
1. Управление процессами путем
прямого воздействия на катализатор
2.
Поиск приемов и подготовка
более стабильных форм биокатализаторов
3.Создание
иммобилизированных ферментов
Основная
задача при создании
иммобилизированных ферментов:
Образование гетерогенных катализаторов,
связанных с определенными носителями
Слайд 7 Основные источники ферментов
1. Ткани животных как отход мясоперерабатывающей промышленности
(прежде всего, это богатые ферментами поджелудочная железа и слизистая оболочка
желудка).
2. Некоторые растения (например, такие гидролитические ферменты, как папаин и рицин извлекают соответственно из сока дынного дерева и инжирного дерева из ячменя - амилазу.
3. Микроорганизмы.
Слайд 8Этапы
Приготовление биотехнологических препаратов иммобилизированных ферментов, сводится к двум
этапам:
- получение собственно фермента Очистка из биол. материала, применение
убитых или живых клеток
- наличие носителя и прикрепление фермента
Итак, как прикрепить, какой возможен способ связывания ?
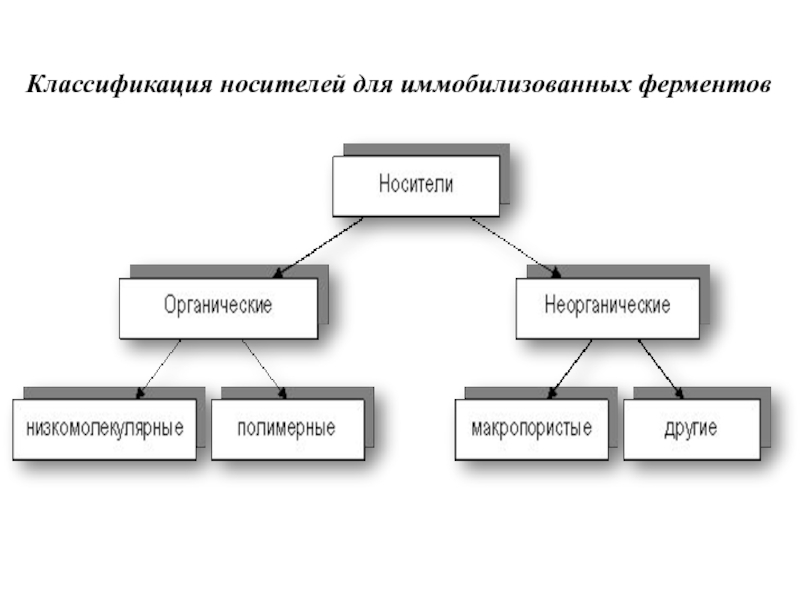
Слайд 9Классификация носителей для иммобилизованных ферментов
Слайд 10Носители делят на 2 группы:
1. Органические
- природные полимеры :
полисахаридные (крахмал,
целлюлоза-бумага, агароза - биогель, декстран, хитин, альгинат),
липидные , белковые (гели - белки коллаген, желатин).
- синтетические полимеры могут быть
в виде волокон, гранул, трубок;
по составу это: производные целлюлозы, ДЭАЭ-целлюлоза, КМ-целлюлоза, нейлон, ионообменные смолы Dowex, Amberlit, полистирол, полиэтилен, гели (полиакриламид), сефадексы; липосомы, ПАВ с ж.к.С 17-С 20., акриловая кислота,
N-винилпирролидон (полиамидная кислота), полиуретан
2. Неорганические
- стекло, гидроокись алюминия Аl(ОН)3, титана, циркония, железа; глина, стекло, керамика, песок, силикагель, цеолиты, алюмосиликаты, металлы и их оксиды
Слайд 11Требования к носителю для иммобилизации
Носитель должен
быть
абсолютно нерастворим
механически прочным
химически стойким
иметь высокую
внутреннюю поверхность
проницаем для субстрата и продукта реакции
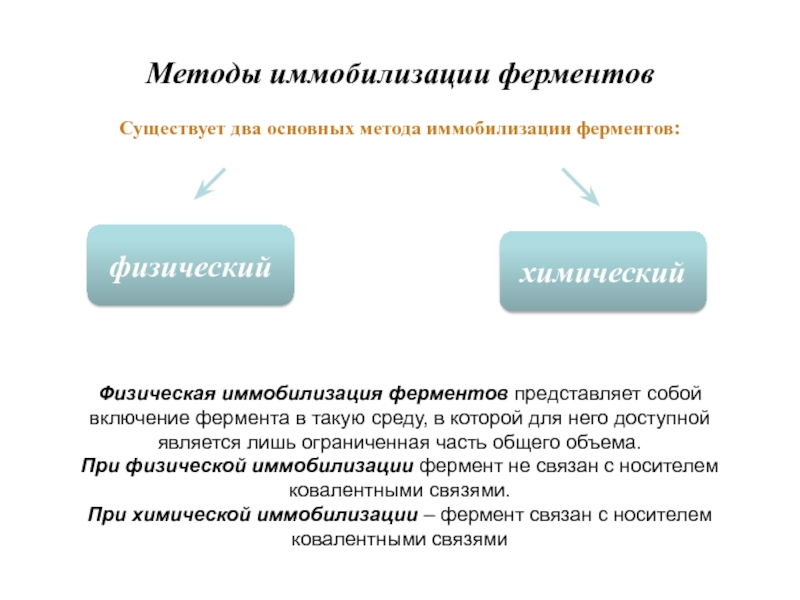
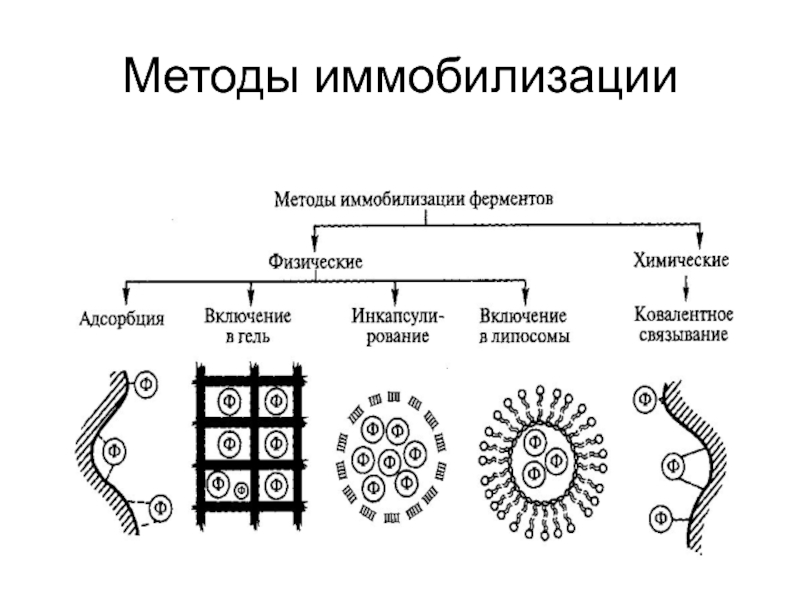
Слайд 12Методы иммобилизации ферментов
Существует два основных метода иммобилизации ферментов:
Физическая иммобилизация
ферментов представляет собой включение фермента в такую среду, в которой
для него доступной является лишь ограниченная часть общего объема.
При физической иммобилизации фермент не связан с носителем ковалентными связями.
При химической иммобилизации – фермент связан с носителем ковалентными связями
физический
химический
Слайд 13
Физические методы иммобилизации
1-
Адсорбция на нерастворимом носителе. Впервые осуществлена Гриффин в 1916г.
Например, ДЭАЭ-сефадекс используют для разделения Д и L аминокислот,прикрепляя фермент аминоацилазу.
Полиуретан с крупными ячейками помещают в биореактор с клетками при очистке сточных вод.
Слайд 14Физические методы иммобилизации
2 - биокатализатор вносят в полимерную структуру
т.о.включают, полимеризуют, в крахмальном, агарозном геле, в силикагеле, в агар-агаре;
3 - Микрокапсулирование – это капсулы, а также – липосомы (впервые в 1964 г. применил Бэнгэм); можно внести несколько ферментов и получить мультиэнзим
могут быть фрагменты клеток, в которых присутствуют комплексы ферментов
Слайд 15Химические методы иммобилизации
Присоединить химически прочной ковалентной связью.
Первая работа по ковалентной иммобилизации на целлюлозу
фермента выполнена Кэмпбэлл в 1951 году, а в1953 году Шлейт и Грубхофер осуществили ковалентное связывание ряда ферментов
Слайд 17Существует четыре типа связывания ферментов:
адсорбция на нерастворимых носителях;
включение в
поры геля;
пространственное отделение фермента от остального объема реакционной системы
с помощью полупроницаемой перегородки (мембраны);
включение в двухфазную среду, где фермент растворим и может находиться только в одной из фаз.
Типы связывания ферментов
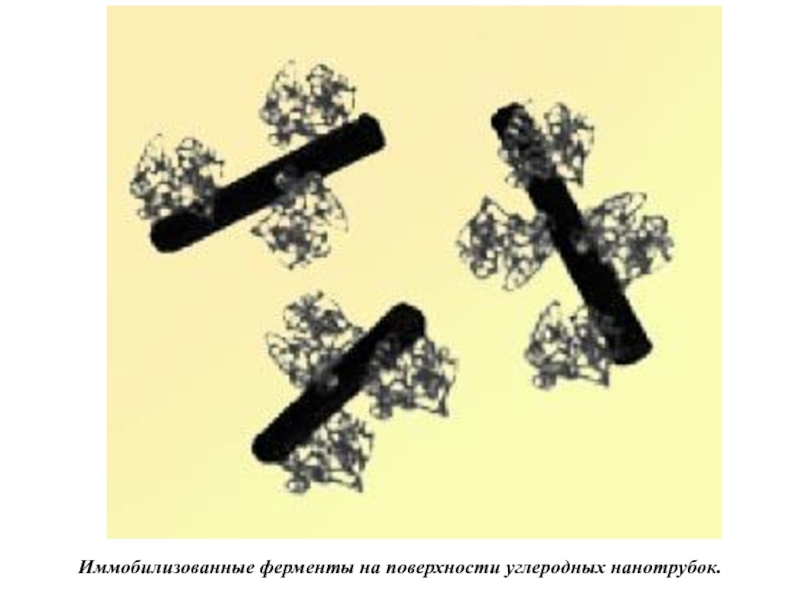
Слайд 18Иммобилизованные ферменты на поверхности углеродных нанотрубок.
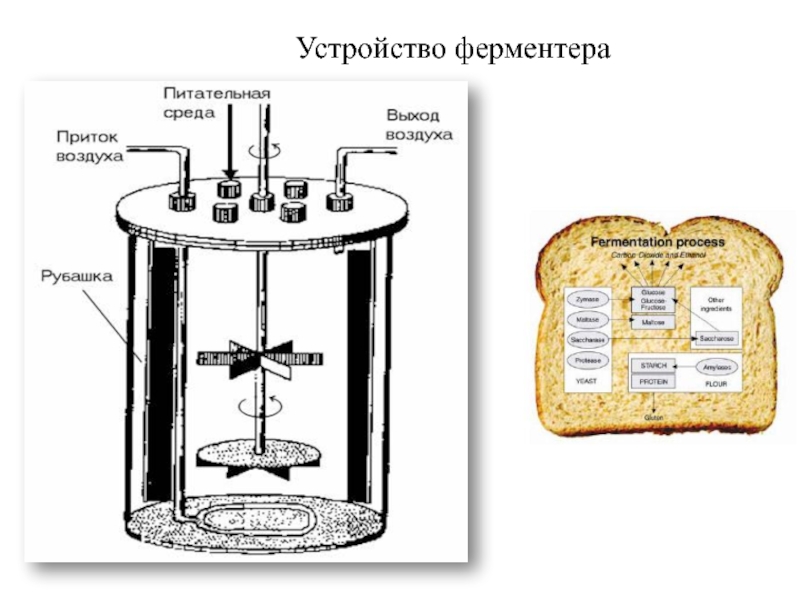
Слайд 19Реакторы для технологического процесса с применением иммобилизированных ферментов
Биокаталитические системы
существуют в биореакторе в виде неподвижной фазы, через которую протекает
среда с субстратом. Это циркуляционные реакторы, чаще всего колоночного типа. (Это одностадийный процесс). Если используют целые клетки, то создают многостадийный процесс.
Слайд 21Биотехнологический процесс с иммобилизированными ферментами
Слайд 22Процесс синтеза целевого продукта. На этот процесс влияют:
- Биосинтез целевого
вещества, происходящего на фоне роста и размножения клеток – продуцентов.
-
Питательные среды на разных стадиях биосинтеза, меняющиеся по составу и физ.-хим показателям.
- Отдельные ферментационные циклы, которые необходимо удалять.
Слайд 23 Основные типы иммобилизованных биокаталитических систем.
Изолированные ферменты
Иммобилизированные клетки
Иммобилизация клеточных органелл
Соиммобилизация
Иммобилизированные кофакторы
Слайд 24Свойства иммобилизированных ферментов
1. Гетерогенность
2. Легко отделимы
от реакционной среды
3. Способны
включать и
выключать реакцию
4. Ферментный препарат
может использован многократно
5. Результат -
получение
чистого продукта,
не загрязненного ферментом
Слайд 25 Биокаталитическая активность целых иммобилизованных клеток в настоящее время может
быть использована в различных отраслях науки и техники:
-
при биосинтезе и трансформации таких соединений, как
аминокислоты, органические кислоты, антибиотики, стероиды углеводы, углеводороды, нуклеотиды и нуклеозиды;
- в пивоварении и виноделии;
- при очистке сточных и природных вод;
- при извлечении металлов из сточных вод;
- при ассимиляции солнечной энергии;
- при изготовлении водородных солнечных элементов;
- в азотфиксации;
- в аналитических целях при изготовлении электродов.
Слайд 26Улучшение свойств ферментов
Задачи биотехнологии сделать ферменты более технологичными, т.е.
более приспособленными к технологическому производству
-модификация ферментов. 60 видов ферментов
микросомального оксиления
-направленный мутагенез и генная инженерия белков – ферментов
Внося изменения в гены, кодирующие ферменты, а также методами белковой инженерии можно изменять:
- Км и У мах сродство Е и субстрата
-Повысить стабильность в широком диапазоне рН и расширить условия, в которых фермент не работает
- создать белки способные работать в безводных растворителях, проводя реакции в нефизиологических условиях
-создать белки активные без кофактора, что позволит им работать в непрерывных промышленных циклах, повысить стабильность белковой молекулы.
-изменить активный центр фермента , чтобы повысить его специфичность и снизить побочные эффекты
-повысить устойчивость к клеточным протеазам, что позволит упростить процесс очистки и повысит его выход
-изменить аллостерическую регуляцию фермента, что позволит снизить степень его ингибирования по типу обратной связи
Слайд 27 Применение ферментов
1 В пищевой промышленности
Первые производства – это
Производство аминокислот (в 1969
г. в Японии из рацемических смесей с помощью аминоацилазы иммобилизованной на ДЭАЭ-целлюлозе).
Производство глюкозо-фруктозных.сиропов (в1973 г в США глюкоизомеразу применили для крупнотоннажного производства, а в 1980 году 10% сахара заменено на сироп в Японии и 40 % в США ).
2. Ферменты в фармакологии и здравоохранении
Производство антибиотиков (из бензилпенициллина получают 6-АПК), а с 1974 - г. в нашей стране получение 6-аминопенициллановой кислоты и далее полусинтетических антибиотиков производят с помощью иммобилизованных ферментов, что привело к снижению их себестоимости .
Энзимодиагностикумы, заместительная энзимотерапия, система «искусственная почка»
3. Производство альтернативных источников энергии; биоэтанола и биогаза благодаря ферментативной конверсии целлюлозы в глюкозу
4. Очистка окружающей среды
5 Ферменты для моющих средств
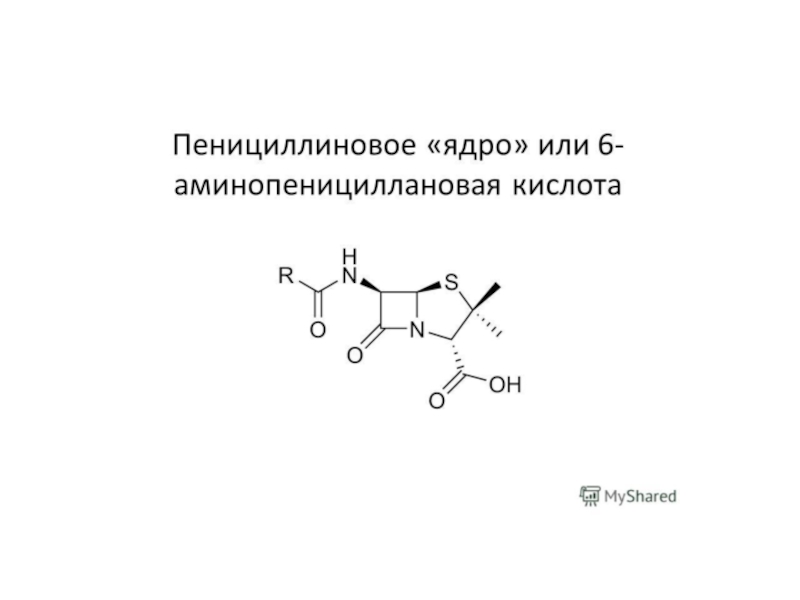
Слайд 28Пенициллины
Пенициллины, группа близких по химическому строению природных и полусинтетических антибиотиков.
Ядро молекулы П.— 6-аминопенициллановая кислота (6-АПК) — гетероциклическое соединение, состоящее
из 4-членного b-лактамного (А) и 5-членного тиазолидинового (В) колец. П. различаются характером радикала (R) в боковой цепи.
Производство антибиотиков (из бензилпенициллина получают 6-АПК), а с 1974 - г. в нашей стране получение 6-аминопенициллановой кислоты и далее полусинтетических антибиотиков производят с помощью иммобилизованных ферментов, что привело к снижению их себестоимости
Слайд 30Применение ферментов
3. Ферментативные методы в анализах - клинических, агрономических,природоохранных,
заводских лабораторий.
Глюкоза, молочная кислота, мочевая кислота, мочевина – глюкозооксидаза, лактатдегидрогеназа,
уриказа, уреаза
ИФА
Ферменты в фармакологии и здравоохранении как лекарства
Энзимодиагностикумы, заместительная энзимотерапия, система «искусственная почка
Слайд 31
4. Производство альтернативных источников энергии; биоэтанола и биогаза благодаря
ферментативной конверсии целлюлозы в глюкозу
5. Очистка окружающей среды
6
Ферменты для моющих средств
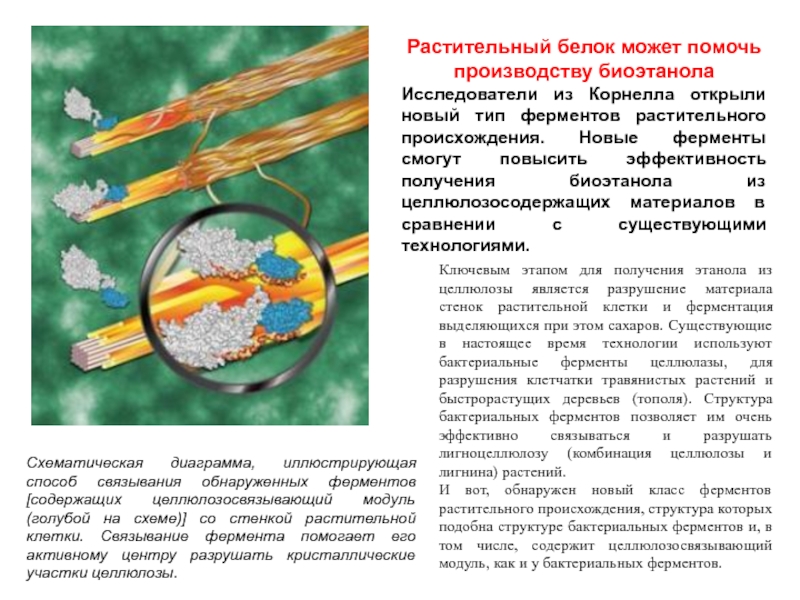
Слайд 32Растительный белок может помочь производству биоэтанола
Исследователи из Корнелла открыли
новый тип ферментов растительного происхождения. Новые ферменты смогут повысить эффективность
получения биоэтанола из целлюлозосодержащих материалов в сравнении с существующими технологиями.
Схематическая диаграмма, иллюстрирующая способ связывания обнаруженных ферментов [содержащих целлюлозосвязывающий модуль (голубой на схеме)] со стенкой растительной клетки. Связывание фермента помогает его активному центру разрушать кристаллические участки целлюлозы.
Ключевым этапом для получения этанола из целлюлозы является разрушение материала стенок растительной клетки и ферментация выделяющихся при этом сахаров. Существующие в настоящее время технологии используют бактериальные ферменты целлюлазы, для разрушения клетчатки травянистых растений и быстрорастущих деревьев (тополя). Структура бактериальных ферментов позволяет им очень эффективно связываться и разрушать лигноцеллюлозу (комбинация целлюлозы и лигнина) растений.
И вот, обнаружен новый класс ферментов растительного происхождения, структура которых подобна структуре бактериальных ферментов и, в том числе, содержит целлюлозосвязывающий модуль, как и у бактериальных ферментов.
Слайд 33Совместно с лабораторией «Полимеры для биологии» разработаны мягкие методы включения
ферментов в биодеградируемые и биосовместимые гидрогели, позволяющие стабилизировать неустойчивые протеиназы.
Получаемые препараты могут найти применение в терапии ран и ожогов.
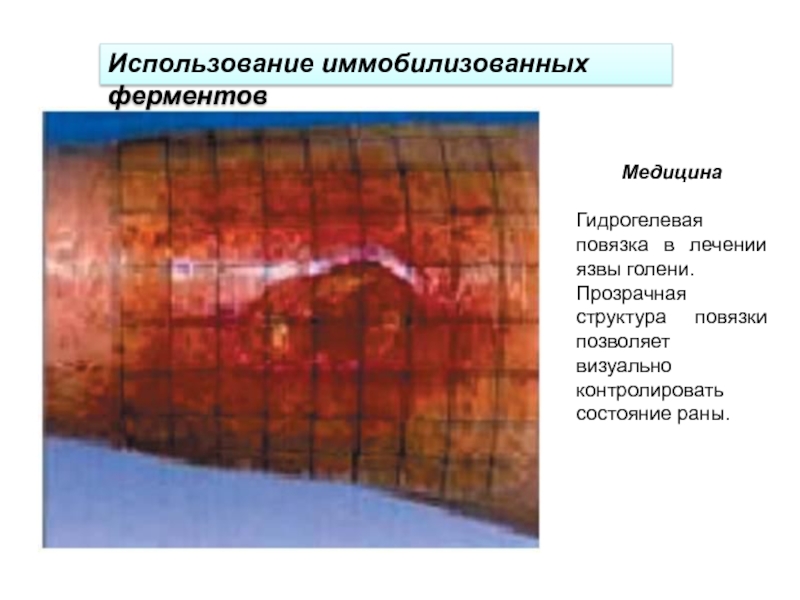
Слайд 34Медицина
Гидрогелевая повязка в лечении язвы голени.
Прозрачная структура повязки позволяет визуально
контролировать состояние раны.
Использование иммобилизованных ферментов
Слайд 35Подложка с иммобилизованными молекулярными колониями
Слайд 36Компоненты иммобилизированной системы и биотехнологический процесс
* Sacharomyces cerevisia
Zymomonas mobilis а) β- глюкозидаза сбраживание целлобиозы до этанола
б) β- галактозидаза сбраживание лактозы до этанола
* Sacharomyces cerevisia а)глюкоамилаза - получение пива с низким содержанием декстринов
б) пепсин - получение пива с низким содержание белка
в) глюкозооксидаза - превращение глюкозы в глюконовую кислоту
Слайд 37Компоненты иммобилизированной системы и биотехнологический процесс
Aspergillus niger
а)
каталаза - превращение глюкозы в глюконовую кислоту
б) глюкоамилаза -
удаление кислорода из пива
Thermus aqyaticus - Taq-ДНК-полимераза
Для ПЦР, опт.Т=70-72 С и даже 95 С
Pyrococcus furiosus Pfu-ДНК-полимераза
Слайд 38Биотехнология - это
Biotechnology: the use of living organisms or their
products including DNA, cells, and enzymes to make products or
solve problems. В кн.: L.Furcht, W.Hoffman «The Stem Cell DILEMMA»