Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 2. Гетерогенные реакции в растворах электролитов
Содержание
- 1. Лекция 2. Гетерогенные реакции в растворах электролитов
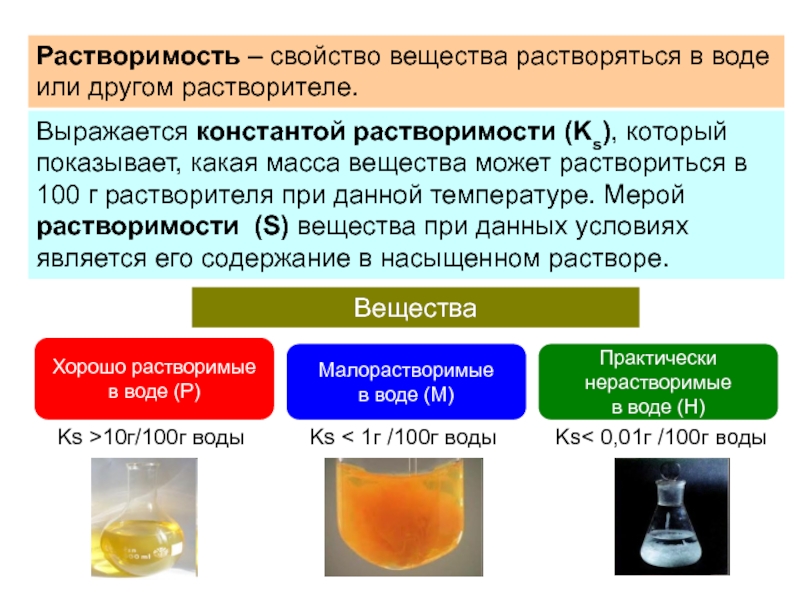
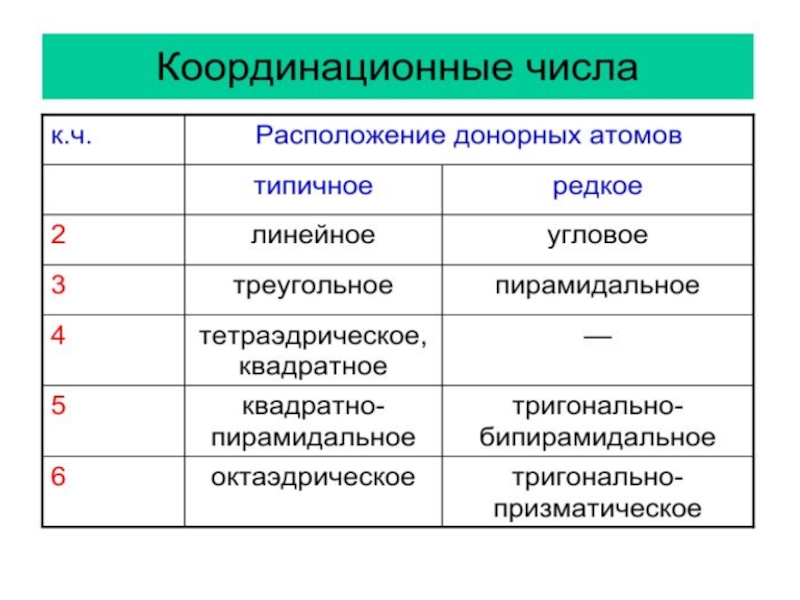
- 2. Растворимость – свойство вещества растворяться в воде
- 3. СаСО3 Са2+
- 4. где а = fа∙ С Кх.р. а
- 5. Ks = а (Са2+) ∙ а (СО32-)
- 6. Ks = Cх(М+) ∙ Cy(А‾) Ks =
- 7. Зная Ks можно рассчитать равновесную
- 8. Условия образования и растворения осадков
- 9. CaSO4
- 10. Конкурирующие гетерогенные равновесия
- 11. Ks (CaSO4) = 2,5 ∙ 10-5Ks (SrSO4)
- 12. Ks (CaSO4) = 2,5 ∙ 10-5Ks (CaCO3)
- 13. Гетерогенные процессы в живых организмахДалее происходит депротонирование
- 14. аморфный Ca3(PO4)2 → Ca5(PO4)3OH
- 15. Слайд 15
- 16. Патология костной тканиСа5(РО4)3ОНВе+2Sr+2Sr90 - β-излучатель бериллиевый рахит
- 17. Камнеобразование-болезнь обмена веществПАДАГРА. Соли мочевой кислоты (ураты)
- 18. Лигандообменные равновесия и процессы
- 19. Координационная теория, предложенная в 1893 году А. Вернером и дополненная Л.А.Чугаевым. Лев Александрович Чугаев(1873-1922)Альфред Вернер(1866-1919)
- 20. [ Ag (NH3)2]внутренняя сферавнешняя сферакомплексообразовательлиганды (от лат.
- 21. Слайд 21
- 22. Комплексообразователь (центральный атом (М)) – атом или
- 23. Слайд 23
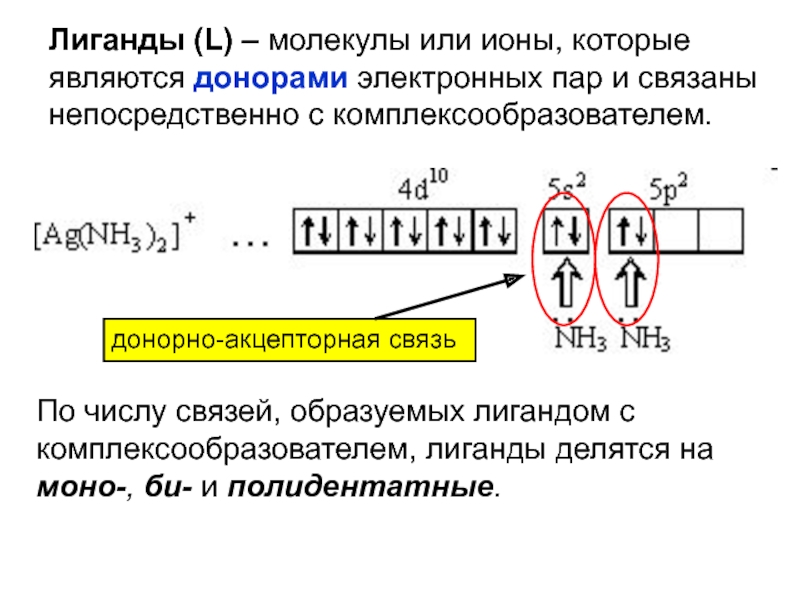
- 24. Лиганды (L) – молекулы или ионы, которые
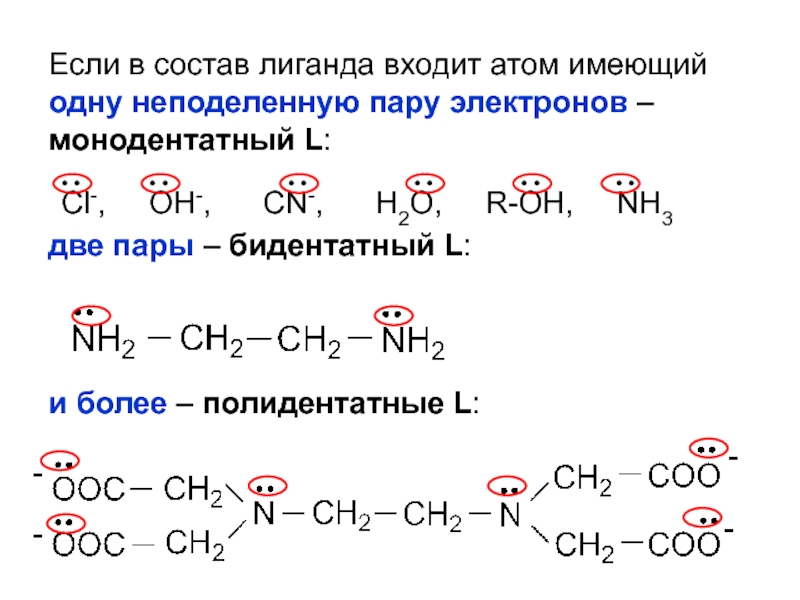
- 25. Если в состав лиганда входит атом имеющий
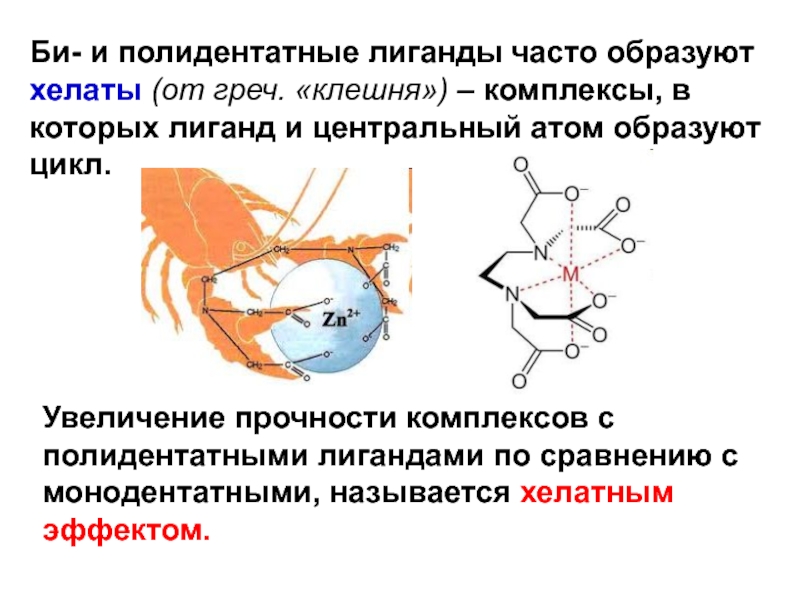
- 26. Би- и полидентатные лиганды часто образуют хелаты
- 27. Эффективность донорно-акцепторного взаимодействия L и M (прочность
- 28. Наиболее прочная связь возникает между «мягкими» L
- 29. Очень «мягкие»: Cd2+, Pb2+, Hg2+, сильно токсичны,
- 30. Детоксикацию организма от металлов токсикантов проводят при
- 31. Диссоциация комплексных соединенийПервичная диссоциация комплексных соединений -
- 32. Устойчивость комплексных соединений Для качественной
- 33. Эффективными препаратами для хелатотерапии являются:этилендиаминтетрауксусная кислотасукцимерБАЛ
- 34. тетацин (кальцийдинатриевая соль ЭДТА)-OOCH2C
- 35. отравление ртутьюотравление мышьяком
- 36. Слайд 36
- 37. Слайд 37
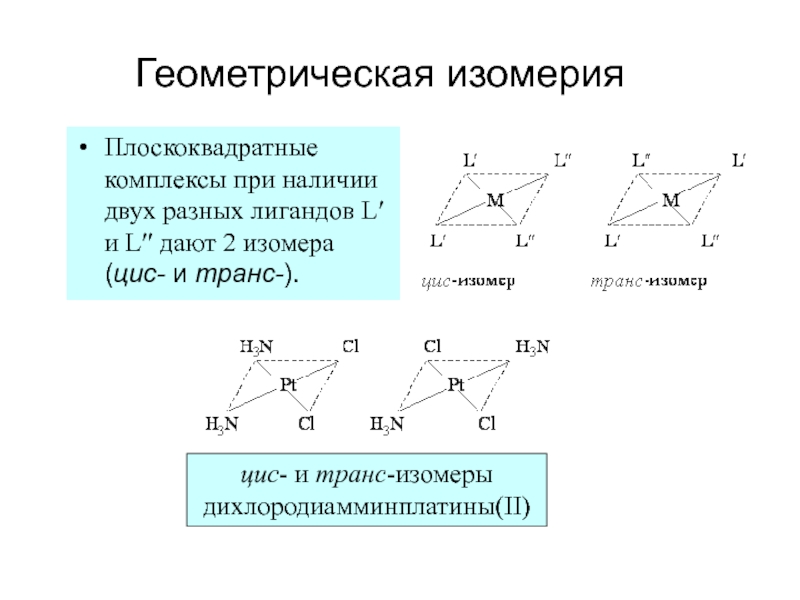
- 38. Геометрическая изомерияПлоскоквадратные комплексы при наличии двух разных
- 39. Междусферная изомерия: 1) сольватная (гидратная); 2) ионная
- 40. Междусферная изомерияИонные (ионизационные) изомеры [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2[Pt(NH3)4SO4](OH)2
- 41. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Растворимость – свойство вещества растворяться в воде или другом растворителе.
раствориться в 100 г растворителя при данной температуре. Мерой растворимости (S) вещества при данных условиях является его содержание в насыщенном растворе.
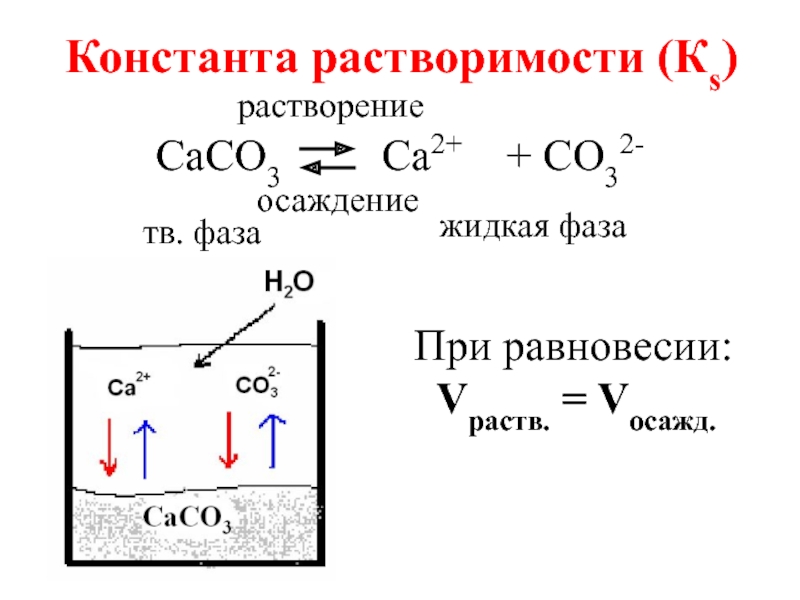
Слайд 3СаСО3 Са2+ + СО32-
При равновесии:
Vраств. = Vосажд.
растворение
осаждение
тв. фаза
жидкая фаза
Константа растворимости (Кs)
Слайд 4где а = fа∙ С
Кх.р. а (CaСО3) = а
(Са2+) а (СО32-)
Ks
соnst
при данных условиях
const
для твердого вещества
Слайд 5Ks = а (Са2+) ∙ а (СО32-)
Ks - константа
растворимости
Ks или ПР (произведение растворимости), справочные величины
для разбавленных
растворов fa→1 и а → С
Ks = С(Са2+) ∙ С(СО32-) или
Ks = [Са2+] ∙ [СО32-]
Слайд 6Ks = Cх(М+) ∙ Cy(А‾)
Ks = C3 (Ca2+) ∙
C2 (PO43-)
Например,
Ca3(PO4)2 3Ca2+ + 2PO43-
Для электролитов состава
МхАyСлайд 7 Зная Ks можно рассчитать равновесную концентрацию вещества в
насыщенном растворе, т.е. растворимость (S)
общий вид для электролита типа AmBn
mA n+ + nB m‾ Пример: Ca3(PO4)2 3Са 2+ + 2РО43-
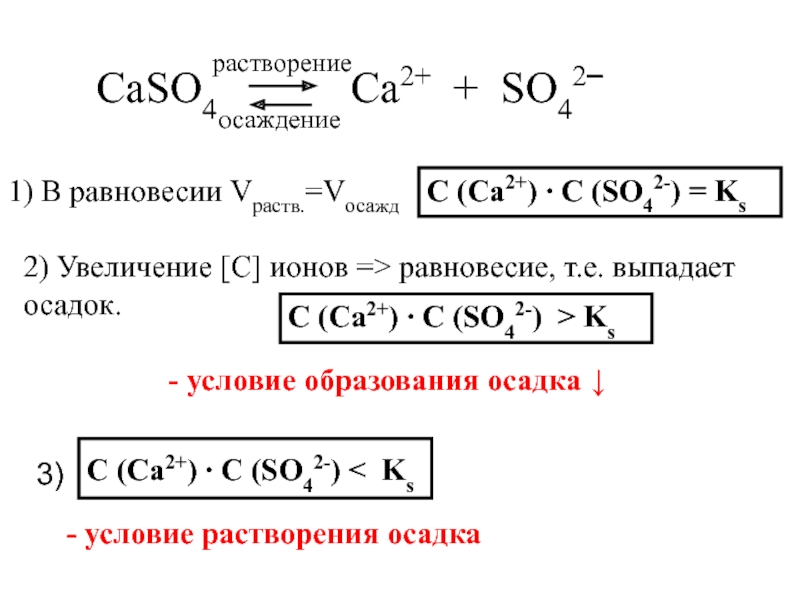
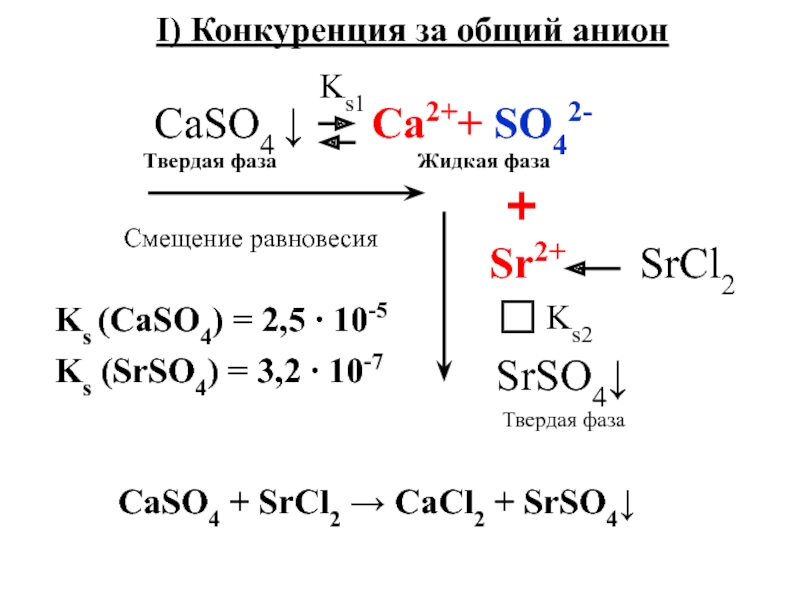
Слайд 9 CaSO4 Ca2+
+ SO42‾
1) В равновесии Vраств.=Vосажд
С (Ca2+)
∙ С (SO42-) = Ksрастворение
осаждение
2) Увеличение [С] ионов => равновесие, т.е. выпадает осадок.
С (Ca2+) ∙ С (SO42-) > Ks
3)
С (Ca2+) ∙ С (SO42-) < Ks
- условие растворения осадка
- условие образования осадка ↓
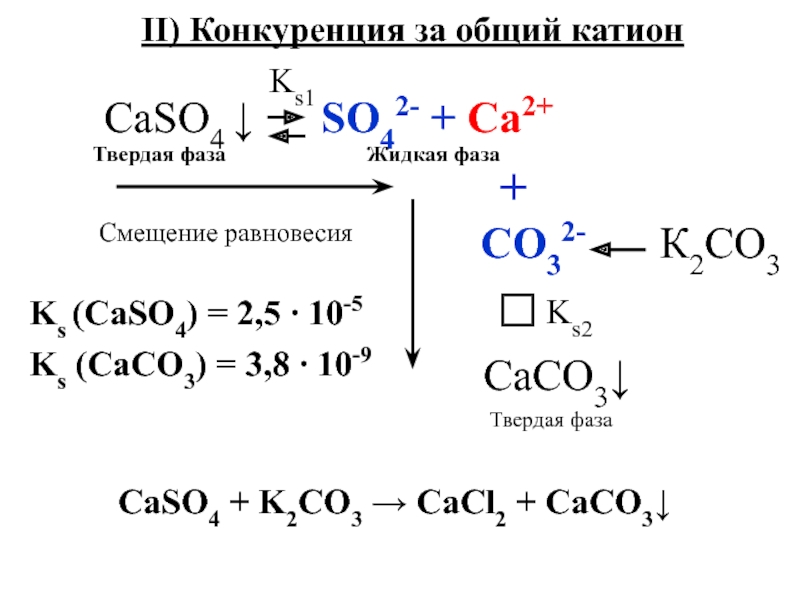
Слайд 11Ks (CaSO4) = 2,5 ∙ 10-5
Ks (SrSO4) = 3,2 ∙
10-7
I) Конкуренция за общий анион
CaSO4 + SrCl2 → CaCl2
+ SrSO4↓Слайд 12Ks (CaSO4) = 2,5 ∙ 10-5
Ks (CaCO3) = 3,8 ∙
10-9
II) Конкуренция за общий катион
Смещение равновесия
+
CО32-
К2CO3CaSO4 + K2CO3 → CaCl2 + CaCO3↓
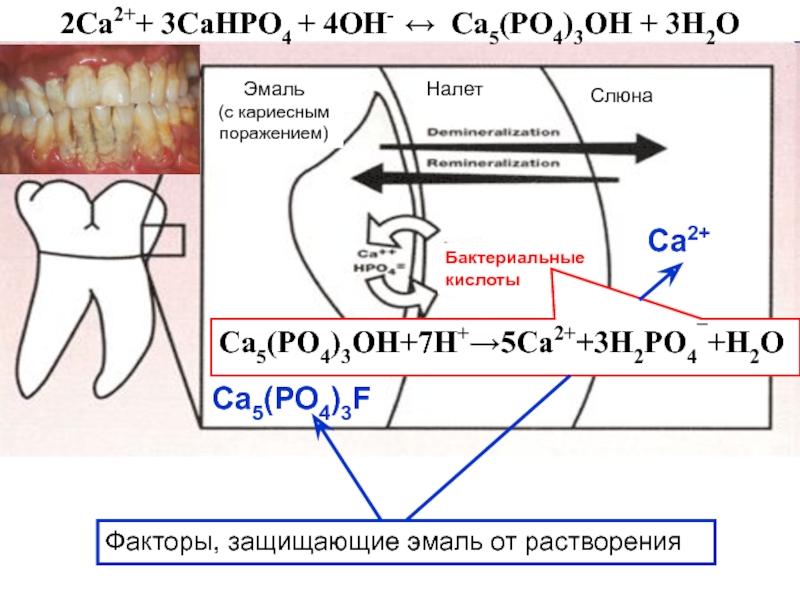
Слайд 13Гетерогенные процессы в живых организмах
Далее происходит депротонирование
Жидкая фаза
– кровь Са2+, НРО42-, Н2РО4-, ОН- , НСО3-, лактаты, белки
2Са2++
3СаНРО4 + 4ОН- Ca5(PO4)3ОН + 3H2OKs (Ca(Н2РO4)2 = 1,0 ∙ 10-3
Ks (CaНРO4) = 2,7 ∙ 10-7
Са2+ + НРО42- → СаНРО4
гидроксиапатит
Кs = 1,6 ∙ 10-58
рН крови (7,4)
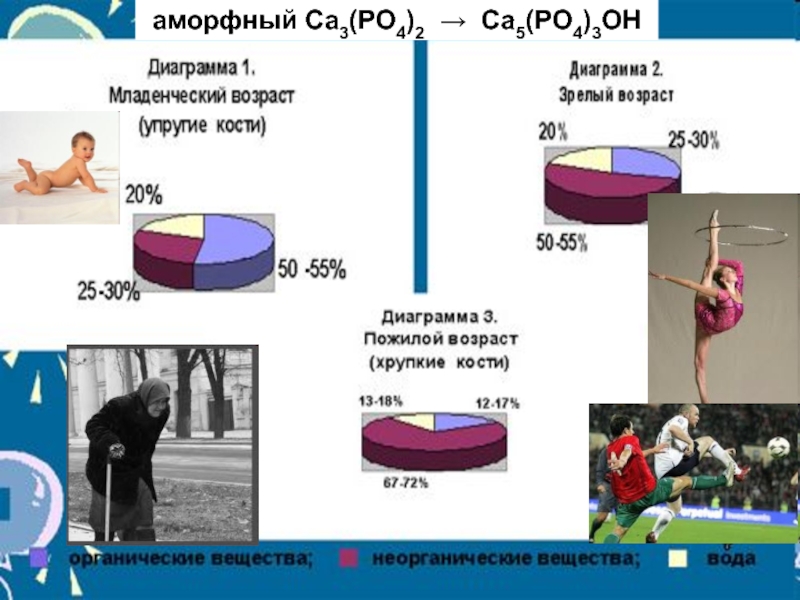
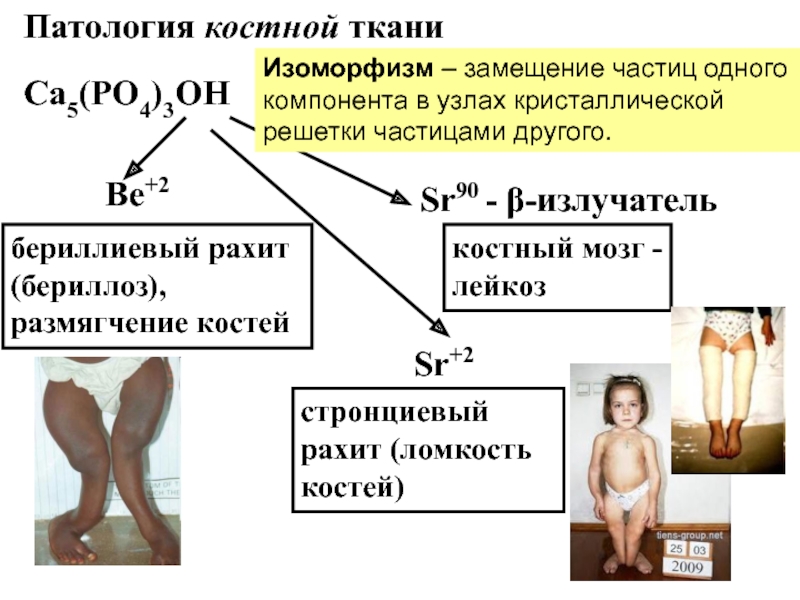
Слайд 16Патология костной ткани
Са5(РО4)3ОН
Ве+2
Sr+2
Sr90 - β-излучатель
бериллиевый рахит (бериллоз), размягчение костей
стронциевый рахит (ломкость костей)
костный мозг - лейкоз
Изоморфизм – замещение частиц
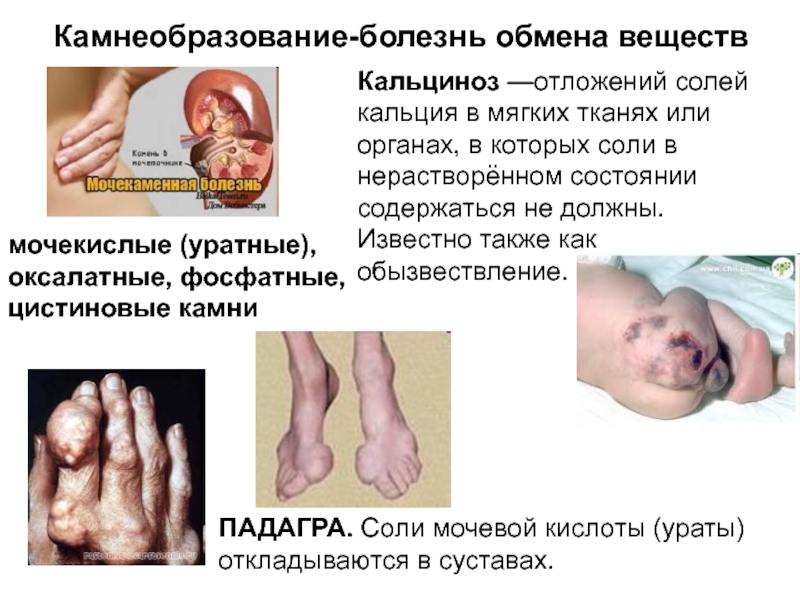
одного компонента в узлах кристаллической решетки частицами другого.Слайд 17Камнеобразование-болезнь обмена веществ
ПАДАГРА. Соли мочевой кислоты (ураты) откладываются в суставах.
мочекислые (уратные), оксалатные, фосфатные, цистиновые камни
Кальциноз —отложений солей кальция в
мягких тканях или органах, в которых соли в нерастворённом состоянии содержаться не должны. Известно также как обызвествление.Слайд 19Координационная теория, предложенная в 1893 году А. Вернером и дополненная
Л.А.Чугаевым.
Лев Александрович
Чугаев
(1873-1922)
Альфред
Вернер
(1866-1919)
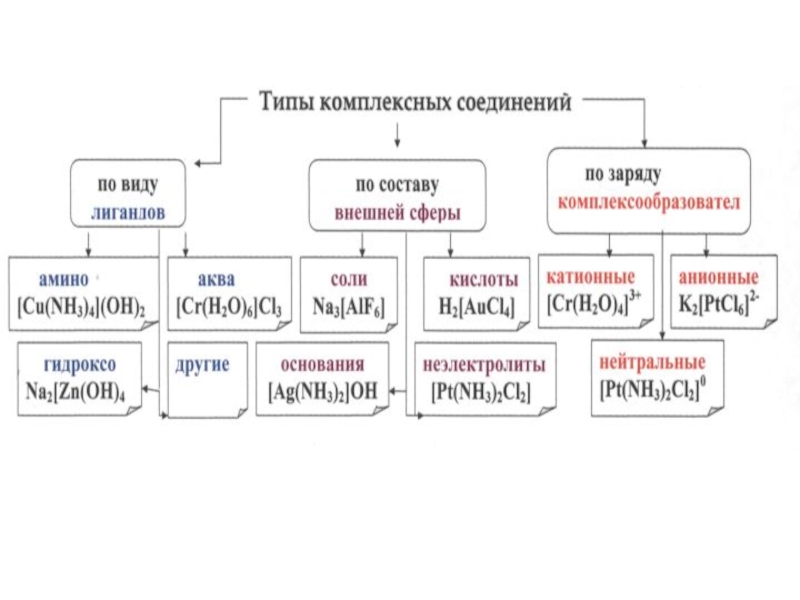
Слайд 20[ Ag (NH3)2]
внутренняя сфера
внешняя сфера
комплексообразователь
лиганды (от лат. ligare – связывать,
соединять)
Комплексные соединения – устойчивые химические соединения сложного состава, в которых
хотя бы одна связь, образована по донорно-акцепторному механизму.Cl
координационное число
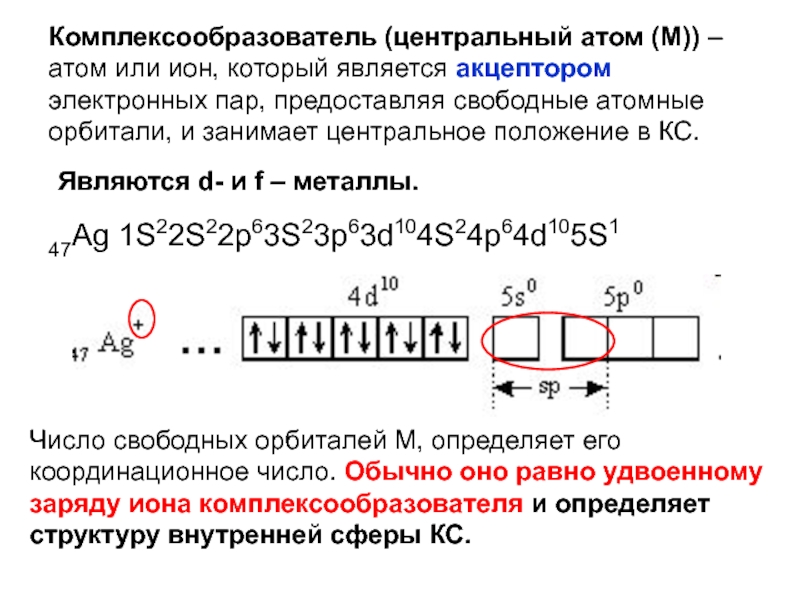
Слайд 22Комплексообразователь (центральный атом (М)) – атом или ион, который является
акцептором электронных пар, предоставляя свободные атомные орбитали, и занимает центральное
положение в КС.47Ag 1S22S22p63S23p63d104S24p64d105S1
Являются d- и f – металлы.
Число свободных орбиталей М, определяет его координационное число. Обычно оно равно удвоенному заряду иона комплексообразователя и определяет структуру внутренней сферы КС.
Слайд 24Лиганды (L) – молекулы или ионы, которые являются донорами электронных
пар и связаны непосредственно с комплексообразователем.
По числу связей, образуемых лигандом
с комплексообразователем, лиганды делятся на моно-, би- и полидентатные.донорно-акцепторная связь
Слайд 25Если в состав лиганда входит атом имеющий одну неподеленную пару
электронов – монодентатный L:
две пары – бидентатный L:
и более
– полидентатные L:Cl-, OH-, CN-, H2O, R-OH, NH3
• •
• •
• •
• •
• •
• •
Слайд 26Би- и полидентатные лиганды часто образуют хелаты (от греч. «клешня»)
– комплексы, в которых лиганд и центральный атом образуют цикл.
Увеличение
прочности комплексов с полидентатными лигандами по сравнению с монодентатными, называется хелатным эффектом. Слайд 27Эффективность донорно-акцепторного взаимодействия L и M (прочность связи) определяется их
поляризуемостью.
Чем меньше радиус и число электронов у частицы, тем менее
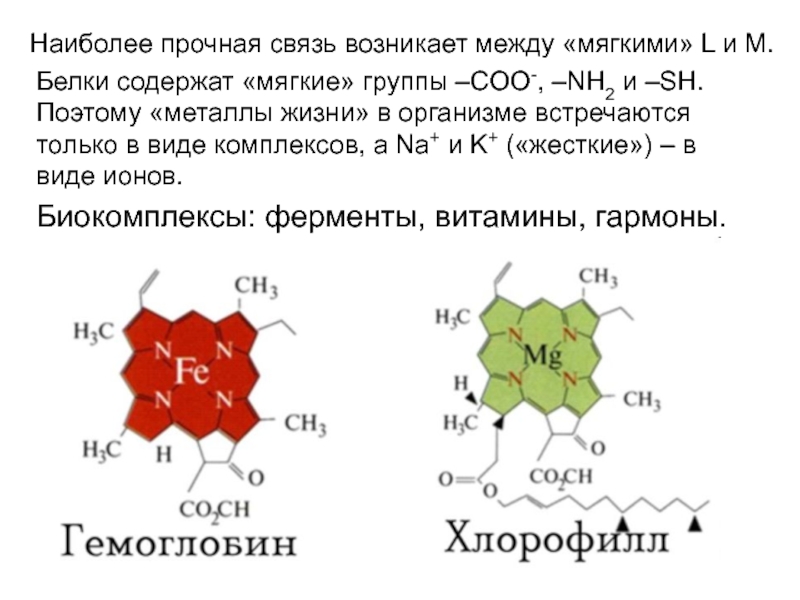
поляризуема («жесткие»), наоборот – «мягкие».Слайд 28Наиболее прочная связь возникает между «мягкими» L и M.
Белки содержат
«мягкие» группы –COO-, –NH2 и –SH. Поэтому «металлы жизни» в
организме встречаются только в виде комплексов, а Na+ и K+ («жесткие») – в виде ионов.Биокомплексы: ферменты, витамины, гармоны.
Слайд 29Очень «мягкие»: Cd2+, Pb2+, Hg2+, сильно токсичны, т.к. образуют прочные
комплексы с белком (особенно содержащие группу – SH), нарушая обмен
веществ, вызывая появление опухолей, мутагенез.Тиоловые яды
Слайд 30Детоксикацию организма от металлов токсикантов проводят при помощи лиганд-препаратов на
основе полидентатных L – хелатотератия.
Принципы хелатотерапии:
1) детоксикант (антидот) должен эффективно
связывать ионы-токсиканты; образующееся соединение должно быть прочнее, чем те, которые существовали в организме;2) антидот не должен разрушать жизненно необходимые КС; соединение детоксиканта с биометаллами должно быть менее прочным, чем существующее в организме.
Слайд 31Диссоциация комплексных соединений
Первичная диссоциация комплексных соединений - это распад КС
в растворе на ионы внешней и внутренней сфер подобно cильным
электролитам, так как эти ионы связаны ионными (электростатическими) силами.Вторичная диссоциация комплексного соединения – это распад внутренней сферы на составляющие ее компоненты. Этот процесс протекает по типу слабых электролитов, так как частицы внутренней сферы связаны ковалентной связью.
Слайд 32Устойчивость комплексных соединений
Для качественной характеристики устойчивости КС
используют:
1) константу нестойкости комплекса (Кнест).
Чем меньше значение Кн, тем более устойчивым является КС.
2) константу устойчивости (Kуст) - величина, обратная Кн.
.
Чем больше значение Куст, тем более устойчивый комплекс.
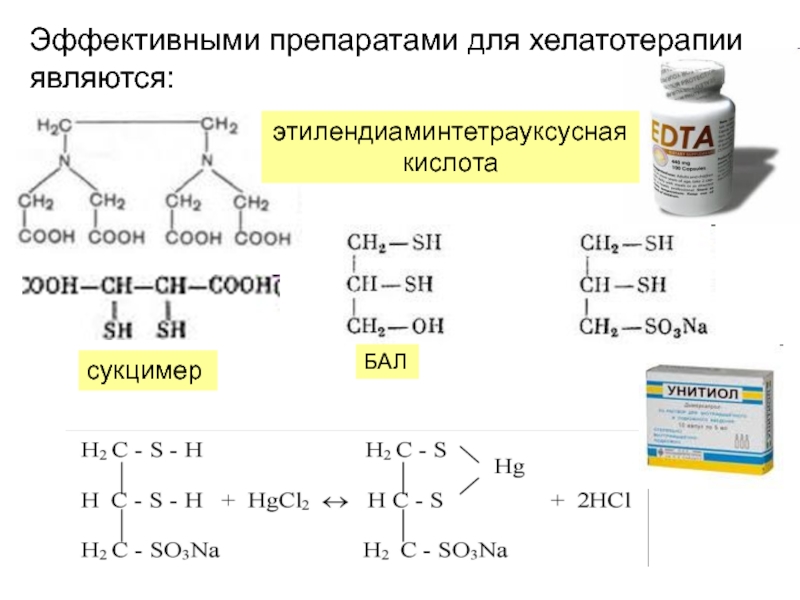
Слайд 33Эффективными препаратами для хелатотерапии являются:
этилендиаминтетрауксусная кислота
сукцимер
БАЛ
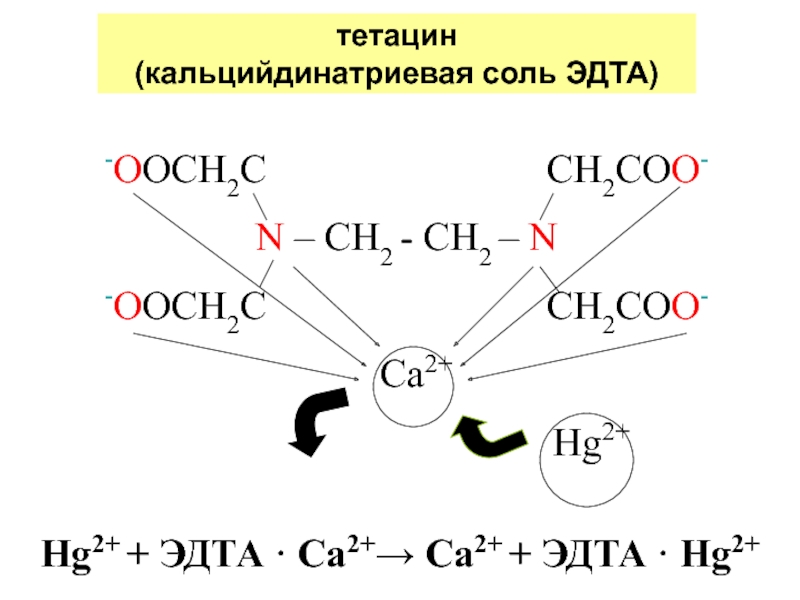
Слайд 34тетацин
(кальцийдинатриевая соль ЭДТА)
-OOCH2C
CH2COO-
N – CH2
- CH2 – N-OOCH2C CH2COO-
Сa2+
Hg2+
Hg2+ + ЭДТА · Ca2+ Ca2+ + ЭДТА · Hg2+
Слайд 38Геометрическая изомерия
Плоскоквадратные комплексы при наличии двух разных лигандов L и
L дают 2 изомера (цис- и транс-).
Слайд 39Междусферная изомерия:
1) сольватная (гидратная); 2) ионная изомерия
[Co(en)2Cl2]Cl · H2O
[Co(H2O)(en)2Cl]Cl2
[Co(NH3)5I]SO4
[Co(NH3)5SO4]I
1
Cl–; H2O (AgCl)
2 Cl– (2 AgCl)
SO42– (BaSO4)
I– (AgI)
Слайд 40Междусферная изомерия
Ионные (ионизационные) изомеры
[Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2
[Pt(NH3)4SO4](OH)2 и [Pt(NH3)4(OH)2]SO4
pH 7
pH 7Координационные изомеры
[Cr(NH3)4(NCS)2][Cr(NH3)2(NCS)4]
[Cr(NH3)6][Cr(NCS)6]

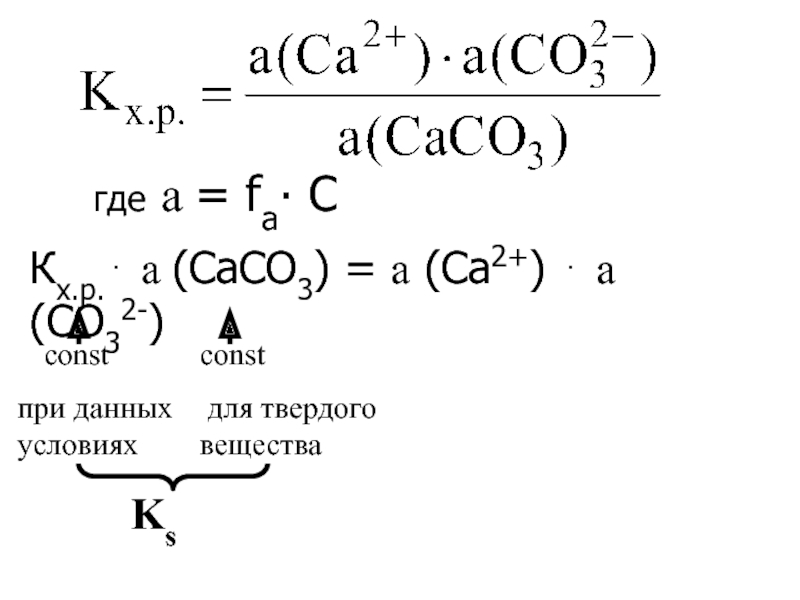








![Лекция 2. Гетерогенные реакции в растворах электролитов [ Ag (NH3)2]внутренняя сферавнешняя сферакомплексообразовательлиганды (от лат. ligare – связывать, соединять)Комплексные [ Ag (NH3)2]внутренняя сферавнешняя сферакомплексообразовательлиганды (от лат. ligare – связывать, соединять)Комплексные соединения – устойчивые химические соединения сложного](/img/thumbs/8783d6fb0b370dd130ca070ac63f0b4d-800x.jpg)






![Лекция 2. Гетерогенные реакции в растворах электролитов Междусферная изомерия: 1) сольватная (гидратная); 2) ионная изомерия [Co(en)2Cl2]Cl · H2O[Co(H2O)(en)2Cl]Cl2[Co(NH3)5I]SO4[Co(NH3)5SO4]I1 Междусферная изомерия: 1) сольватная (гидратная); 2) ионная изомерия [Co(en)2Cl2]Cl · H2O[Co(H2O)(en)2Cl]Cl2[Co(NH3)5I]SO4[Co(NH3)5SO4]I1 Cl–; H2O (AgCl)2 Cl– (2 AgCl)SO42–](/img/thumbs/5a369c05c4cf3026f7917da36d1ac16b-800x.jpg)
![Лекция 2. Гетерогенные реакции в растворах электролитов Междусферная изомерияИонные (ионизационные) изомеры [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2[Pt(NH3)4SO4](OH)2 и [Pt(NH3)4(OH)2]SO4 Междусферная изомерияИонные (ионизационные) изомеры [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2[Pt(NH3)4SO4](OH)2 и [Pt(NH3)4(OH)2]SO4 pH 7](/img/thumbs/8ac009426bc753c17c4f7620115c4137-800x.jpg)



















