Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 7
Содержание
- 1. Лекция 7
- 2. План лекцииХимические элементыТипы связейВопросыСписок литературы
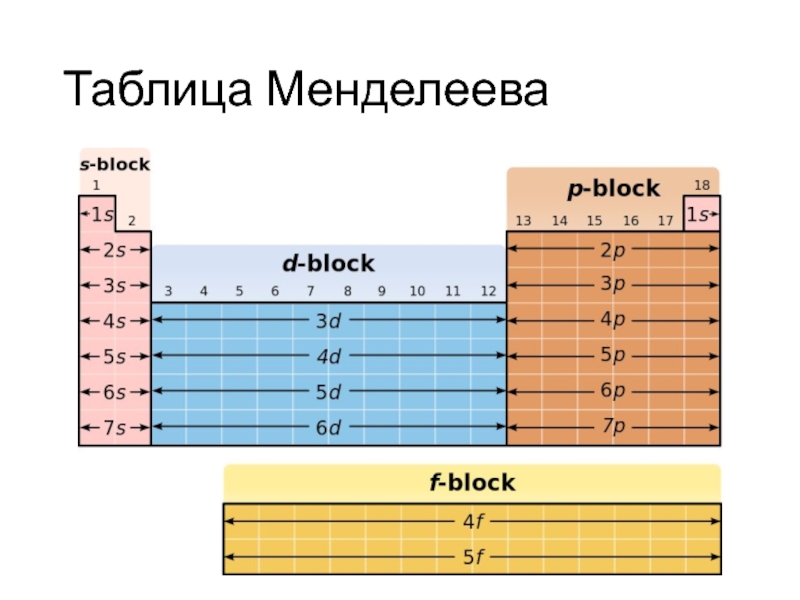
- 3. Таблица Менделеева
- 4. Таблица Менделеева
- 5. Таблица Менделеева
- 6. Атомные орбитали
- 7. Распространенность элементов в Солнечной системеhttp://commons.wikimedia.org/wiki/File:SolarSystemAbundances.jpg
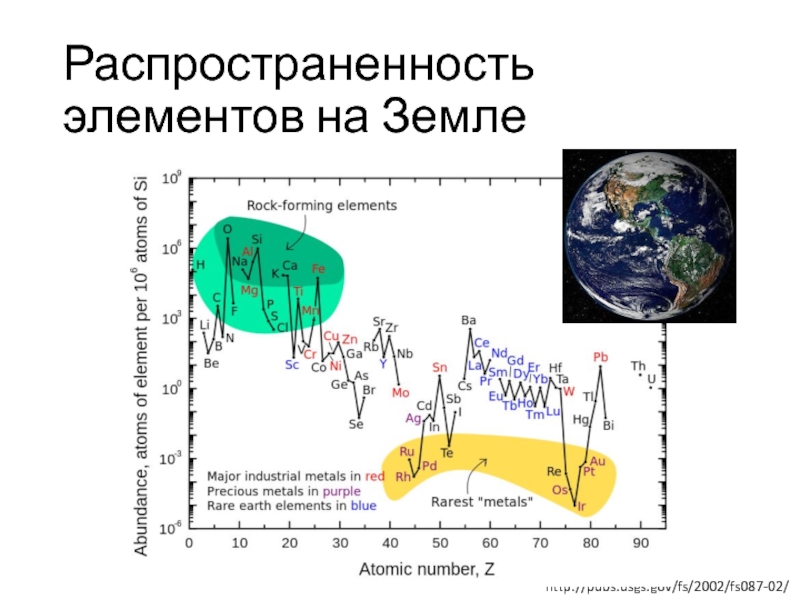
- 8. Распространенность элементов на Землеhttp://pubs.usgs.gov/fs/2002/fs087-02/
- 9. Химическая связьХимическая связь – взаимное притяжение атомов, приводящее к образованию молекул, кристаллов, конденсированной фазы.
- 10. Химическая связьТип связи определяет электронные свойстваТип связи
- 11. Типы химических связейСилы Ван-дер-Ваальса Ионная связьКовалентная связьМеталлическая связьВодородная связь
- 12. Силы Ван-дер-Ваальса Силы межатомного (межмолекулярного взаимодействия) с
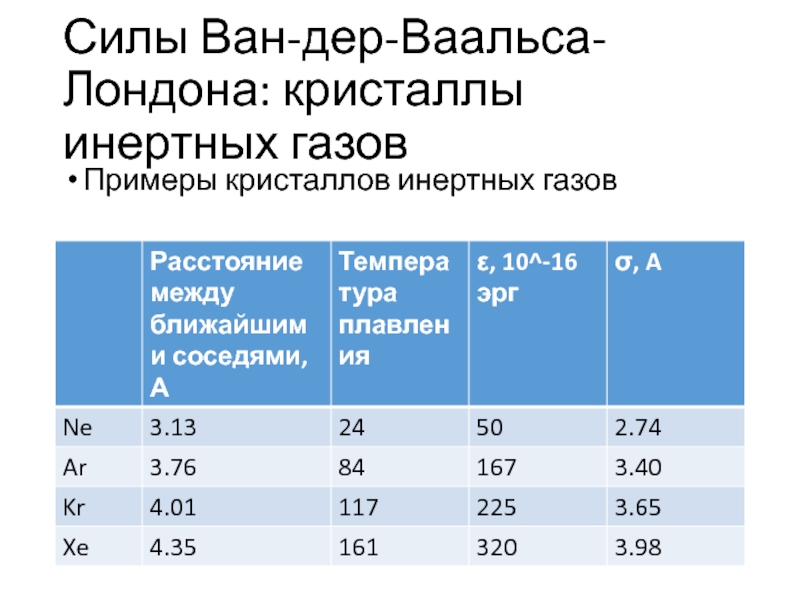
- 13. Силы Ван-дер-Ваальса-Лондона: кристаллы инертных газов
- 14. Силы Ван-дер-Ваальса-Лондона: кристаллы инертных газов
- 15. Силы Ван-дер-Ваальса-Лондона: кристаллы инертных газовПримеры кристаллов инертных газов
- 16. Ионная связьИонная связь - очень прочная химическая
- 17. Электростатическая энергия или энергия Маделунга
- 18. Постоянная Маделунга
- 19. Объемный модуль упругости
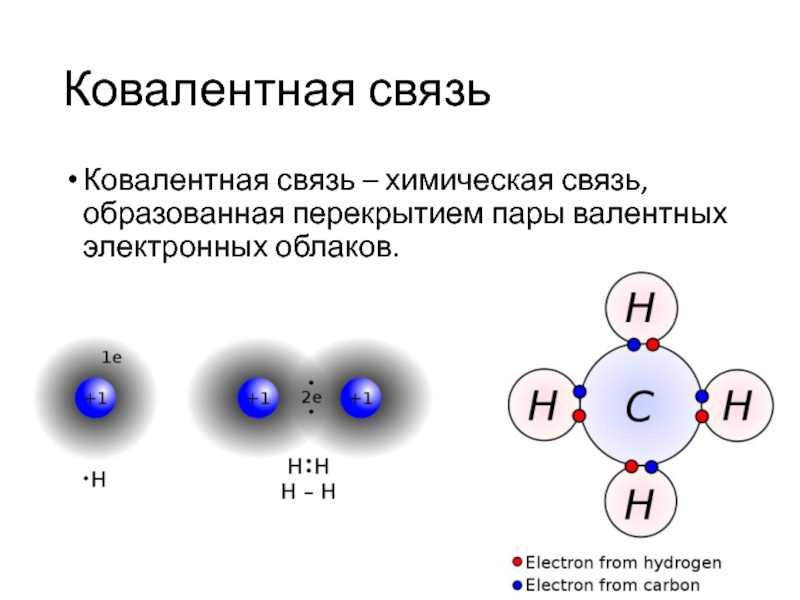
- 20. Ковалентная связьКовалентная связь – химическая связь, образованная перекрытием пары валентных электронных облаков.
- 21. Ковалентная связьХарактерные свойства - направленность, насыщаемость, полярность,
- 22. Металлическая связьХимическая связь между атомами, возникающая за
- 23. Водородная связьОбразование связи электроотрицательного иона с атомом
- 24. ВопросыПолучить постоянную Маделунга для первых трех координационных сфер кристалла NaCl.Оценить объемный модуль для кристалла Xe
- 25. Список литературыФизико-химический основы материаловедения. // Г. Готтштайн (2009).Материаловедение. // Адаскин, Седов, Онегина, Климов (2005).
- 26. Скачать презентанцию
План лекцииХимические элементыТипы связейВопросыСписок литературы
Слайды и текст этой презентации
Слайд 7Распространенность элементов в Солнечной системе
http://commons.wikimedia.org/wiki/File:SolarSystemAbundances.jpg
Слайд 9Химическая связь
Химическая связь – взаимное притяжение атомов, приводящее к образованию
молекул, кристаллов, конденсированной фазы.
Слайд 10Химическая связь
Тип связи определяет электронные свойства
Тип связи определяет колебательные свойства
Энергия
связи определяет характерную величину взаимодействия, необходимую для воздействия на связь
(температура плавления, энергия сублимации и т.д.)Слайд 11Типы химических связей
Силы Ван-дер-Ваальса
Ионная связь
Ковалентная связь
Металлическая связь
Водородная связь
Слайд 12Силы Ван-дер-Ваальса
Силы межатомного (межмолекулярного взаимодействия) с энергией 10-20 кДж/моль.
Классификация
ван-дер-ваальсовых сил
Ориентационные силы, диполь-дипольное притяжение. Энергия такого взаимодействия обратно пропорциональна
кубу расстояния между диполями.Дисперсионное притяжение (лондоновские силы). Взаимодействием между мгновенным и наведенным диполем. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным (индуцированным)
Слайд 16Ионная связь
Ионная связь - очень прочная химическая связь, образующаяся между
атомами с большой разностью электроотрицательностью, при которой общая электронная пара
переходит преимущественно к атому с большей электроотрицательностью.Слайд 20Ковалентная связь
Ковалентная связь – химическая связь, образованная перекрытием пары валентных
электронных облаков.
Слайд 21Ковалентная связь
Характерные свойства - направленность, насыщаемость, полярность, поляризуемость.
Насыщенность - способность
атомов образовывать ограниченное число ковалентных связей.
Полярность связи связи обусловлена
неравномерным распределением электронной плотности.Валентность – число химических связей.