Слайд 1Лекция № 12
Энергетика мышечного сокращения. Ферменты в толстых нитях
поперечно-полосатых мышц позвоночных
Курс лекций по дисциплине
«Структурные и функциональные особенности
поперечно-полосатых и гладких мышц»
Институт теоретической и экспериментальной
биофизики РАН
(ИТЭБ РАН)
Слайд 21. Что такое электромеханическое сопряжение (ЭМС)?
2. Какая концентрация ионов
кальция в покоящихся мышечных клетках?
Вопросы для мини-проверки
3. Почему необходимо
поддерживать низкий уровень кальция в покое?
4. Перечислите механизмы, поддерживающие низкий уровень кальция в покое ?
5. 0,2 микромоля: сколько это наномолей?
6. Для какой мышцы запуск сокращения инициируется входом ионов натрия и кальция?
- сердечной;
-скелетной;
- гладкой.
Слайд 37. Какова длительность ПД в скелетных мышцах,
сердечной и гладких мышцах?
8. Что такое EF-hand белки?
9. Назовите 2 типа регуляции
мышечного сокращения.
10. В скелетных мышцах позвоночных какой тип регуляции – основной, а какой – вспомогательный?
Слайд 4Энергетика сокращения
Источником энергии для сокращения и расслабления служит АТФ.
На
головках миозина есть каталитические центры, расщепляющие АТФ до АДФ и
неорганического фосфата. Т.е., миозин является одновременно структурным белком, сократительным белком и ферментом АТФ-азой.
Активность миозина как АТФ-азы значительно возрастает при его взаимодействии с актином. При каждом цикле взаимодействия актина с головкой миозином расщепляется 1 молекула АТФ. Следовательно, чем больше мостиков переходят в активное состояние, тем больше расщепляется АТФ, тем сильнее сокращение. Для стимуляции АТФ-азной активности миозина требуются ионы кальция, выделяющиеся из саркоплазматического ретикулума (СР), которые способствуют освобождению активных центров актина от тропомиозина.
Слайд 5Запасы АТФ в мышечном волокне ограничены, они обеспечивают выполнение физической
нагрузки не более 1-2 с.
При продолжительной мышечной работе АТФ
должна восстанавливаться с той же скоростью, с какой расходуется. Энергия, необходимая для ресинтеза АТФ, высвобождается в процессе расщепления энергосубстратов (белков, липидов, углеводов).
Ресинтез (восстановление) АТФ может происходить анаэробно (без участия кислорода в саркоплазме) и аэробно (при участии кислорода в митохондриях):
в клетке имеются фосфагенная, гликолитическая и окислительная энергетическая системы.
Слайд 61. Фосфагенная энергосистема – первый энергетический резерв мышечного волокна.
К
фосфагенам относятся АТФ и КрФ (креатинфосфат).
Креатинфосфат – быстрый источник
восстановления АТФ: КрФ анаэробно распадается на креатин (Кр) и остаток фосфорной кислоты (Ф), высвобождаемая энергия немедленно используется на ресинтез АТФ.
На мембране митохондрий происходит следующая реакция: АТФ + креатин =АДФ + креатинфосфат. Эту реакцию контролирует известный всем фермент – креатинфосфокиназа (КФК).
Слайд 7Фосфагенная система обеспечивает мышечные усилия «взрывного» характера (спринтерский бег, прыжки,
метание, подъем штанги и т.д.).
Емкость невелика – работа может
продолжаться не более 5-6 с при максимальных мышечных усилиях. Для более продолжительной мышечной работы используется вторая энергетическая система – гликолиз.
Слайд 82. гликолитическая энергосистема.
В основе ее лежит расщепление анаэробно глюкозы или
гликогена до молочной кислоты (выход – 2-3 молекулы АТФ).
Ферменты гликолиза
рассредоточены в саркоплазме мышечных волокон, уровень молочной кислоты по принципу обратной связи регулирует гликолиз.
С6Н12О6=2С3Н6О3+Q.
Энергосистема включается в самом начале мышечной работы и достигает максимальной мощности через 30-40 с. Гликолиз играет решающую роль в энергообеспечении работы большой мощности (в беге на дистанцию 200-800 м, при статических напряжениях, при ускорениях, в самом начале любой работы при недостатке кислорода).
Слайд 9Высокий уровень молочной кислоты и несостоятельность щелочного резерва крови является
ведущим звеном в периферических механизмах утомления: затрудняется выход кальция из
саркоплазматической сети мышечных волокон, снижается АТФ-азная активность миозина, не происходит присоединения мостиков миозина к актину, в общем, снижаются сократительные способности мышц.
В анаэробном процессе пировиноградная кислота восстанавливается до молочной кислоты (лактата), поэтому в микробиологии анаэробный гликолиз называют молочнокислым брожением.
Лактат далее ни во что не превращается, единственная возможность утилизовать лактат – это окислить его обратно в пируват.
Слайд 10Реакции, происходящие с участием кислорода, получили название аэробных.
Окисление –
аэробный путь ресинтеза АТФ протекает в митохондриях!
Образование энергии и восстановление
запасов АТФ в этом случае происходит за счет окисления углеводов и жиров. При этом образуются углекислый газ и вода.
Часть энергии расходуется на восстановление молочной кислоты в глюкозу и гликоген.
При этом обеспечивается ресинтез АТФ.
3. Окислительная энергетическая система
Слайд 11При окислении 1 молекулы глюкозы до конечных продуктов (воды и
углекислого газа) ресинтезируется 36 молекул АТФ, т.е. емкость окисления почти
в 20 раз выше, чем емкость гликолиза.
Окислительная энергосистема обеспечивает возможность выполнения продолжительной по времени мышечной работы до многих часов.
Для преобразования энергии, заключенной в жирных кислотах, в энергию связей АТФ существует метаболический путь окисления жирных кислот до СО2 и воды, тесно связанный с циклом трикарбоновых кислот и дыхательной цепью. Этот путь называется β-окисление.
Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие в цитозоль из крови или появляющиеся при липолизе собственных внутриклеточных ТАГ (триацилглицеролы, триглицериды, триацилглицерины, нейтральные жиры).
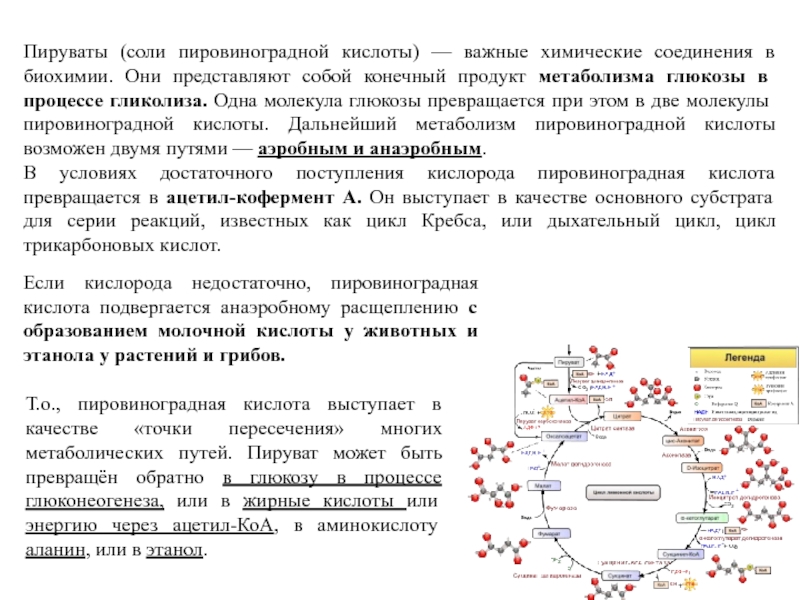
Слайд 12Пируваты (соли пировиноградной кислоты) — важные химические соединения в биохимии.
Они представляют собой конечный продукт метаболизма глюкозы в процессе гликолиза.
Одна молекула глюкозы превращается при этом в две молекулы пировиноградной кислоты. Дальнейший метаболизм пировиноградной кислоты возможен двумя путями — аэробным и анаэробным.
В условиях достаточного поступления кислорода пировиноградная кислота превращается в ацетил-кофермент А. Он выступает в качестве основного субстрата для серии реакций, известных как цикл Кребса, или дыхательный цикл, цикл трикарбоновых кислот.
Если кислорода недостаточно, пировиноградная кислота подвергается анаэробному расщеплению с образованием молочной кислоты у животных и этанола у растений и грибов.
Т.о., пировиноградная кислота выступает в качестве «точки пересечения» многих метаболических путей. Пируват может быть превращён обратно в глюкозу в процессе глюконеогенеза, или в жирные кислоты или энергию через ацетил-КоА, в аминокислоту аланин, или в этанол.
Слайд 13Электроно-транспортная цепь митохондрий является местом проведения окислительного фосфорилирования у эукариот.
NADH и сукцинат, образовавшиеся в ходе цикла трикарбоновых кислот, окисляются,
и их энергия передаётся АТР-синтазе, которая за её счёт синтезирует АТР.
Энергия, выделяющаяся при движении электронов по электронно-транспортной цепи (ЭТЦ), используется для транспорта протонов через внутреннюю митохондриальную мембрану в межмембранное пространство. Таким образом накапливается потенциальная энергия, слагающаяся из протонного градиента и электрического потенциала. Эта энергия высвобождается при возвращении протонов обратно в митохондриальный матрикс по их электрохимическому градиенту. Это возвращение происходит через особый белковый комплекс — АТФ-синтазу; сам процесс перемещения протонов по их электрохимическому градиенту получил название хемиосмос. АТФ-синтаза использует выделяющуюся при хемиосмосе энергию для синтеза АТФ из АДФ в ходе реакции фосфорилирования. Эта реакция запускается потоком протонов, которые вызывают вращение части АТФ-синтазы; таким образом, АТФ-синтаза работает как вращающийся молекулярный мотор.

Слайд 14После смерти содержание АТФ в клетках быстро снижается и когда
становится ниже критического, поперечные мостики миозина не могут отсоединиться от
актиновых нитей. Возникает трупное окоченение.
АТФ также необходима для расслабления потому, что обеспечивает работу кальциевого насоса.
Слайд 15Ферменты в толстых нитях поперечно-полосатых
мышц позвоночных
Известно, что толстая
(миозиновая) нить поперечно-полосатых мышц позвоночных помимо основного белка миозина содержит
ряд белков немиозиновой природы. Их принято называть минорными белками, так как их общее количество не превышает 5-10% от веса миозина.
Среди этих белков выявлены как белки саркомерного цитоскелета (титинового семейства), так и ферменты.
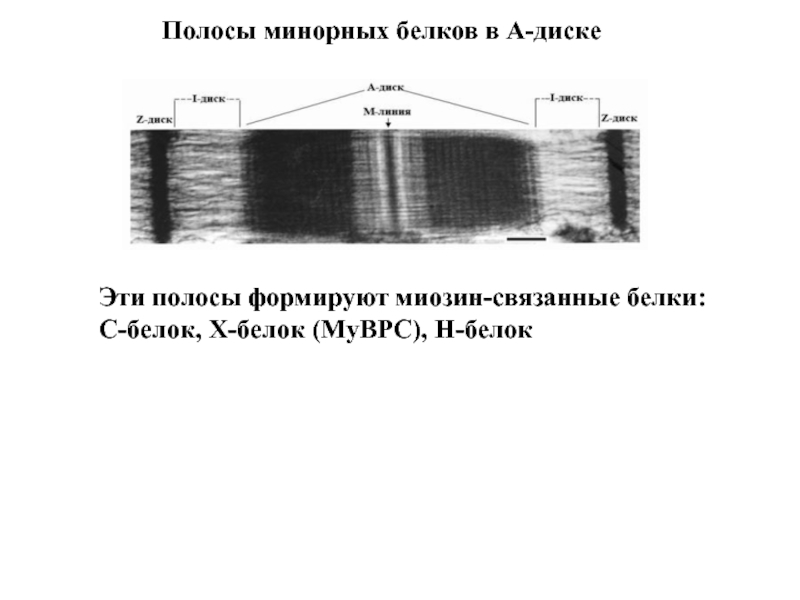
Слайд 16Полосы минорных белков в А-диске
Эти полосы формируют миозин-связанные белки:
С-белок,
Х-белок (MyBPC), Н-белок
Слайд 17ЭМ исследование формы и размеров молекул С-белка
Подлубная, 1990.
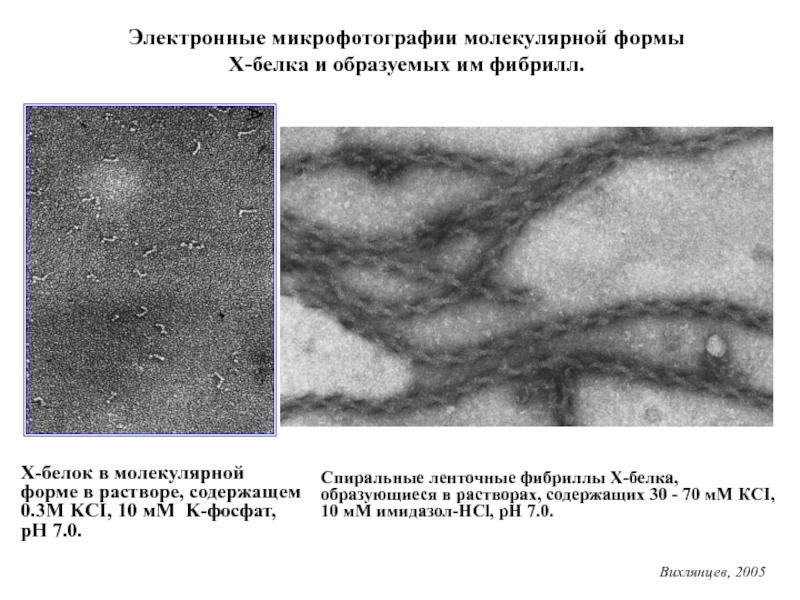
Слайд 18Х-белок в молекулярной форме в растворе, содержащем 0.3М KCI, 10
мМ K-фосфат, pH 7.0.
Электронные микрофотографии молекулярной формы
Х-белка и образуемых
им фибрилл.
Спиральные ленточные фибриллы Х-белка, образующиеся в растворах, содержащих 30 - 70 мМ КCI, 10 мМ имидазол-НСl, pH 7.0.
Вихлянцев, 2005
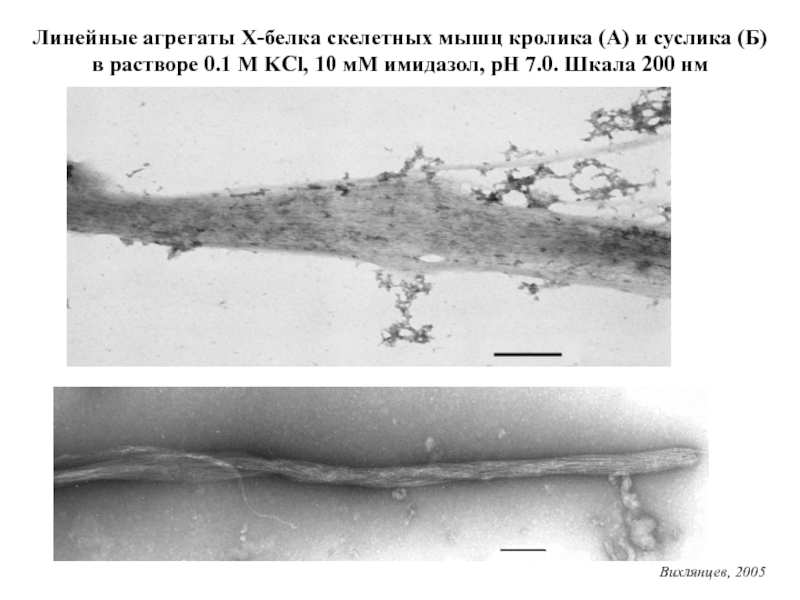
Слайд 19Линейные агрегаты Х-белка скелетных мышц кролика (А) и суслика (Б)
в
растворе 0.1 М KCl, 10 мМ имидазол, рН 7.0. Шкала
200 нм
Вихлянцев, 2005
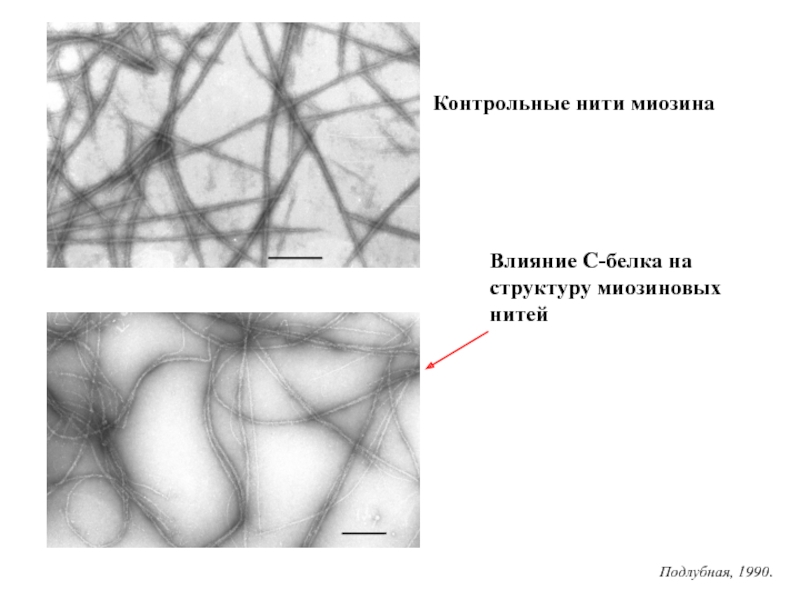
Слайд 20Влияние С-белка на структуру миозиновых нитей
Контрольные нити миозина
Подлубная, 1990.
Слайд 21Ферменты, связанные с толстыми нитями
Как оказалось, толстые нити - это
биологическая подложка для ферментативных систем, сопряженных с АТФазой миозина!
Слайд 22Первый фермент – Креатинкиназа
Фермент, катализирующий реакцию переноса фосфорильного остатка
с креатинфосфата на ADP, в результате
Известны 4 изоформы КК:
ММ – в скелетных мышцах и сердце
ВВ – в мозге и сердце
МВ – в сердце
MiMi – митохондриальная форма, катализирует реакцию образования креатинфосфата.
Слайд 23Локализация креатинкиназы: в цитоплазме и М-линии саркомера.
предполагается, что фермент
может связываться по всей длине толстых нитей.
А зачем это? Какое
физиологическое значение такого связывания?
Т.о., креатинкиназа – ambiquitous фермент, присутствует не только в растворенной форме (в цитоплазме), но и в связанной (с миозиновыми нитями), находясь у стратегически важных участков мышечной клетки.
Слайд 24Функции креатинкиназы:
Структурная (в М-линии)
Ферментативная, заключающаяся в обеспечении быстрого ресинтеза
АТФ.
Активация креатинкиназы начинается после накопления ADP и Н+,
при повышении работы АТФазы миозина.
А по мере расходования креатинфосфата начинают активироваться и другие системы ресинтеза и синтеза АТФ
Например, аденилаткиназа, катализирующая реакцию:
2ADP ----- AMP + ATP
Слайд 25Второй фермент – АМФ-дезаминаза (тоже ambiquitous фермент)
Катализирует реакцию дезаминирования (процесс
удаления аминогрупп NH2) адениловой кислоты до инозиновой с выделением аммиака
AMP + H2O ------ IMP + NH3.
Её активность особенно высока в скелетных мышцах.
Но также обнаружен в эритроцитах, сердце, мозге, печени.
По данным ЭМ фермент связывается с миозиновыми нитями по всей их длине в саркомере, кроме «голой» зоны, но больше всего связывается на концах миозиновых нитей на каждом краю в А-диске.
Слайд 26Функциональное значение АМФ-дезаминазы не ясно. Возможно этот фермент участвует в
цикле пуриновых нуклеотидов (АТФ, АДФ, АМФ, поддержании их баланса).
Аммиак
может регулировать активность фосфофруктокиназы и пируваткиназы – основных ферментов гликолиза.
Слайд 27Третий фермент – фосфофруктокиназа или F-белок (тоже ambiquitous фермент).
Фермент, катализирующий
центральную реакцию гликолиза:
Ф6Ф + АТФ ------- ФДФ + АДФ
+ Н+
Было показано, что ФФК является постоянной примесью препаратов миозина и в виде минорного F-белка отделяется от миозина в процессе хроматографической очистки.
Как выглядит F-белок?
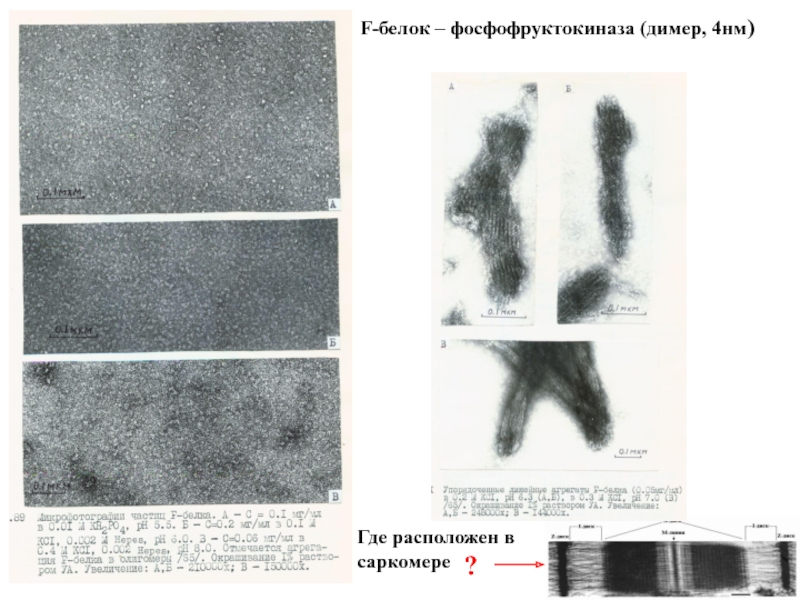
Слайд 28F-белок – фосфофруктокиназа (димер, 4нм)
Где расположен в саркомере
?
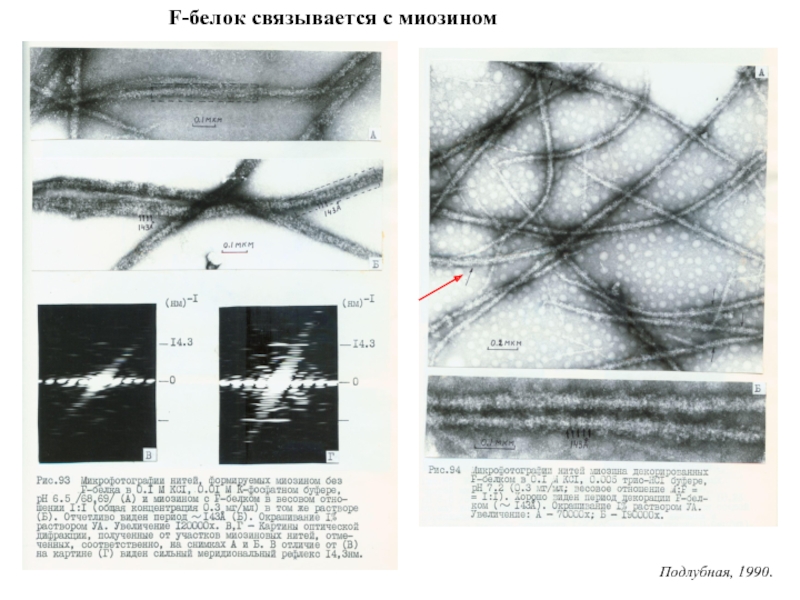
Слайд 29F-белок связывается с миозином
Подлубная, 1990.
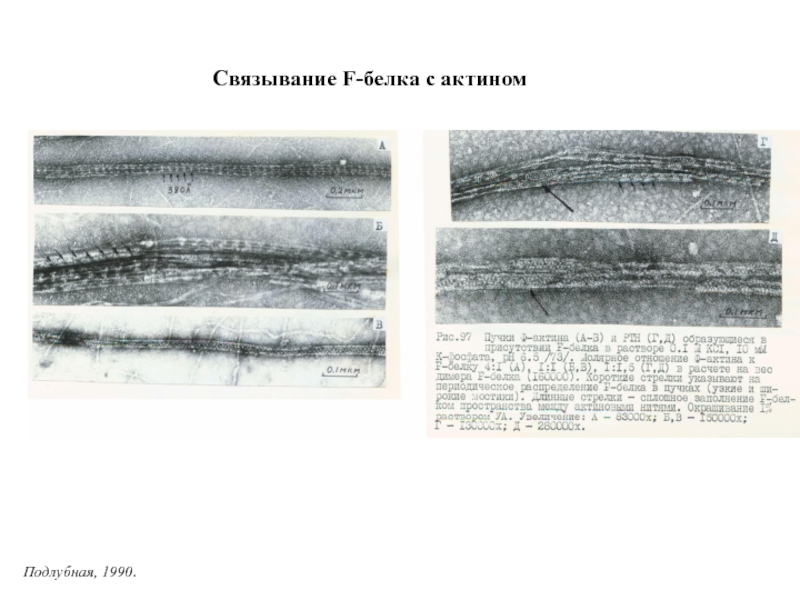
Слайд 30Связывание F-белка с актином
Подлубная, 1990.
Слайд 31Связывание F-белка в саркомере – в районе первых 2-х поперечных
полос из 11-ти.
Но!
Возможно фермент связывается и по всей
длине толстых нитей.
+ связывается с актиновыми нитями.
Подлубная, 1990.
Слайд 32Итак, резюме:
Значение адсорбции ферментов, участвующих в метаболизме энергии (т.е.,
не только трёх вышеупомянутых), на толстых нитях состоит в максимальном
их приближении к местам потребления АТФ, т.е. к головкам миозина; этим достигается уменьшение времени доставки «макроэргов» для сокращения.
Толстую нить можно рассматривать как высокоорганизованный мультиферментный комплекс, состав которого может изменяться в зависимости от функционального состояния мышечной клетки.
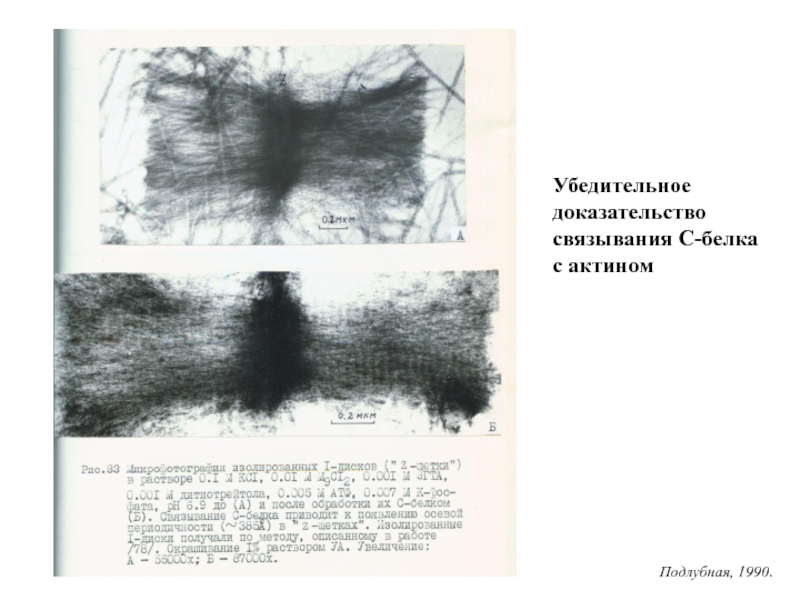
Слайд 34Убедительное доказательство связывания С-белка с актином
Подлубная, 1990.