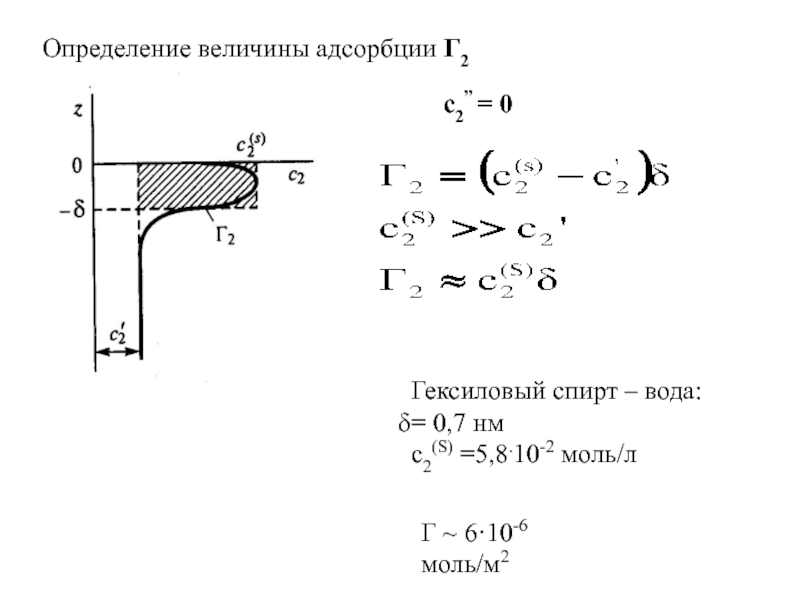
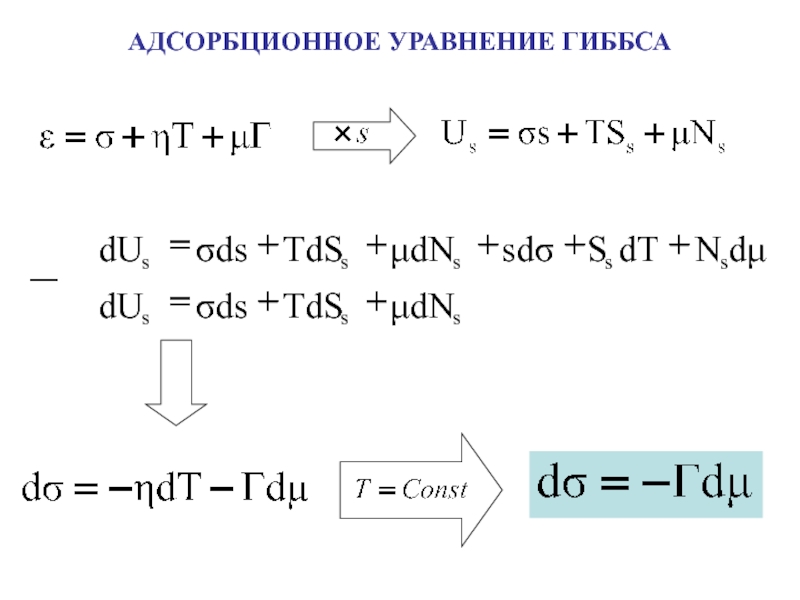
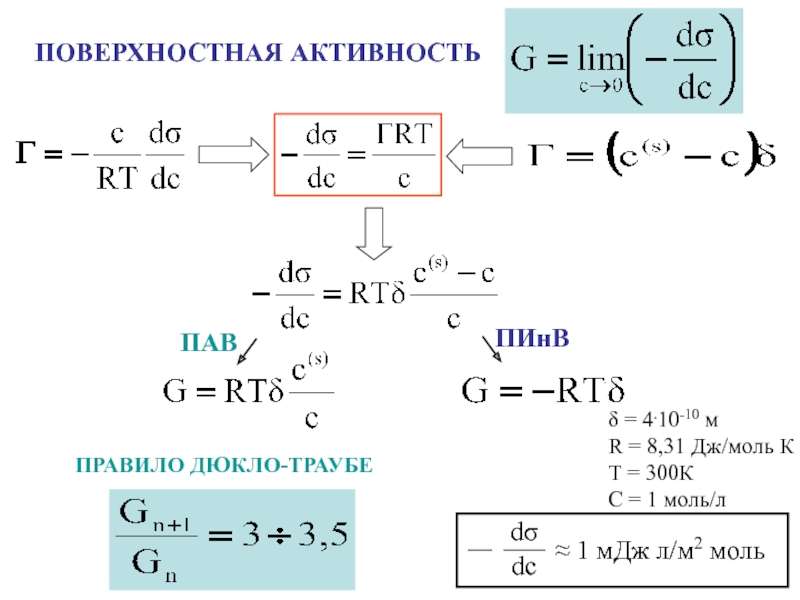
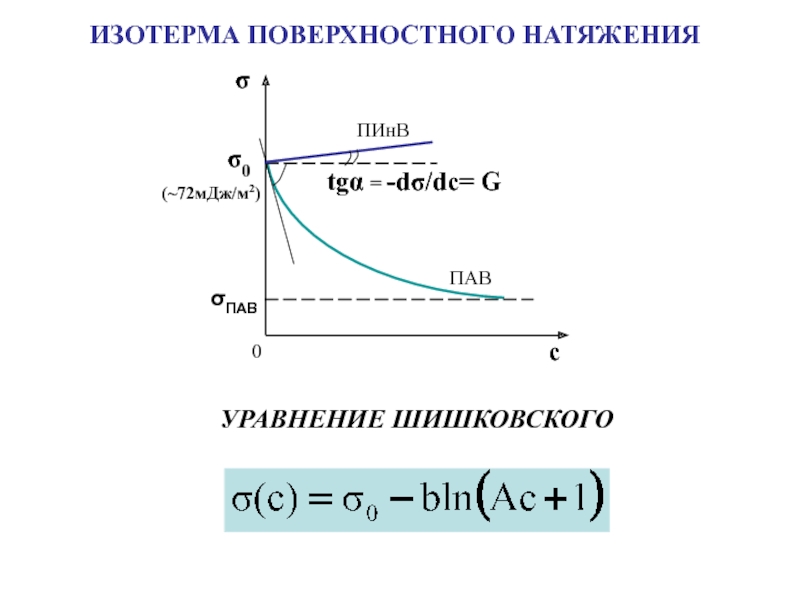
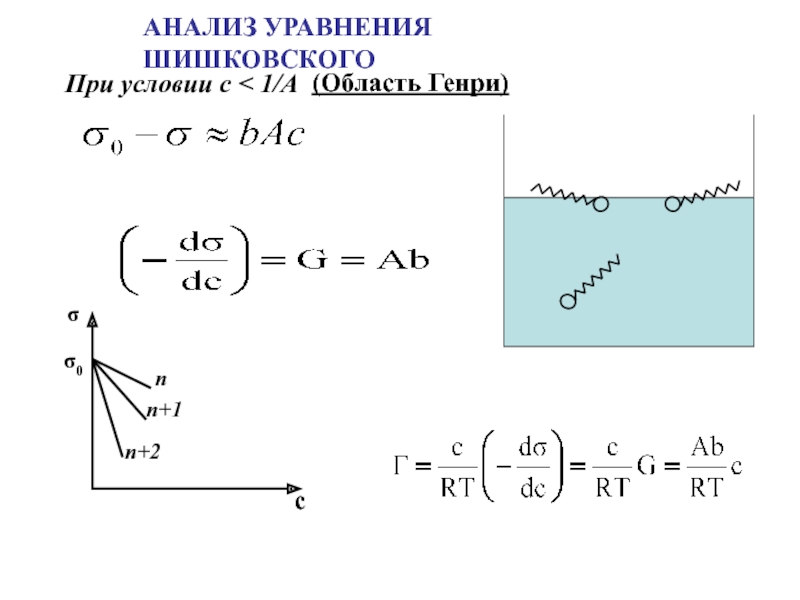
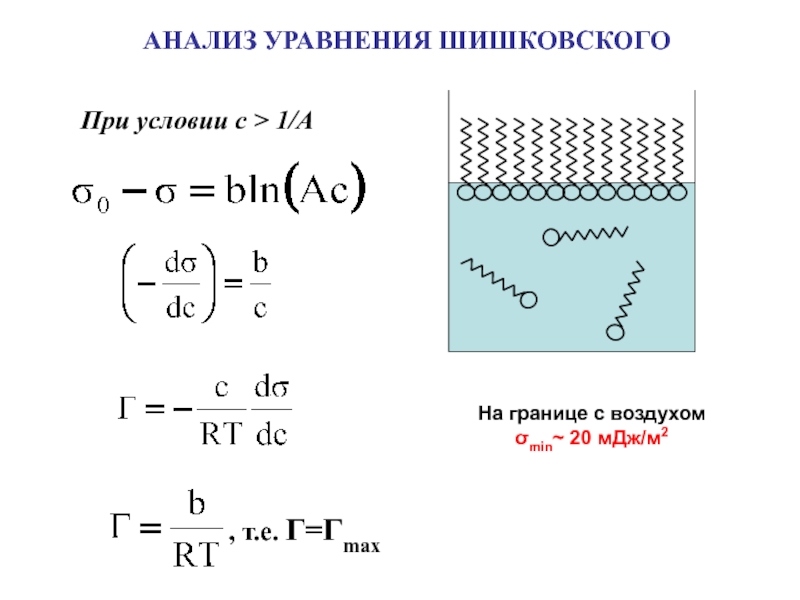
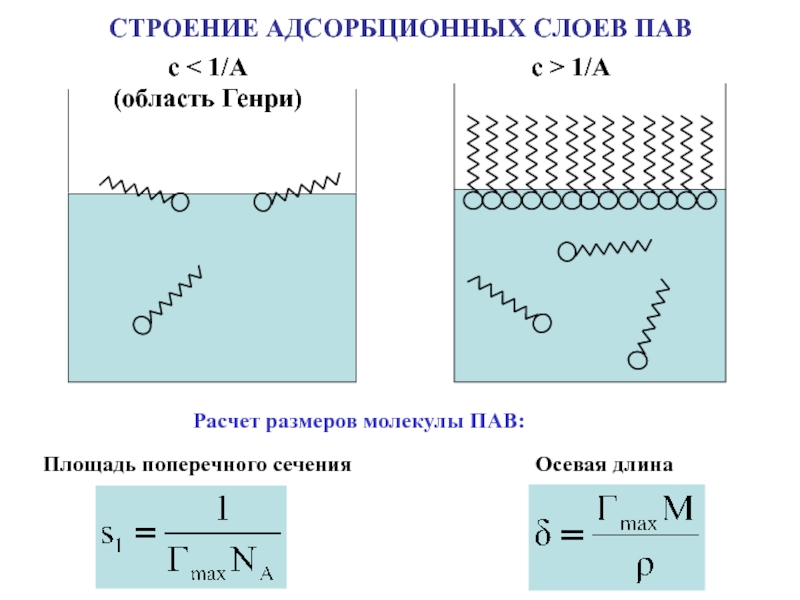
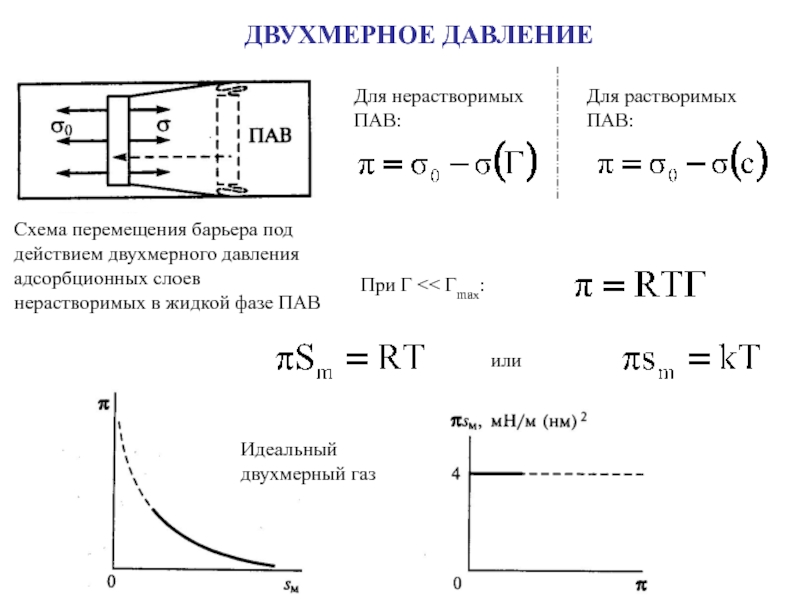
поверхности раздела фаз
n – общее число молей растворенного
веществаn’, n” – число молей растворенного вещества в каждой фазе
s - площадь поверхности раздела фаз
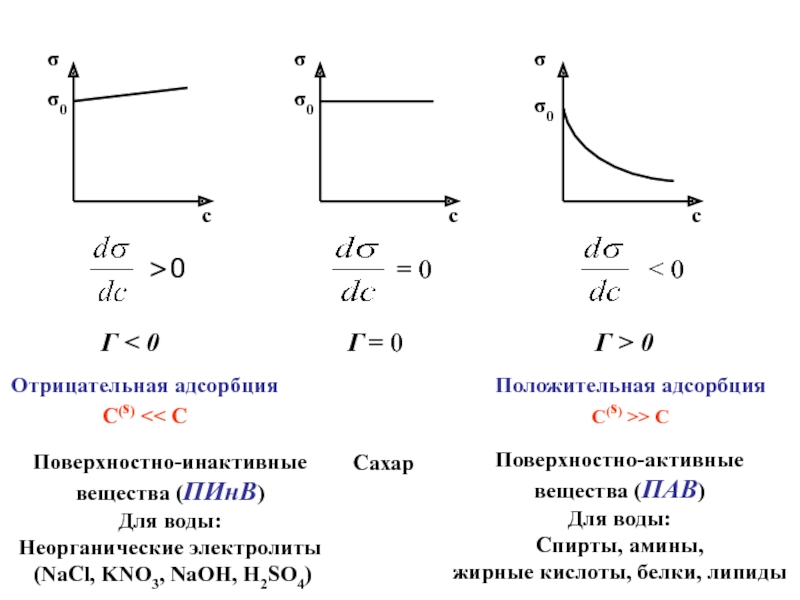
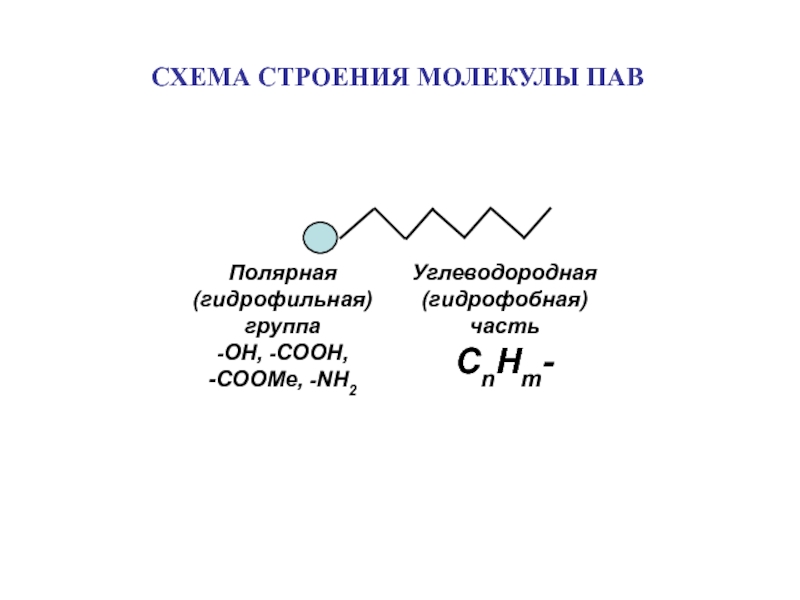
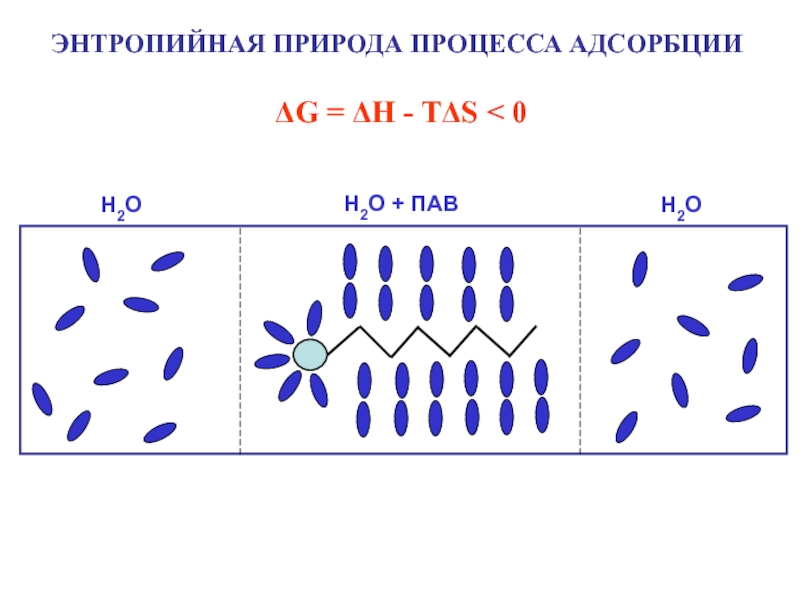
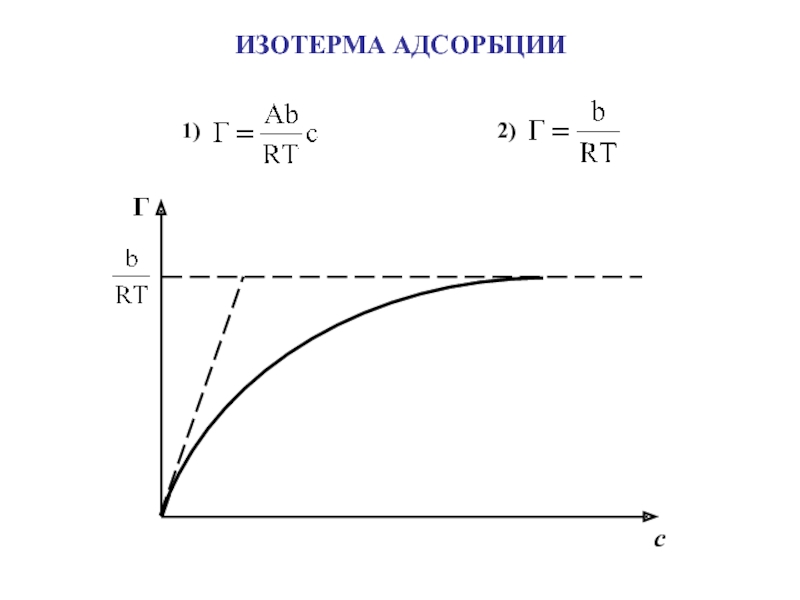
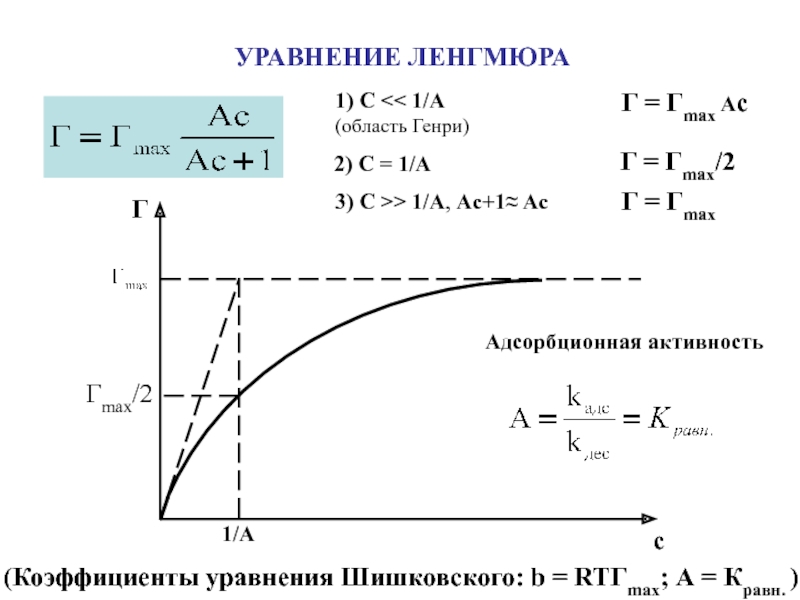
Адсорбция – самопроизвольное
концентрирование вещества на поверхности раздела фаз
[моль/м2]





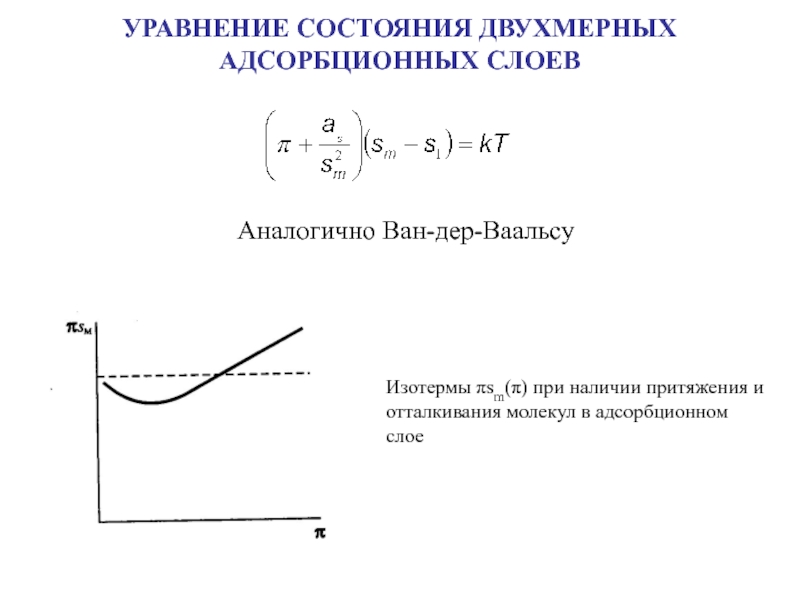
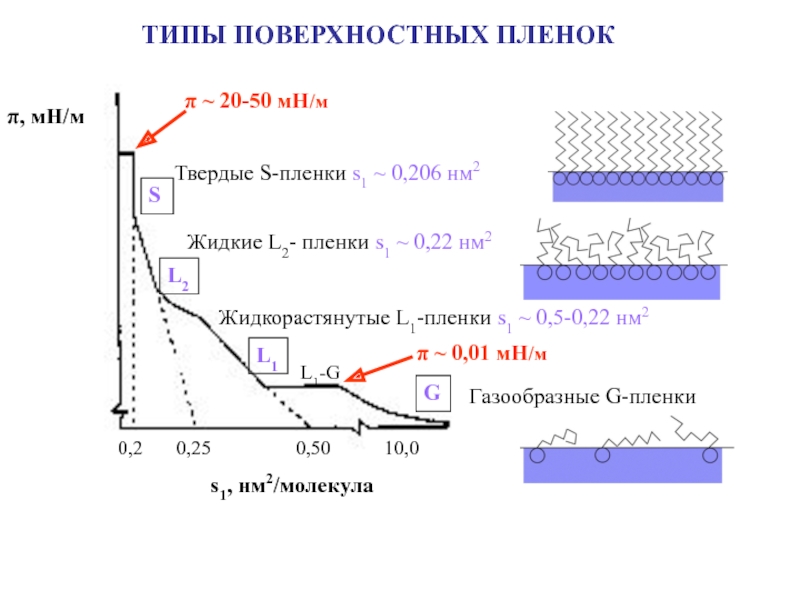
![Лекция № 4
АДСОРБЦИЯ ИЗ РАСТВОРОВ
НА РАЗНЫХ ПОВЕРХНОСТЯХ РАЗДЕЛА ФАЗ СТРУКТУРНАЯ ФОРМУЛА ФОСФОХОЛИНА: Ethanaminium, 2-[[[(2,2-dipentadecyl-1,3-dioxolan-4-yl)methoxy]hydroxyphosphinyl]oxy]-N,N,N-trimethyl-, inner salt СТРУКТУРНАЯ ФОРМУЛА ФОСФОХОЛИНА: Ethanaminium, 2-[[[(2,2-dipentadecyl-1,3-dioxolan-4-yl)methoxy]hydroxyphosphinyl]oxy]-N,N,N-trimethyl-, inner salt](/img/thumbs/caf78fbde9995adce62b0983b2d8e923-800x.jpg)